植物MYB转录因子与非生物胁迫响应研究
2014-03-25陈信波
唐 宁, 陈信波
(1. 湖南农业大学 作物基因工程湖南省重点实验室,长沙410128; 2. 湖南农业大学 生物科技学院,长沙410128)
转录因子是通过特定的方式激活或抑制目的基因的表达,使其以特定强度在特定的时间和空间表达,来调控细胞的发育、增殖和新陈代谢等生理生化反应。MYB转录因子家族是一个庞大的转录因子家族,广泛地存在于所有真核生物中。第一个MYB基因v-MYB是在禽类成髓细胞瘤病毒(avian myeloblastosis virus)中发现的一个癌基因,因此人们把这一类的基因都称为MYB基因。随后科学家还发现了它在脊椎动物体内对应的原癌基因c-MYB、A-MYB和B-MYB。随着进一步的研究,科学家们逐渐发现这一类基因存在于昆虫、真菌和霉菌等生物中。植物中第一个被发现的MYB基因是玉米中的COLORED1,它参与了玉米花青素的合成调控。动物中通常只有4~5个MYB基因,而植物中的MYB基因的数量较多,每个物种基因组内一般有100~200个[1],如拟南芥中有196个,水稻中有185个[2]。数量丰富的MYB转录因子基因主要在植物的发育、次级代谢产物的合成、植物激素信号转导以及植物对逆境的响应中起着重要的作用[3]。近年来,高温干旱等极端天气频繁出现,与此同时众多与逆境响应相关的植物MYB转录因子被分离并鉴定出功能。因此,本文将对近年来植物MYB转录因子在干旱、高温、低温和高盐等不同非生物逆境应答中作用的研究进展进行综述。
1 MYB转录因子的结构特点
MYB转录因子家族是一类含有长50~53个氨基酸残基的高度保守的MYB结构域的转录因子。一般在MYB 蛋白中含有1~3 个串联的、不完全重复的MYB 结构域(1R-、2R-和3R-MYB), MYB结构域主要是在肽链的N末端,但是近些年发现有的也存在于C末端[4]。MYB结构域序列中每隔18~19个氨基酸残基出现的色氨酸残基(或者疏水性氨基酸残基)参与了肽段空间结构中疏水核心的形成。然后,这些保守的氨基酸残基再进一步使MYB结构域折叠成螺旋-转角-螺旋(H-T-H)结构,从而形成MYB转录因子的DNA结合域。
2 MYB转录因子的分类
MYB转录因子的分类是根据MYB结构域的个数的不同。植物中的MYB 类转录因子起初被分为3个亚族(1R-、2R-和3R-MYB),但现在由于发现有4或5个MYB结构域的MYB转录因子而被分为4个亚族,分别为1R-MYB、2R-MYB(R2R3-MYB)、3R-MYB(R1R2R3-MYB)和非典型MYB[5]。原癌基因编码的c-MYB蛋白的3个MYB结构域分别为R1、R2和R3,因此其他MYB蛋白根据其结构域相似性而分类为R1、R2和R3。1R-MYB亚族在植物中数量较多,包括R1/2、MYB-related和其他一些只有一个MYB结构域的MYB转录因子,如StMYB1R-1[6]、MYBS3[7]和LcMYB1[8]。2R-MYB亚族MYB转录因子,含有两个MYB结构域,是植物中数量最多的一类MYB转录因子,因此也研究的最多,如 MYB60[9]、TaMYB30-B[10]和NbPHAN[11]。3R-MYB亚族MYB转录因子,它们含有3个MYB结构域,在植物中数量较少,如TaMYB3R1[12]。非典型MYB亚族含有4或5个MYB结构域,植物中数量稀少,一般只有1~2个,如AT3G18100和LOC_Os07g04700[5]。
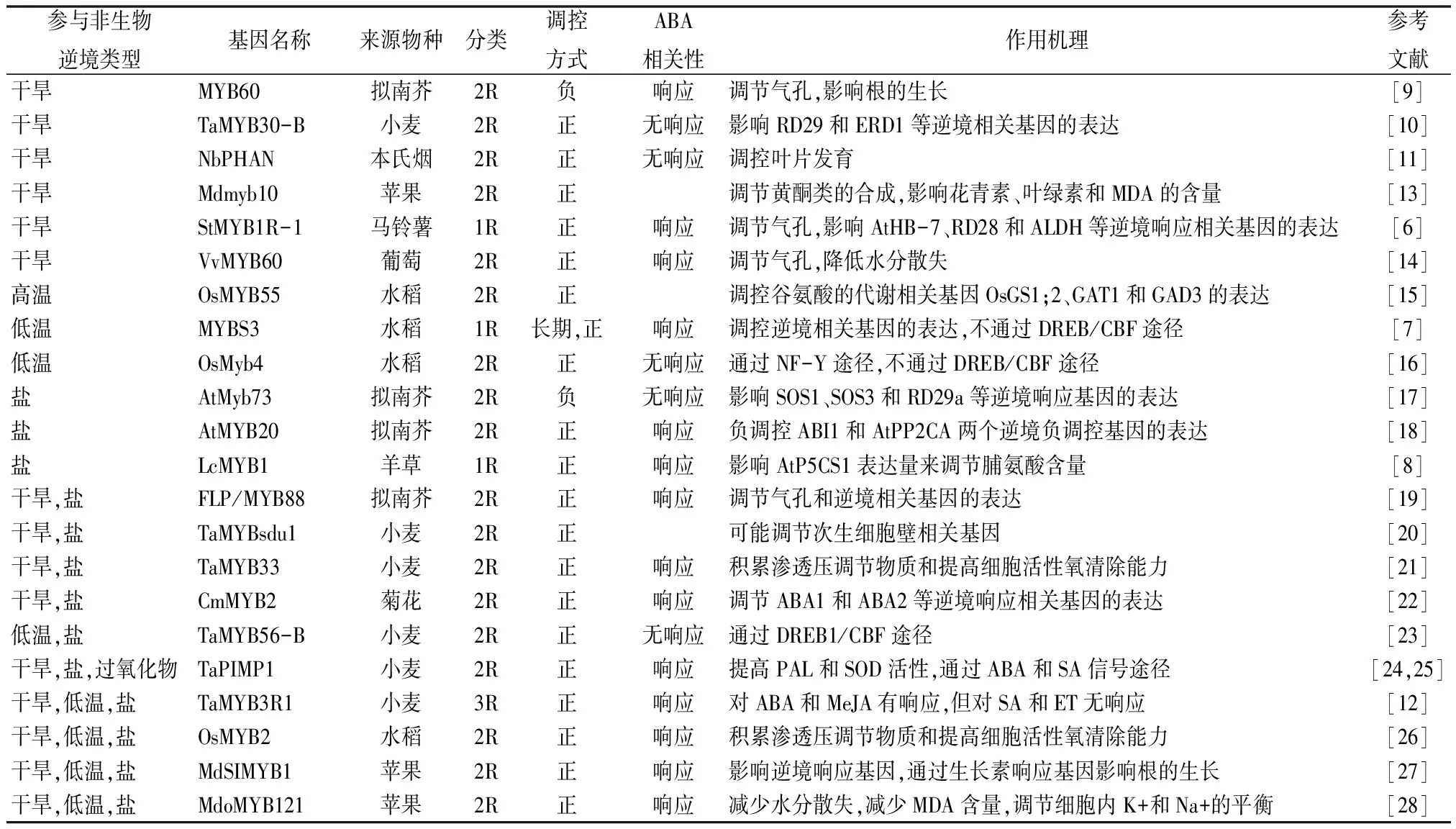
表1 近年发现的参与非生物逆境响应的植物MYB基因
3 植物MYB转录因子在非生物逆境胁迫响应中的作用
自然界中存在着多种非生物胁迫如干旱、高温、低温和高盐等,它们严重影响植物的生长和发育,并且是造成粮食生产降低的重要因素。植物对非生物逆境的响应涉及到细胞内一系列逆境响应基因的表达调控。近几年鉴定出一批新的参与各种植物非生物逆境响应的MYB转录因子,并对其作用机理进行了研究,表1为这些基因的主要作用机理。
3.1 植物MYB转录因子在干旱胁迫响应中的作用
干旱缺水是限制植物生长和作物产量的最严重因素之一。它可以引起植物体内多种生理生化反应变化,包括气孔关闭、光合作用与细胞生长的抑制以及呼吸作用的增强,与此同时植物也会在细胞和分子层面上去适应干旱胁迫,如产生逆境胁迫响应相关的蛋白,积累渗透平衡物。而这些适应都离不开逆境胁迫响应信号网络和转录因子。
脱落酸(ABA)是一种广谱植物激素不仅参与调节气孔开放,生长和发育,还协调各种逆境信号转导途径。依据与ABA的相关性,信号转导途径可分为两类:ABA依赖型和ABA非依赖型。小麦中的TaMYB33受ABA介导的逆境响应信号调控,通过积累渗透压调节物和提高细胞活性氧清除能力来提高植物对干旱和盐的耐受性[21]。而Zhang等[10]的研究发现小麦TaMYB30-B过表达植株在种子萌发和幼苗阶段相对于野生型植株表现出更好的耐旱性。但是其过表达植株对外源ABA没有响应,而且体内两个ABA非依赖型途径逆境相关基因RD29A和ERD1的表达量明显增高。这说明了MYB转录因子不仅可参与ABA依赖型途径的逆境胁迫响应,也有参与ABA非依赖型途径的逆境胁迫响应。
过去发现的参与非生物逆境响应的MYB转录因子大多为2R-MYB亚族,这是由于这个亚族数量最多,同时研究的最多。StMYB1R-1是Shin等[6]在马铃薯中发现一个含有MYB-like结构域的1R-MYB转录因子基因。干旱胁迫下StMYB1R-1过表达转基因植株的气孔关闭,水分散失减少,植物体内与干旱胁迫相关的基因AtHB-7、RD28、ALDH和ERD15的表达量上调,并表现出明显的耐旱性。Shan等[22]把菊花中的一个2R-MYB亚族基因CmMYB2转入拟南芥中,发现转基因植株的多个逆境相关基因表达上升,特别是ABA合成基因ABA1和ABA2,从而提高植株对干旱的耐受能力。TaMYB3R1是一个3R-MYB亚族的转录因子,能与MSA顺式作用原件结合,参与了干旱、盐和低温胁迫的响应[12]。以上研究表明MYB中1R-、2R-和3R-MYB都可能参与非生物逆境胁迫的响应。
3.2 植物MYB转录因子在高温胁迫响应中的作用
近年来在中国南方主要粮食产区频繁出现异常高温天气,对粮食生产造成了巨大的影响。高温直接影响着作物的生长发育,特别是生殖生长阶段雄性生殖器官的发育,这直接影响到粮食产量。高温能影响植物细胞内多种生理生化反应,如光合作用、三羧酸循环、糖酵解和黄烷酮醇与花青素的代谢等[29]。
近年来鉴定出的在高温胁迫响应中有显著作用的植物MYB转录因子很少。El-Kereamy等[15]发现OsMYB55基因的过表达能使得水稻在高温胁迫下生长发育正常且产量比未转基因对照提高。研究表明转录因子OsMYB55能直接激活OsGS1;2、GAT1和GAD1等谷氨酸代谢相关基因。OsMYB55的过量表达使转基因植株细胞内的总氨基酸、谷氨酸、γ-氨基丁酸、脯氨酸和精氨酸的含量上升,这些代谢产物直接或间接提高了植物对逆境的耐受性。
在高温胁迫下植物转录组的芯片分析结果表明有许多MYB转录因子参与了高温逆境的响应。Zhang等[30]在高温下水稻幼穗的基因表达谱分析中发现有9个(R1)R2R3,7个MYB-related和3个非典型MYB转录因子对高温有响应。Liu等[31]也在热激后葡萄叶片转录组分析中发现有MYB转录因子参与了高温胁迫响应。
3.3 植物MYB转录因子在低温胁迫响应中的作用
低温胁迫可以导致萌发率下降,幼苗发育不良,萎黄病,减少叶扩张和萎蔫,也可能导致植物组织的死亡。冷驯化可以提高植物自身在低温环境下的低温耐受性,而没有经过冷驯化的植物直接置于低温环境下会对植株造成巨大的伤害。植物的低温驯化所涉及到的转录因子调控网络包括了许多低温逆境响应的转录因子和含有对应顺式作用原件的启动子的下游基因。
Su等[6]发现MYBS3参与水稻对低温逆境的响应,但却并非通过DREB/CBF信号通路途径。与研究的较多的DREB/CBF信号通路对逆境响应快而短的特点不同,OsMYB3R-2对低温逆境响应比较慢。他们认为植物中可能存在着一条新的信号通路,与DREB/CBF信号通路形成短期和长期的低温逆境响应的互补。
不仅如此,科学家还发现了多个MYB转录因子同时参与了低温、干旱和高盐的响应。Yang等[26]研究发现OsMYB2过表达植株中可溶性糖和脯氨酸含量上升,并发现其细胞内脯氨酸合成酶和转运蛋白基因等逆境相关基因表达量上升,同时抗氧化酶的活性升高,对低温、盐害和干旱逆境胁迫的耐受性都明显增强。Cao等[28]在对苹果中与逆境响应有关的MYB转录因子研究时发现MdoMYB121的过表达能提高苹果对低温、盐害和干旱等多种非生物逆境的耐受性。这是因为植物对于逆境胁迫的响应是由一个多重复杂的信号网络调控,但是不同逆境胁迫响应所涉及到的信号传递模式却有很大的重叠,所以一些转录因子可能参与了多种逆境胁迫响应。
3.4 植物MYB转录因子在高盐胁迫响应的作用
盐害会严重影响作物的生长、发育和产量。植物通过一系列的特殊机制去适应高盐的环境,其中包括提高积累渗透调节物质,主动向细胞外排出Na+以及提高细胞抗氧化能力。
Liu等[24]从小麦中分离出的TaPIMP1参与了生物和非生物逆境的响应,它也可能是小麦中第一个被发现同时参与生物和非生物逆境响应的MYB基因。研究发现TaPIMP1转基因烟草植株中PAL和SOD的活性明显高于野生型,并对高盐、干旱、过氧化物和青枯病表现出更好的耐受性。Cheng等[8]过表达羊草LcMYB1基因的拟南芥转基因植株中参与脯氨酸生物合成中限速反应步骤的AtP5CS1表达量增高,从而使游离脯氨酸含量上升,同时细胞内可溶性糖含量升高,MDA含量降低,植株对盐害表现出更强的耐受性。Cui等[18]研究证明了AtMYB20直接作用于ABI1和AtPP2CA,通过抑制这两个ABA信号通路的负调控基因表达,增强植物对高盐的耐受性。
在发现大量对非生物逆境起正调控作用的MYB转录因子的同时,科学家们还发现了起负调控作用的MYB转录因子。Kim等[17]发现AtMyb73对高盐逆境有响应,但是对ABA没有响应,同时该基因的两个突变体atmyb73 ko和atmyb73 eko的幼苗比野生型对盐胁迫的耐受性更好。进一步研究发现突变体中ABA非依赖型盐响应基因SOS1和SOS3表达量显著升高,这说明AtMYB73可能通过SOS途径对植物盐逆境响应起负调控作用。
4 总结
植物MYB转录因子参与植物细胞内多种生理生化反应,能从多个方面参与植物对非生物逆境的应答,如调控生长发育,影响代谢产物的合成和影响激素信号等。除了以上介绍的逆境外,MYB转录因子还被证实参与了UV-B和缺磷等非生物逆境,如HbMyb1[32]和BnPHR1[33]。另外对黄酮类和花青素代谢的调控也是MYB转录因子的一个研究热点。花青素能调节渗透压的平衡,黄酮类化合物和花青素都有抗氧化和抗炎症的作用,并在植物对多种逆境胁迫环境的抵抗中发挥作用。到目前为止发现了许多调节黄酮类和花青素代谢的MYB转录因子,如SbMYBP2和SbMYBP7[34],还发现其中有一些受温度等条件调控,如MYB4[35]。而且Mdmyb10被研究发现通过调节黄酮类代谢,影响花青素的含量等途径影响植物的耐旱性[13]。这提示我们这些调节黄酮类和花青素的MYB转录因子也有可能参与植物对逆境的响应。有趣的是第一个被发现的植物MYB基因COLORED1就被证实参与了花青素的合成。
目前MYB转录因子在非生物逆境方面的研究仍主要集中于2R-MYB亚族,但是1R-和3R-MYB亚族也被发现可能参与非生物逆境的响应。在发现参与逆境响应的MYB转录因子的同时,科学家们还对部分MYB转录因子所调控的下游基因和涉及的信号途径进行了一定的研究,但是并没有清晰地描绘出一个完整的信号网络和MYB转录因子在整个调控网络中的定位。这可能是由于许多转录因子在功能上有重叠和表达水平极低时很难检测。因此对MYB转录因子所参与的信号调控网络的研究仍处于新兴阶段。随着新技术的出现,蛋白质-DNA相互作用的检测更快,分辨率更高,MYB转录因子的调控网络的研究将会飞速发展。这也能促进了对新的参与非生物逆境的MYB转录因子的发现和功能研究,为完善整个植物逆境信号网络奠定基础。同时,近年来高温干旱等极端天气频繁出现,粮食作物的稳产与高产显得同样重要,因此提高作物的耐逆性也是作物种质改造的一大方向。MYB转录因子在非生物逆境方面的研究也为抗逆境作物的基因工程改良提供了理论基础。
参考文献:
[1]Prouse M B, Campbell M M. The interaction between MYB proteins and their target DNA binding sites[J]. Biochim Biophys Acta, 2012, 1819(1): 67-77.
[2]Dubos C, Stracke R, Grotewold E, et al. MYB transcription factors inArabidopsis[J]. Trends Plant Sci, 2010(10): 573-581.
[3]Tombuloglu H, Kekec G, Sakcali M S, et al. Transcriptome-wide identification of R2R3-MYB transcription factors in barley with their boron responsive expression analysis[J]. Mol Genet Genomics, 2013, 288(3/4): 141-155.
[4]Linger B R, Price C M. Conservation of telomere protein complexes: shuffling through evolution[J]. Crit Rev Biochem Mol Biol, 2009, 44(6): 434-446.
[5]Katiyar A, Smita S, Lenka S K, et al. Genome-wide classification and expression analysis of MYB transcription factor families in rice andArabidopsis[J]. BMC Genomics, 2012, 13: 544.
[6]Shin D, Moon S J, Han S, et al. Expression of StMYB1R-1, a novel potato single MYB-like domain transcription factor, increases drought tolerance[J]. Plant Physiol, 2011, 155(1): 421-432.
[7]Su C F, Wang Y C, Hsieh T H, et al. A novel MYBS3-dependent pathway confers cold tolerance in rice[J]. Plant Physiol, 2010, 153(1): 145-158.
[8]Cheng L, Li X, Huang X, et al. Overexpression of sheepgrass R1-MYB transcription factor LcMYB1 confers salt tolerance in transgenicArabidopsis[J]. Plant Physiol Biochem, 2013, 70: 252-260.
[9]Oh J E, Kwon Y, Kim J H, et al. A dual role for MYB60 in stomatal regulation and root growth ofArabidopsisthalianaunder drought stress[J]. Plant Mol Biol, 2011, 77(1/2): 91-103.
[10]Zhang L, Zhao G, Xia C, et al. A wheat R2R3-MYB gene, TaMYB30-B, improves drought stress tolerance in transgenicArabidopsis[J]. J Exp Bot, 2012, 63(16): 5873-5885.
[11]Huang C, Hu G, Li F, et al. NbPHAN, a MYB transcriptional factor, regulates leaf development and affects drought tolerance inNicotianabenthamiana[J]. Physiol Plant, 2013, 149(3): 297-309.
[12]Cai H, Tian S, Liu C, et al. Identification of a MYB3R gene involved in drought, salt and cold stress in wheat (TriticumaestivumL.) [J]. Gene, 2011, 485(2): 146-152.
[13]Gao J J, Zhang Z, Peng R H, et al. Forced expression of Mdmyb10, a myb transcription factor gene from apple, enhances tolerance to osmotic stress in transgenicArabidopsis[J]. Mol Biol Rep, 2011, 38(1): 205-211.
[14]Galbiati M, Matus J T, Francia P, et al. The grapevine guard cell-related VvMYB60 transcription factor is involved in the regulation of stomatal activity and is differentially expressed in response to ABA and osmotic stress[J]. BMC Plant Biol, 2011, 11: 142, doi: 10.1186/1471-2229-11-142.
[15]El-Kereamy A, Bi Y M, Ranathunge K, et al. The rice R2R3-MYB transcription factor OsMYB55 is involved in the tolerance to high temperature and modulates amino acid metabolism[J]. PLoS One, 2012, 7(12): e52030.
[16]Park M R, Yun K Y, Mohanty B, et al. Supra-optimal expression of the cold-regulated OsMyb4 transcription factor in transgenic rice changes the complexity of transcriptional network with major effects on stress tolerance and panicle development[J]. Plant Cell Environ, 2010, 33(12): 2209-2230.
[17]Kim J H, Nguyen N H, Jeong C Y, et al. Loss of the R2R3 MYB, AtMyb73, causes hyper-induction of the SOS1 and SOS3 genes in response to high salinity inArabidopsis[J]. J Plant Physiol, 2013, 170(16): 1461-1465.
[18]Cui M H, Yoo K S, Hyoung S, et al. An Arabidopsis R2R3-MYB transcription factor, AtMYB20, negatively regulates type 2C serine/threonine protein phosphatases to enhance salt tolerance[J]. FEBS Lett, 2013, 587(12): 1773-1778.
[19]Xie Z, Li D, Wang L, et al. Role of the stomatal development regulators FLP/MYB88 in abiotic stress responses[J]. Plant J, 2010, 64(5): 731-739.
[20]Rahaie M, Xue G P, Naghavi M R, et al. A MYB gene from wheat (TriticumaestivumL.) is up-regulated during salt and drought stresses and differentially regulated between salt-tolerant and sensitive genotypes[J]. Plant Cell Rep, 2010, 29(8): 835-844.
[21]Qin Y, Wang M, Tian Y, et al. Over-expression of TaMYB33 encoding a novel wheat MYB transcription factor increases salt and drought tolerance inArabidopsis[J]. Mol Biol Rep, 2012, 39(6): 7183-7192.
[22]Shan H, Chen S, Jiang J, et al. Heterologous expression of the chrysanthemum R2R3-MYB transcription factor CmMYB2 enhances drought and salinity tolerance, increases hypersensitivity to ABA and delays flowering inArabidopsisthaliana[J]. Mol Biotechnol, 2012, 51(2): 160-173.
[23]Zhang L, Zhao G, Xia C, et al. Overexpression of a wheat MYB transcription factor gene, TaMYB56-B, enhances tolerances to freezing and salt stresses in transgenicArabidopsis[J]. Gene, 2012, 505(1): 100-107.
[24]Liu H, Zhou X, Dong N, et al. Expression of a wheat MYB gene in transgenic tobacco enhances resistance toRalstoniasolanacearum, and to drought and salt stresses[J]. Funct Integr Genomics, 2011, 11(3): 431-443.
[25]Zhang Z, Liu X, Wang X, et al. An R2R3 MYB transcription factor in wheat, TaPIMP1, mediates host resistance toBipolarissorokinianaand drought stresses through regulation of defense-and stress-related genes[J]. New Phytol, 2012, 196(4): 1155-1170.
[26]Yang A, Dai X, Zhang W H. A R2R3-type MYB gene, OsMYB2, is involved in salt, cold, and dehydration tolerance in rice[J]. J Exp Bot, 2012, 63(7): 2541-2556.
[27]Wang R K, Cao Z H, Hao Y J. Overexpression of a R2R3 MYB gene MdSIMYB1 increases tolerance to multiple stresses in transgenic tobacco and apples[J]. Physiol Plant, 2014, 150(1):76-87.
[28]Cao Z H, Zhang S Z, Wang R K, et al. Genome wide analysis of the apple MYB transcription factor family allows the identification of MdoMYB121 gene confering abiotic stress tolerance in plants[J]. PLoS One, 2013, 8(7): e69955.
[29]Zhang X, Rerksiri W, Liu A, et al. Transcriptome profile reveals heat response mechanism at molecular and metabolic levels in rice flag leaf[J]. Gene, 2013, 530(2): 185-192.
[30]Zhang X, Li J, Liu A, et al. Expression profile in rice panicle: insights into heat response mechanism at reproductive stage[J]. PLoS One, 2012, 7(11): e49652.
[31]Liu G T, Wang J F, Cramer G, et al. Transcriptomic analysis of grape (VitisviniferaL.) leaves during and after recovery from heat stress[J]. BMC Plant Biol, 2012, 12: 174,. doi: 10.1186/1471-2229-12-174.
[32]Peng S Q, Wu K X, Huang G X, et al. HbMyb1, a Myb transcription factor fromHeveabrasiliensis, suppresses stress induced cell death in transgenic tobacco[J]. Plant Physiol Biochem, 2011, 49(12): 1429-1435.
[33]Ren F, Guo Q Q, Chang L L, et al.BrassicanapusPHR1 gene encoding a MYB-like protein functions in response to phosphate starvation[J]. PLoS One, 2012, 7(8): e44005.
[34]Yuan Y, Wu C, Liu Y, et al. et al. TheScutellariabaicalensisR2R3-MYB transcription factors modulates flavonoid biosynthesis by regulating GA metabolism in transgenic tobacco plants[J]. PLoS One, 2013, 8(10): e77275.
[35]Azuma A, Yakushiji H, Koshita Y, et al. Flavonoid biosynthesis-related genes in grape skin are differentially regulated by temperature and light conditions[J]. Planta, 2012, 236(4): 1067-1080.
