假蜜环菌发酵工艺的优化研究
2014-03-25徐来清张书祥
徐来清, 张书祥
(安徽大学 生命科学学院,安徽 合肥 230601)
假蜜环菌 [Armillariellatabescens(Scop.ex Fr.)Sing]是层菌纲口蘑科假蜜环菌属真菌,因菌丝体在暗处发出荧光,故称为亮菌。该菌具有治疗肝炎、胆囊炎、肿瘤以及放疗、化疗引起的白细胞减少等药效,且还具有强筋壮骨、疏风活络、明目、利肺、醒酒、益肠胃等保健功效[1-3]。现代研究表明,用乙醇、乙酸乙酯提取可得到亮菌甲素、亮菌乙素、亮菌丙素,而亮菌甲素主要用于急慢性肝炎、慢性浅表性胃炎和慢性胆囊炎急性发作等疾病的对症治疗[3,4]。另据报道,用水提或碱提法可提取得到亮菌杂多糖ATM3、AT-HW和AT-AC,而亮菌多糖是假蜜环菌生理生化活性的主要成分之一,具有抑制小鼠S180肿瘤的生长,提高机体免疫机能的功效[5-8]。
目前, 国内亮菌口服液或胶囊制剂多采用固体发酵工艺生产,以廉价易得的玉米粉、红薯粉等原料按一定比例混合配制固体培养基, 灭菌接种, 然后在室内避光培养2个月左右。这种生产方式优点是发酵程度深,有利于多种药用有效成分的表达分泌,但明显存在的问题是生产周期长,污染的概率大,且一旦染菌只能全部丢掉,浪费大。因此,固体发酵规模小、周期长、产量低的缺点严重制约了企业的产能和效益。
本文在相关文献报道的基础上[9,10],针对合肥诚志生物制药有限公司提供的假蜜环菌菌种,在本实验室前期工作的基础[11]上,进行液体发酵罐深层发酵和静置发酵两种发酵方式的研究,探究其取代传统固体发酵方式的可行性,为亮菌口服液的液态发酵生产工艺提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种
假蜜环菌[Armillariellatabescens(Scop.ex Fr.)Sing]菌种由合肥诚志生物制药有限公司提供。
1.1.2 培养基
1)试管斜面培养基:PDA培养基。
2)液体培养基(g/L):马铃薯去皮,200;KH2PO4,2;MgSO4·7H2O,1。
1.1.3 试剂
亮菌甲素对照品(中国药品生物制品检定所);甲醇为色谱纯,其余试剂均为分析纯。
1.1.4 主要仪器
UV-5200 紫外分光光度计(上海元析仪器有限公司); SX-700压力蒸汽灭菌锅(TOMY);R-3旋转蒸发仪(BUCHI);高效液相色谱仪(HITACHI D-2000 series);色谱柱:Agilent TC-C18(2) (4.6 mm × 250 mm,5 μm);检测器:L-2420; PiloFD系列中试型冻干机(SIM),GF-1高速匀浆机(海门市麒麟医用仪器厂);SNB-2数字粘度计(上海精科);BIOFLO-410型发酵罐(NBS)。
1.2 实验方法
1.2.1 液体种子的制备[11]
试管菌种经活化,用接种铲挑取试管表面菌丝体于盛有无菌水的250 mL三角瓶中,匀浆机打散,按10%接种量接种入250 mL 三角瓶内,28 ℃、150 r/min振荡培养4 d。
1.2.2 发酵罐液体深层发酵
待三角瓶内形成菌丝球并均匀分散在培养基中时,将液体种子按5%接种量接种于14 L 发酵罐中。28 ℃,200 r/min,pH值5.5,通气量1∶ 1 v/v·m,培养7 d,放罐。
1.2.3 静置发酵
将液体种子按10%接种量接种于500 mL三角瓶中,先28 ℃、150 r/min振荡培养4 d,然后避光静置培养2个星期。用匀浆机将发酵液搅匀,准确测定菌丝生物量及各活性成分含量。
1.3 测定方法
1.3.1 亮菌干重的测定
取发酵罐的发酵液样品共9份,每份100 mL,4000 r/min离心20 min,去上清,沉淀用蒸馏水冲洗,重复操作2次收集沉淀,取9份中的任意3份,80℃烘干至恒重,电子天平称量菌丝体的干质量。另外6份冷冻干燥制成亮菌菌粉,测定菌粉中多糖和蛋白含量。静置发酵菌丝体生物量的测定与之相同。
1.3.2 多糖含量测定[10,12]
1)热水浸提法提取亮菌粗多糖。发酵罐液体深层发酵法:称取制得的1 g菌粉,加入蒸馏水300 mL,80℃下水浴2.5 h,不断搅动,防止黏壁。浸提完毕后冷却至室温,4000 r/min离心20 min,收集上清,沉淀在相同条件下重复浸提2次,合并滤液,旋转蒸发(65℃)浓缩至原液的1/6,得亮菌粗多糖提取液。
液体静置法:取发酵完毕后的发酵液100 mL代替1 g菌粉,其余操作与发酵罐液体深层发酵法完全相同。
2)样品多糖含量测定。葡萄糖标准曲线的制备:精密量取0.1 g/L的葡萄糖标准溶液0、0.2、0.4、0.6、0.8和1 mL分别置于洁净的具塞试管中,分别加入蒸馏水补充至1 mL,依次加入6%的苯酚1 mL,再迅速加入浓硫酸5 mL,振荡混匀10 min,冷却至室温静置20 min,490 nm处比色,测定吸光值。测的多糖标准曲线的回归方程为y= 11.41x+0.003(x为多糖浓度,y为OD值),回归率R2= 0.9993。
样品多糖含量测定:向提取的多糖溶液中加入95%乙醇,使含醇量达到80%,4℃静置过夜,4000 r/min条件下离心20 min得粗多糖,加入蒸馏水复溶,定容至1000 mL。苯酚硫酸法测定吸光值,根据标准曲线计算发酵液中多糖浓度。
1.3.3 蛋白质含量测定[11]
1)考马斯亮蓝G-250染液的配置:取50 mg考马斯亮蓝G-250溶于25 mL 95%乙醇中,待完全溶解后加入50 mL 85%磷酸,最后用蒸馏水定容至500 mL。
2)考马斯亮蓝标准曲线的制备:精密量取100 mg/L的BSA标准溶液0、0.1、0.2、0.4、0.6和0.8 mL,分别置于洁净的具塞试管中,分别加入蒸馏水补充至1 mL,各试管中依次加入5 mL考马斯亮蓝G-250试剂,595 nm处比色,测定吸光值。测的考马斯亮蓝标准曲线的回归方程为y=6.9463x+0.0054(x为蛋白浓度,y为OD值),回归率R2=0.9997。
3)样品中蛋白质含量测定:称取1 g菌粉(菌粉用蒸馏水定容至100 mL)或100 mL发酵液,4000 r/min ,4℃离心20 min,破碎细胞,收集上清,沉淀相同条件重复浸提2次,合并滤液,定容至1000 mL,595 nm处比色,测定吸光值,根据标准曲线计算发酵液中蛋白浓度。
1.3.4 亮菌甲素含量的测定[13,14]
1)标准曲线的制备:精密称取10 mg亮菌甲素标准品置500 mL容量瓶中,以流动相为甲醇和0.1 mol/L乙酸(50∶ 50)溶解定容,超声20 min后,用流动相梯度稀释成浓度为0.125、0.25、0.5、1、2和4 mg/L的系列对照品溶液。分别进样16 μL,柱温30℃,检测波长为366 nm,测定峰面积积分值。在上述色谱条件下测定,测的亮菌甲素标准曲线的回归方程为y=112.57x+2978.8(x为亮菌甲素浓度,y为峰面积积分值),回归率R2=0.9997。
2)样品中亮菌甲素含量的测定:为了进一步的分析静置发酵液中药效成分亮菌甲素的含量,称取经匀浆机打散的静置发酵的发酵液100 mL,超声15 min,4000 r/min ,4℃离心20 min,收集上清,沉淀相同条件重复浸提2次,合并滤液,定容至1000 mL,取50 mL置分液漏斗中加无水乙醇10 mL,再加50 mL无水乙醚提取,收集有机相,水相继续用50 mL无水乙醚提取2次,合并乙醚液旋转蒸发蒸干,用流动相溶解定容至10 mL,进样16 μL,柱温30℃,检测波长为366 nm,测定峰面积积分值。
2 结果与分析
2.1 发酵罐深层发酵
经发酵罐7 d避光培养,测得此时的发酵液粘度为746 mPa·S(测定条件:25.0℃,1#转子,6 r/min),此时发酵液中菌丝呈白色纤维糊状,发酵液呈棕黄色。发酵液菌丝干重及菌粉中多糖和蛋白含量见表1。

表1 发酵罐发酵液组分
由表1可知,通过发酵罐液体深层发酵方式所获得的亮菌生物量平均能达到16.55 g/L,且周期短。但缺点是发酵液颜色不深,发酵程度低,无法像固体发酵那样菌丝体表层分泌大量棕褐色液体,这可能是由于液体发酵环境无法为亮菌次级代谢产胞外棕褐色浆液创造适宜的环境。
2.2 静置培养发酵
静置发酵2周后,发酵液表面形成约5 mm厚的菌丝层,且菌丝分泌大量棕褐色液体,发酵液中菌索向下延伸粗壮且多分支布满整个三角瓶,三角瓶中发酵液呈胶质半固体形态。称取经匀浆机打散的发酵液100 mL,4000 r/min条件下离心20 min ,沉淀80℃烘干至恒重。发酵液组分各项指标见表2。

表 2 静置培养发酵液组分
通过表2可知,发酵液中多糖含量为9.5%,蛋白质含量为3.0%。对比表1和表2,虽然静置发酵得到的亮菌生物量不及发酵罐液体深层发酵,但其发酵程度深,培养基利用率高,发酵液中多糖和蛋白含量明显优于液体深层发酵的发酵结果,同时也优于传统的固体发酵[11]。
为了进一步的探究静置发酵生产工艺能否取代传统的亮菌固体发酵生产工艺,本实验室采用HPLC法检测静置发酵液中亮菌甲素的含量(见图1和图2),结果发现发酵液中亮菌甲素含量平均为3.118 mg/L。
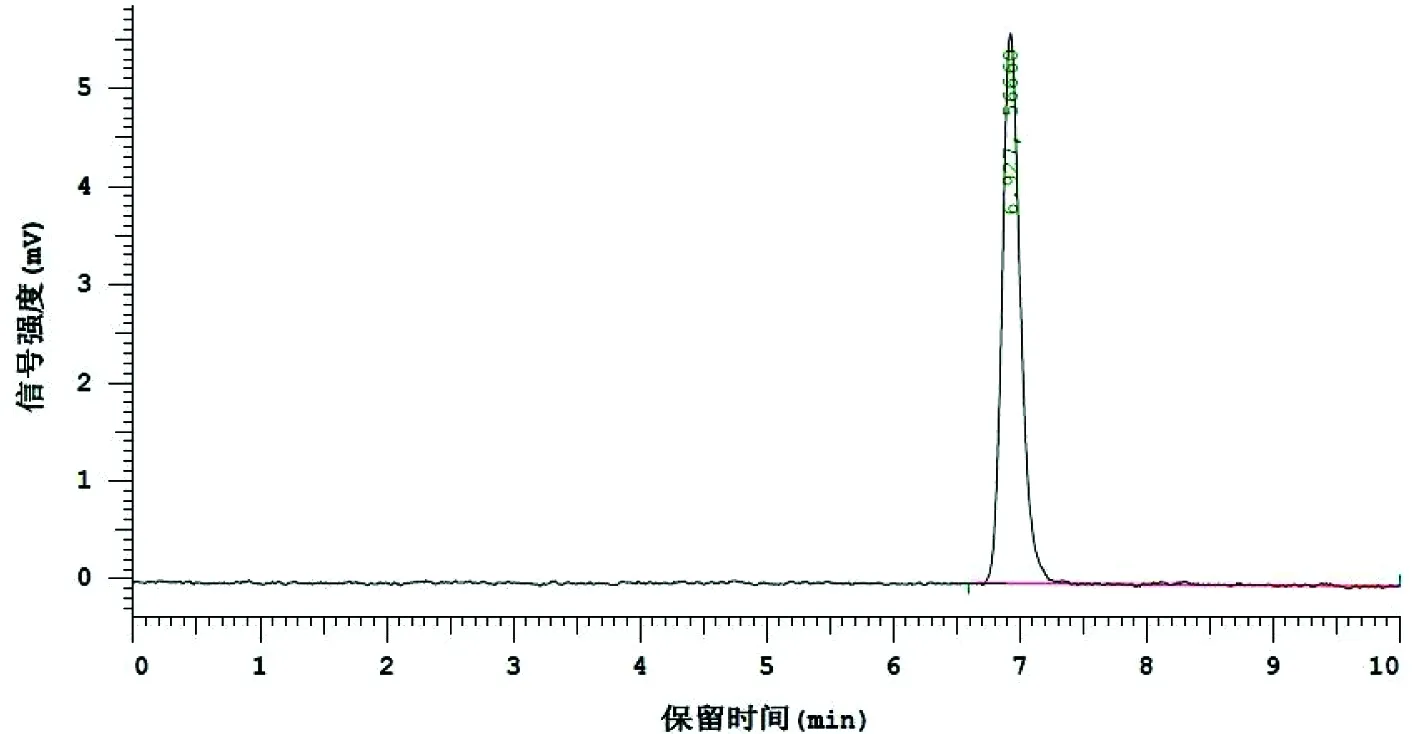
图 1 亮菌甲素对照品HPLC色谱图
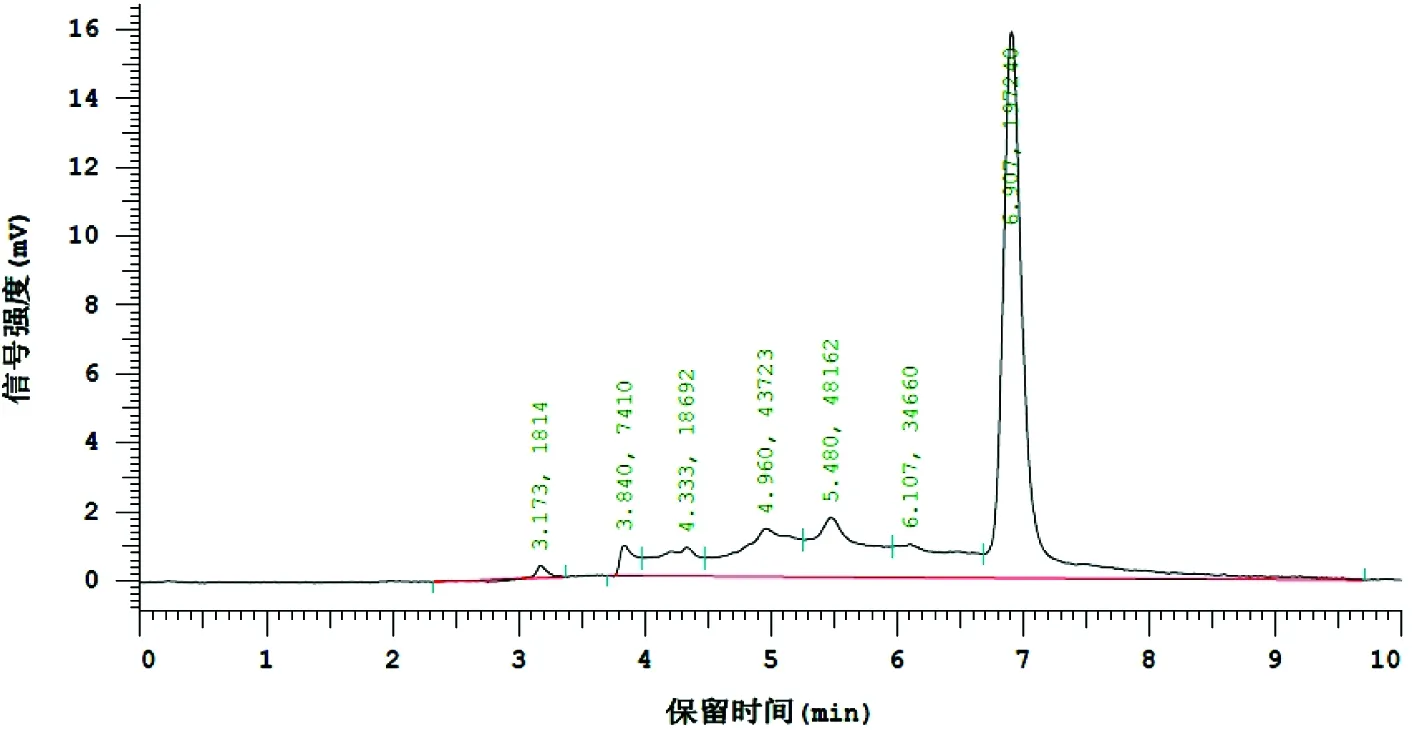
图2 样品HPLC色谱图
由图1和图2可以看出,亮菌甲素对照品和供试品中亮菌甲素的保留时间均在6.91 min左右,峰形较好。亮菌甲素属于香豆素类衍生物,具有亲脂性,易溶于乙醚,因此采用乙醚提取纯化,结果显示纯化后的样品中杂质含量较少且对待测物峰无影响[4,14]。
3 小结与讨论
1)通过14 L发酵罐进行液体深层发酵,发现尽管能够实现可观的菌丝生物量和较短的发酵周期,但发酵液颜色不是很深,发酵程度低,发酵液制得的菌粉中多糖和蛋白含量均较低,无法形成像固体发酵菌丝体分泌大量棕褐色液体和粗壮多分枝菌索的现象,而能否大量分泌棕褐色液体是合肥诚志生物制药有限公司在应用传统的固体发酵工艺生产亮菌口服液制剂中衡量亮菌发酵质量的一项重要指标,因此本文所采用的发酵罐液体深层发酵工艺尚需进一步加以研究和探讨。
2)采用液体静置发酵的方法,观察发现所有三角瓶都能分泌大量棕褐色液体和形成粗壮多分支的菌索。该方法大大缩短了发酵周期,且发酵液质量高,杂质少,提取浓缩简单易行,亮菌多糖等活性成分指标均优于传统的固体发酵。
综合以上两种发酵方法,液体静置发酵法结合了传统固体发酵程度深和液体发酵周期短的双重优点,且在多项技术指标及发酵成本方面均有优越性。此外,静置发酵法操作简便,无需专门设备,是亮菌制剂工业生产工艺改进与创新的首选。
参考文献:
[1]卯晓岚.中国大型真菌[M].郑州:河南科学技术出版社,2000,187.
[2]凌庆枝,袁怀波,王妮娜,等.亮菌固态和液体发酵多糖及其醒酒作用研究[J].食品科学,2008,29(5):324-326.
[3]沈业寿,马金宝.亮菌研究的现状与展望[J].安徽大学学报,2007,31(1):82-86.
[4]王 岩.香豆素类利胆药物亮菌甲素的药代动力学研究[D].长春,吉林大学,2008.
[5]Nagai K, Tanaka J, Kiho T, et al. Synthesis and antitumor activities of mitomycin C (1-3)-beta-D-glucan conjugate[J].Chem Pharm Bull(Tokyo), 1992, 40(4): 986-989.
[6]赵戈清,罗 霞,刘高阳,等.亮菌多糖对S180荷瘤小鼠免疫功能的研究[J].免疫学杂志,2006,22(3):146-148.
[7]Kiho T.Polysaccharides in fungi. XXIX. structural features of two antitumor polysaccharides from the fruiting bodies ofArmillariellatabescens[J].Chemical and Pharmaceutical Bulletin,1992,40(8):2212-2214.
[8]高 婷,白家峰,罗 霞,等.亮菌粗多糖对小鼠免疫功能的影响[J].四川大学学报,2005,42(2):395-398.
[9]敖宗华, 符慧子, 邹锡良. 大规模液体深层发酵生产亮菌菌丝体菌粉及其多糖工艺[P]. CN: 1596585, 2005-03-23.
[10]敖宗华,陆震鸣,孙军恩,等.亮菌菌粉和亮菌糖浆品质分析比较[J].生物技术通报,2008,4:188-190.
[11]宋 淼,王 清,张书祥.假蜜环菌液体种子培养条件的优化及其应用研究[J].生物学杂志,2012,29(5):64-67.
[12]董丽辉,范三微,黄贝贝.亮菌液体发酵多糖提取工艺研究[J].食品工业,2012,33(10):4-6.
[13]黄赵刚,李绍平,张 平,等.高效液相色谱法测定亮菌糖浆中亮菌甲素的含量[J].药物分析杂志,2003, 23(3):229-231.
[14]任惠霞,张 平,程 刚,等.高效液相色谱法测定亮菌水提液中亮菌甲素的含量[J].安徽医药,2012,16(6):759-760.
