PGRP和Cecropin基因在家蚕中肠和脂肪体中的免疫模式研究
2014-03-25王传旭
王传旭
(运城学院 生命科学系,山西 运城 044000)
家蚕(BombyxmoriLinaeus)属于昆虫纲鳞翅目蚕蛾科,为完全变态昆虫。家蚕作为鳞翅目昆虫研究中的代表生物,在昆虫的生长发育和害虫防治等研究领域都有着不可比拟的优势。2003年成功绘制家蚕基因组框架图,2006年研制成功了世界上第一张覆盖家蚕全基因组的寡核苷酸芯片。家蚕基因组和表达组分析平台的建立,为我们从基因组和基因水平上研究家蚕提供了良好的基础[1]。
蚕病是桑蚕养殖中的大敌,直接影响蚕茧的产量及质量。家蚕致病的因素有生物因素如病原菌感染,环境因素如不良的光照、温度或者气体等,化学因素如农药毒物,物理因素如机械损伤,饲料因素如叶片质量差,体质因素如品种差异、蚕种带毒等[2],其中生物因素是家蚕致病最主要的原因。
了解家蚕免疫系统是解决蚕病的基础。对家蚕免疫相关基因的研究,不仅可以使人们更加详细地了解家蚕免疫应答的分子调控机制,还可以促进人们对昆虫的分子调控机制的深入理解,为昆虫免疫分子的多样性研究提供线索[3]。在漫长的进化过程中,家蚕形成了一套高效的先天性免疫系统以抵御外界微生物的感染。先天性免疫是无脊椎和脊椎动物的重要免疫防御阵线,其通过模式受体蛋白(pattern recognition receptors,PRR)识别病原微生物表面的病原相关分子模式(pathogen assoeiated molecular pattems,PAMPs)[4,5]。病原相关分子模式是宿主昆虫体内不存在的物质,它代表的是一种分子模式。PAMPs是一类不以蛋白质为主要组分的生物大分子,主要包括脂多糖、肽聚糖、脂磷壁、葡聚糖和甘露聚糖等[6,7]。这些大分子容易被先天免疫系统识别[8]。
模式识别受体是生物体先天免疫系统中免疫受体的代表,对生物体的生存极为重要[9]。昆虫的先天免疫系统中,肽聚糖识别蛋白(peptidoglycan recognition proteins, PGRPs)作为模式识别受体在识别入侵病原物和激活免疫调控途径中起着重要作用[10~14]。1996年,Yoshida等人从家蚕血液中纯化得到一种具有信号肽、等电点为6.5、分子量为19 kDa的PGRPs,也是生物界最早从昆虫中得到的小型肽聚糖识别蛋白。该蛋白存在于家蚕的血淋巴和表皮中,对肽聚糖和革兰氏阳性菌具有较高的结合活性,体外结合实验表明该肽聚糖识别蛋白在结合肽聚糖以后可以激活酚氧化酶原系统[15],之后又在其他的昆虫和哺乳动物中克隆出肽聚糖识别蛋白基因[16],它们都具有一个大小约165个氨基酸的保守的PGN结合结构域。目前在果蝇中发现13个该家族的基因,并且至少编码17个蛋白[17],在按蚊中发现7个该家族的基因,共编码9个蛋白[18]。人类含有4种PGRP基因[19]。昆虫的血细胞、脂肪体和中肠等免疫器官中肽聚糖识别蛋白都可表达,且大多能被PGN或细菌诱导上调表达,表明其在抗菌反应中起到重要作用[8]。
天蚕素(Cecropin)最先是在1981年从注射过细菌的惜古比天蚕滞育蛹中分离得到的,是一类对革兰氏阴性菌和革兰氏阳性菌都有很好抗菌活性的阳离子抗菌肽,具有很好的药物开发潜能[20]。Cecropin A是最早发现的抗菌肽之一,由35个氨基酸残基构成,其N端碱性很强,螺旋结构,N端序列对其活性具有重要作用,使Cecropin具有广谱的抗菌活性[21]。
目前对PGRP和Cecropin基因的研究主要集中于其在革兰氏阳性菌和革兰氏阴性菌的免疫作用上,而对这2个基因在细菌和真菌的免疫中的作用少有涉及。因此,利用代表性的细菌(金黄色葡萄球菌)和真菌(白色念珠菌)对家蚕进行免疫刺激,以期得到PGRP和Cecropin这2个基因在家蚕不同组织中的免疫模式。
1 材料与方法
1.1 材料
家蚕由运城市蚕业科学研究院提供。幼虫在室温23℃下桑叶喂食。桑叶是从运城学院东门桑树采摘的新鲜嫩叶。所用菌种为金黄色葡萄球菌(Staphyloccocusaureus)和白色念珠菌(Moniliaalbican),由运城学院李新提供。
1.2 方法
1.2.1 家蚕处理
1.2.1.1 取样
取过夜培养的金黄色葡萄球菌和白色念珠菌各1 mL,离心后分别将沉淀用0.5 mL灭菌PBS(10 mM Na2HPO4, 1.8 mM KH2PO4, 140 mM NaCl, 2.7 mM KCl, pH 7.4,稀释至0.1 mg·mL-1)重悬备用。
1.2.1.2 注射
选取3龄、蜕皮后20~24 h家蚕作为试验材料,每只家蚕注射5 μL病原菌,对照组选取3龄蜕皮后20~24 h家蚕注射等体积的灭菌PBS,于注射后1,3,6和12 h分别提取不同处理下家蚕中肠和脂肪体总RNA。每种处理均为6只家蚕。
1.2.2 家蚕中肠和脂肪体总RNA的提取
使用北京全式金公司Trans Zol试剂盒,按照说明书提取处理后的家蚕中肠和脂肪体总RNA,测定OD值,并用琼脂糖凝胶电泳分析检测提取的RNA的质量。
1.2.3 反转录
使用TakaRa公司反转录试剂盒,以Oligo dT为引物进行反转录,具体实验步骤按照说明书进行,获得第一链cDNA。
1.2.4 RT-PCR引物设计
实验中所需要的引物均采用Oligo 6软件进行设计(表1)。引物合成由生工生物工程(上海)有限公司完成。
1.2.5 半定量RT-PCR检测
采用半定量RT-PCR的方法,测定家蚕幼虫在分别注射金黄色葡萄球菌和白色念珠菌1,3,6和12 h后中肠和脂肪体内PGRP基因和Cecropin基因的转录水平。半定量RT-PCR采用家蚕看家基因胞质肌动蛋白β-Actin做内参,以cDNA为模板,利用表1对应的引物进行扩增。PCR程序如下:94℃预变性5 min;94℃,45 s;53℃,30 s;72℃,45 s;循环32次;72℃延伸10 min后4℃保存。每个样品重复3次以上。PCR后样品利用1%琼脂糖凝胶电泳检测,利用Tanon Gis软件分析电泳结果。

表1 RT-PCR引物序列
2 结果与分析
2.1 金黄色葡萄球菌和白色念珠菌对PGRP基因转录水平的影响
以β-Actin为内参基因,对白色念珠菌和金黄色葡萄球菌分别感染的家蚕中肠和脂肪体中PGRP基因进行半定量RT-PCR检测,结果见图1。
由图1可以看出,与对照组(注射灭菌PBS)相比,白色念珠菌感染的家蚕中肠和脂肪体中PGRP基因的转录水平较低,与对照相比转录几乎没有变化(图1A)。
金黄色葡萄球菌感染的家蚕中肠和脂肪体中PGRP基因的转录水平变化比较明显,但在不同的组织中,PGRP的转录模式有少许不同:中肠中,PGRP对金黄色葡萄球菌响应较快,在刺激后1 h转录即出现明显的上调,并且上调可以持续至12 h(图1A);脂肪体中,PRGP基因对金黄色葡萄球菌的响应较慢,在刺激3 h后转录水平没有变化但刺激6 h后,其转录水平明显开始上升,至刺激12 h后转录水平继续增强(图1B)。
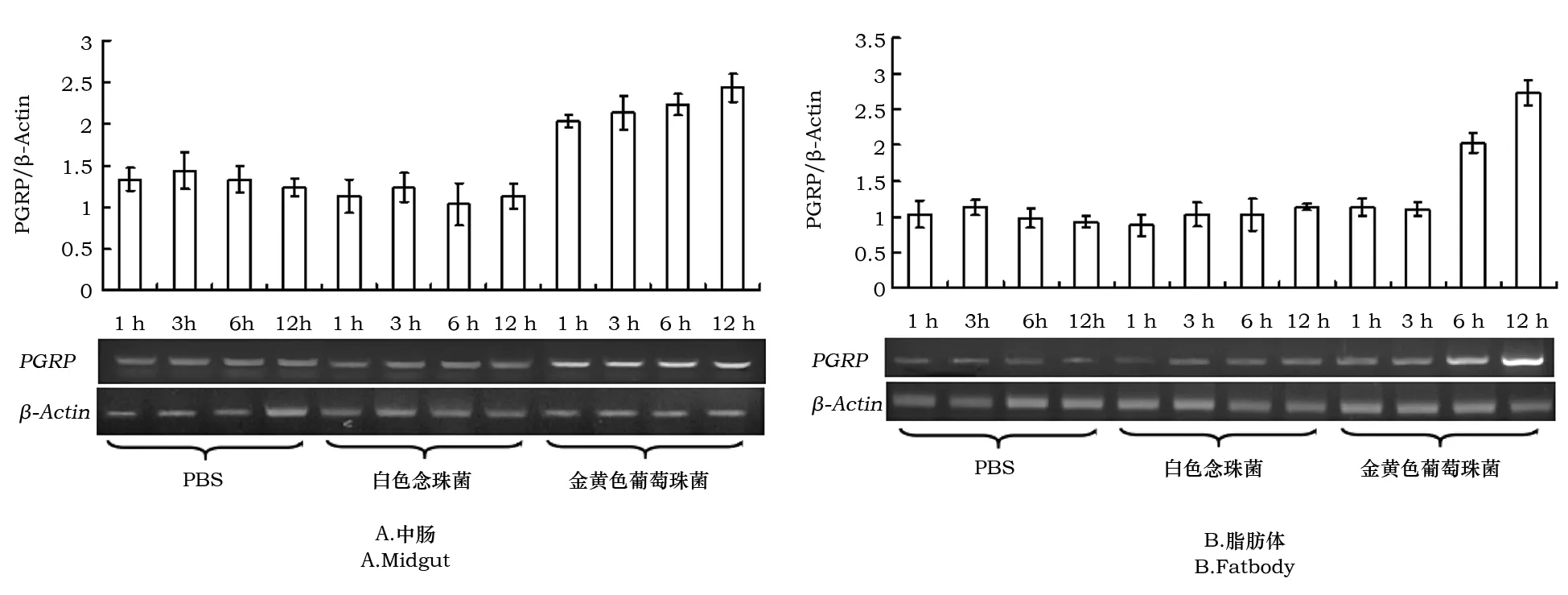
图1 家蚕中肠和脂肪体PGRP基因在白色念珠菌(真菌)或金黄色葡萄球菌(细菌)刺激后的转录变化Fig.1 The transcription pattern of B.mori midgut gene PGRP after the challenge of C.albicans(fungi) and S.aureus(bacteria).注:PBS为对照。图2同。Note:PBS was the control.The same as Fig.2.
2.2 金黄色葡萄球菌和白色念珠菌对Cecropin基因转录水平的影响
以β-Actin为内参基因,对白色念珠菌和金黄色葡萄球菌分别感染的家蚕中肠和脂肪体中Cecropin基因进行半定量RT-PCR检测,结果见图2。由图2可以看出,与对照组(注射灭菌PBS)相比,白色念珠菌感染的家蚕中肠中Cecropin基因的转录水平较低,与对照相比转录几乎没有变化;金黄色葡萄球菌刺激后,中肠中的Cecropin基因在刺激后3 h转录开始上调并持续至刺激后12 h(图2A)。
脂肪体中的Cecropin基因在白色念珠菌刺激后3 h和6 h后出现转录上调,在刺激12 h后趋于平稳。同对照组相比,在金黄色葡萄球菌刺激后,脂肪体中的Cecropin基因的转录水平没有明显变化(图2B)。
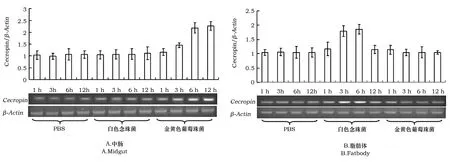
图2 家蚕中肠和脂肪体Cecropin基因在白色念珠菌(真菌)或金黄色葡萄球菌(细菌)刺激后的转录变化Fig.2 The transcription pattern of B.mori midgut and fatbody gene Cecropin after the challenge of C.albicans (fungi) and S.aureus(bacteria).
3 讨论与结论
(1)PGRP可以响应革兰氏阳性细菌引起的免疫反应,对革兰氏阳性真菌没有免疫反应。金黄色葡萄球菌是典型的革兰氏阳性细菌,白色念珠菌是典型的革兰氏阳性真菌。PGRP是昆虫先天免疫中的重要的模式识别受体,当革兰氏阳性菌入侵昆虫时,Imd通路上游的PGRP作为模式识别受体来识别革兰氏阳性菌细胞壁中的赖氨酸型肽聚糖,从而启动Imd通路的表达[11]。试验结果证明了PGRP只能启动革兰氏阳性细菌引起的免疫反应,对革兰氏阳性真菌没有明显的免疫反应。可能是由于金黄色葡萄球菌是典型的革兰氏阳性菌,PGRP能够轻松的识别细菌表面的肽聚糖;白色念珠菌虽然也是革兰氏阳性菌,但染色时着色不均匀,说明细胞表面肽聚糖分布不均匀,故不易被PGRP所识别。
(2)Cecropin在昆虫不同组织对细菌和真菌的刺激反应不同。Cecropin是昆虫中的一类重要的抗菌肽。Cecropin是螺旋的线性抗菌肽,通过在微生物细胞膜上形成离子通道使得微生物胞内物质泄漏产生抗菌活性。Cecropin家族对革兰氏阴性菌有强抗菌活性,对革兰阳性菌的抗性较弱[20]。Cecropin家族在家蚕体内分布具有组织特异性,在脂肪体和血淋巴中表达量很高,而马氏管、中肠、丝腺等组织器官几乎不表达[21]。
结果显示Cecropin基因在家蚕的中肠和脂肪体中都有转录活性,在受到不同的病原菌的刺激后都可以引起转录上调。在中肠中,转录活性较弱一些,主要是对细菌的刺激具有免疫反应;在脂肪体中,转录活性相对强一些,主要针对真菌的刺激具有免疫反应。
参 考 文 献
[1]黄重.家蚕幼虫蜕皮期基因表达的全基因组芯片研究[D].重庆:西南大学,2008.
[2]陈志勇.蚕病防治浅谈[J].蚕学通报,1999,19(2):55-56.
[3]程廷才.家蚕免疫系统相关基因的鉴定及其诱导表达模式研究[D].重庆:西南大学,2008.
[4]Choe K M,Lee H,Anderson K V.Drosophilapeptidoglycan recognition protein LC acts as a signal-transducing innate immune receptor[J].Proc Natl Acad Sci USA,2005,102(4):1122-1126.
[5]Hoffmann J A.The immune response ofDrosophila[J].Nature,2003,426(6962):33-38.
[6]Medzhitov R,Janeway C A Jr.Decoding the patterns of self and nonself by the innate immune system[J].Science,2002,296(5566):298-300.
[7]Dziarski R.Peptidoglycan recognition proteins[J].Mol Immunol,2004,40(12):877-886.
[8]许平震.家蚕先天免疫的模式识别——信号传导和抗微生物肽基因表达调控机制研究[D].重庆:西南大学,2010.
[9]许平震,张美蓉,夏庆友,等.家蚕模式识别受体PGRP、βGRP编码基因的克隆鉴定及表达谱分析[J].蚕业科学,2010,36(3):0383-0390.
[10]Kaneko T,Goldman W E,Mellroth P.Monomeric and polymeric Gram-negative peptidoglycan but not purified LPS stimulate the Drosophila IMD pathway [J].Immunity,2004,20 (5):637-649.
[11]Pili-Floury S,Leulier F,Takahashi K.In vivo RNA interference analysis reveals an unexpected role for GNBP1 in the defense against Gram-positive bacterial infection inDrosophilaadults [J].J Biol Chem,2004,279(13):12848-12853.
[12]Royet J,Reichhart J M,Hoffmann J A.Sensing and signaling during infection inDrosophila[J].Curr Opin Immunol,2005,17(1):11-17.
[13]Steiner H.Peptidoglycan recognition proteins:on and off switches for innate immunity [J].Immunol Rev,2004,198(1):83-96.
[14]Werner T,Borge-Renberg K,Mellroth P.Functional diversity of theDrosophilaPGRP-LC gene clusler in the response to lipopolysaccharide and peptidoglycan[J].J Biol Chem,2003,278(29):26319-26322.
[15]Yoshida H,Kinoshita K,Ashida M.Purification of a peptidoglgcan recognition protein from hemolymph of the silkworm,Bombyxmori[J].Biol Chem,1996,271(23): 13854-13860.
[16]Kang D,Liu G,Lundstrom A.A Peptidoglycan recognition protein in innate immunity conserved from insects to humans[J].Proc Natl Acad Sci USA ,1998,95(17): 10078-10082.
[17]Werner T,Liu G,Kang D.A family of peptidoglycan recognition proteins in the fruit flyDrosophilamelanogaster[J].Proc Nalt Acad Sci USA,2000,97(25):13772-13777.
[18]Christophides GK,Zdobnov E,Barillas-Mury C.Immunity-related genes and gene families inAnophelesgambiae[J].Science,2002,298(5591):159-165.
[19]Kurata S.Recognition of infectious non-self and activation of immune response by peptidoglycan recognition protein (PGRP)-family members inDrosophila[J].Dev Comp Immunol,2004,28(2):89-95.
[20]王云起,刘飞鹏,李月琴,等.天蚕素A-蜂毒素杂合肽用pBV220载体的表达、纯化和活性测定[J].中国生物工程杂志,2005,25(10):29-33.
[21]王炜,郑学礼.家蝇Cecropin A分子体外表达及抗菌活性鉴定[J].中国人兽共患病学报,2012,28(11):1098-1101.
