马齿苋内生细菌的分离鉴
2014-03-25定武燕尚世辉杨倩王瑞刚
定武燕,尚世辉,杨倩,王瑞刚
(内蒙古农业大学 生命科学学院,内蒙古 呼和浩特 010018)
马齿苋(PortuLacaoteracea)为马齿苋科(PortuLaeaceae)马齿苋属(PortuLacaL.)一年生肉质草本植物,也称五行草、酸味草、长命草等,生于菜园、农田、路旁、荒地等,为常见杂草,是古今闻名的佳蔬良药[1]。马齿苋原产于印度,后传播到世界各地,广泛分布于温带和热带地区。我国大部分地区的田边、地角和荒地均可见到野生马齿苋[2]。
目前发现,内生细菌广泛存在于多种陆生及水生植物中。从各种农作物及果树等经济作物中分离到的内生细菌已超过129种(分别属于54个属)。这些内生细菌大多为土壤微生物种类。因此,人们开始认为内生细菌存在于大多数高等植物体内[3]。
分离鉴定内生细菌最常用、最有效的方法就是16S rDNA鉴定法。16S rDNA是细菌染色体上编码16S rRNA相对应的DNA序列,存在于所有细菌染色体基因中。16S rDNA由于大小适中,约1.5 kb左右,既能体现不同菌属之间的差异,又能利用测序技术较容易地得到其序列,故被细菌学家和分类学家所接受[4]。16S rDNA鉴定法包括16S rDNA特异引物PCR扩增、扩增产物纯化、DNA测序、序列比对等步骤,是常用的快速获得细菌种属信息的方法[3]。
随着植物内生细菌越来越多地被分离,它们的作用也不断被揭示。其中作为外源基因的载体,产生抗菌素、某些酶类等次生代谢产物以及诱导植物产生抗逆性,促进植物生长,与病原菌竞争生态位等是其主要功能。因此,植物内生细菌的研究虽然起步较晚,但是由于其具有较大的潜在价值和较广的拓展空间,现在已经成为重点研究对象之一。
我国的植物内生细菌资源极其丰富,只是对野生植物的内生细菌的研究较少,而对马齿苋内生细菌的研究目前尚未见报道。本文采用微生物形态学方法和分子生物学方法对马齿苋内生细菌进行分离鉴定研究。
1 材料与方法
1.1 试验材料
健康野生马齿苋全株,于2013年4月采自内蒙古农业大学校园。 采后置于保鲜袋中,于4℃条件下保存,采样后8 h内处理样品。
1.2 内生菌的分离及纯化
取健康马齿苋全株,洗净晾干后,在超净台内进行表面消毒处理,首先用5% NaClO浸泡5 min,再用无菌水冲洗3~5次,收集最后一次用的无菌水,用无菌滤纸吸干植株上的水分,使用75%乙醇灭过菌的研砵和研磨棒,在无菌状态下将马齿苋研磨成糊状,再用无菌水将匀浆稀释到1/10倍、1/100倍、1/1000倍,之后分别取1 mL涂布于新鲜的NA培养基[5]上,置于28℃的恒温培养箱培养1~2 d。同时,将最后一次漂洗用的无菌水和未研磨但进行了以上表面消毒处理的植株分别接入培养基作为对照组,以证明试验材料表面消毒充分彻底,得到的菌株是内生菌而非表生菌。
待长出菌落后根据菌落形态分类法,将得到的菌落初步分类得到B1,B2,B3,B4,B5,B6 6种,在超净台下转接于NA培养基平板(标号B1,B2,B3,B4,B5,B6)上,转接时在平板上画“Z”形以便得到各菌株的单菌落。反复纯化后,当单菌落长出,再转接于试管斜面上,进行菌种的鉴定及保存。
1.3 内生菌的菌种鉴定
1.3.1 形态学方法
首先根据内生细菌主要群落形态特点(菌落大小、颜色、形态)进行初步分类[6]并记录。然后挑取少量菌体,制成临时装片,用革兰氏染色液对细菌进行单染色。
1.3.2 分子生物学方法
1.3.2.1 引物
16S rDNA基因序列的扩增采用细菌通用引物:正向引物5-AGAGTTTGATCATGGCTCAG-3,反向引物5-GGTACCTTGTTACGACTT-3[7]。
1.3.2.2 菌落PCR
PCR混合液的制备:
Taq buffer(10×) 2μL
dNTP(2.5 mM) 1.6 μL
Primer Forward(引物浓度2 μM) 2 μL
Primer Reverse(引物浓度2 μM) 2 μL
ddH2O 10.3 μL
rTaq(2 U·μL-1) 0.1 μL
常温下,用枪头挑选单菌落到装有15 μL dd水的PCR管中,然后悬浮菌液。在做PCR时,吸取2 μL做模板,挑好单克隆菌落后将之前配制好的PCR混合液加入体系是20 μL。将混有菌体的PCR混合物置于PCR仪中,扩增条件:94℃预变性5 min,94℃变性30 s,55℃退火30 s,72℃延伸1 min,30个循环;72℃延伸5 min,16℃保温。其中退火温度设有5个梯度51℃、52℃、53℃、54℃、55℃。寻找每种菌的最适退火温度,使扩增顺利完成。
1.3.2.3 测序
PCR 产物用1.0%的琼脂糖凝胶电泳20 min后,用凝胶成像系统观察电泳结果并拍照。切胶后利用DNA回收试剂盒(北京天为时代科技有限公司)回收。然后将回收产物交由北京华大基因研究中心进行测序,测序引物为1492R和27F。
1.3.2.4 摇菌
电泳检测后,取有阳性克隆相对应的菌液10 μL于试管中的液体培养基中培养。
1.3.2.5 序列对比
用BLAST进行序列对比,找到相似度在95%以上的菌属,以确定该菌株的种属分类定位。
2 结果与分析
2.1 内生菌的分离及纯化
将研磨好的匀浆接入分离NA培养基,置于细菌培养箱中培养,12 h长出菌落。对照组的平板上没有出现菌落,说明试验中的马齿苋表面消毒充分彻底,得到的菌株为植株的内生菌。自菌落出现后再培养24 h后进行菌种的分离纯化,当单菌落长出后,转接于新的培养基上保存。从马齿苋中共分离得到6种细菌,菌落形态如图1所示,其形态描述见表1。
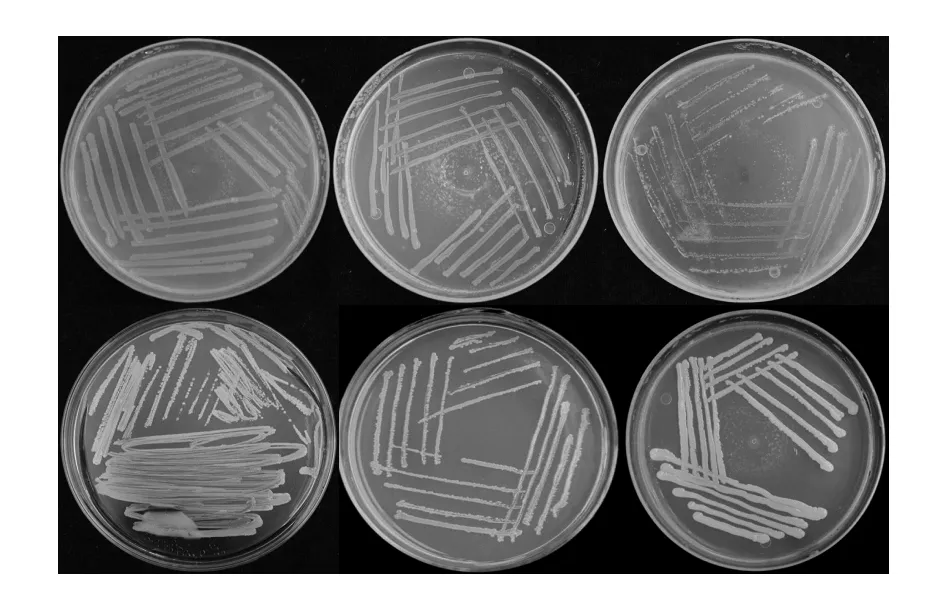
图1 马齿苋内生菌菌落形态图Fig.1 P.oteracea endophytic bacteria colony morphology
2.2 内生菌的菌种鉴定
2.2.1 PCR反应扩增的16S rDNA片段
琼脂糖凝胶电泳结果见图2。
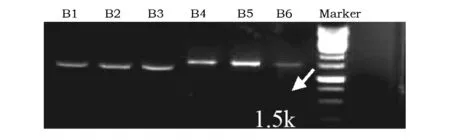
图2 菌落PCR 扩增产物凝胶电泳结果Fig.2 ColonyPCR amplified fragments in polyacrylamide gel electrophoresis
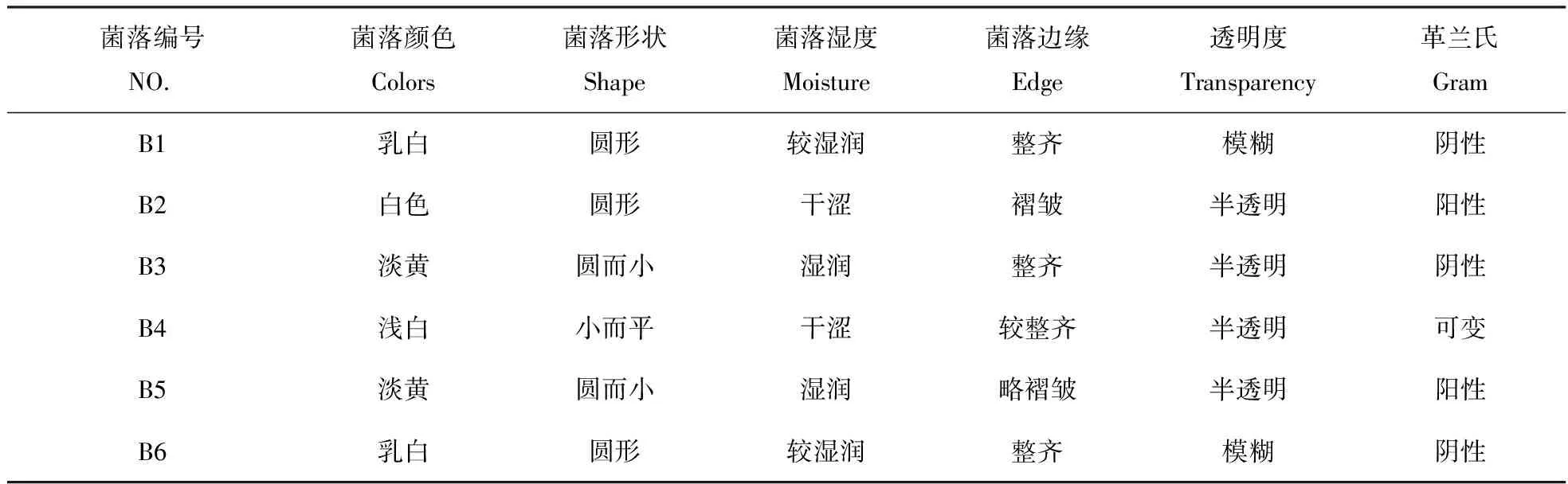
菌落编号NO.菌落颜色Colors菌落形状Shape菌落湿度Moisture菌落边缘Edge透明度Transparency革兰氏GramB1乳白圆形较湿润整齐模糊阴性B2白色圆形干涩褶皱半透明阳性B3淡黄圆而小湿润整齐半透明阴性B4浅白小而平干涩较整齐半透明可变B5淡黄圆而小湿润略褶皱半透明阳性B6乳白圆形较湿润整齐模糊阴性
从图2可见,电泳得到了清晰、单一的条带,条带亮度不同可能是由于挑取菌落大小不一,使得模板量不同导致扩增产物有多有少。但与Marker对比可知片段长度都接近1.5 kb,因此初步判断得到的就是目的片段,进一步测序可以最终确定。
2.2.2 16S rDNA测序结果
切胶后利用DNA回收试剂盒回收并测序。结果见表2。
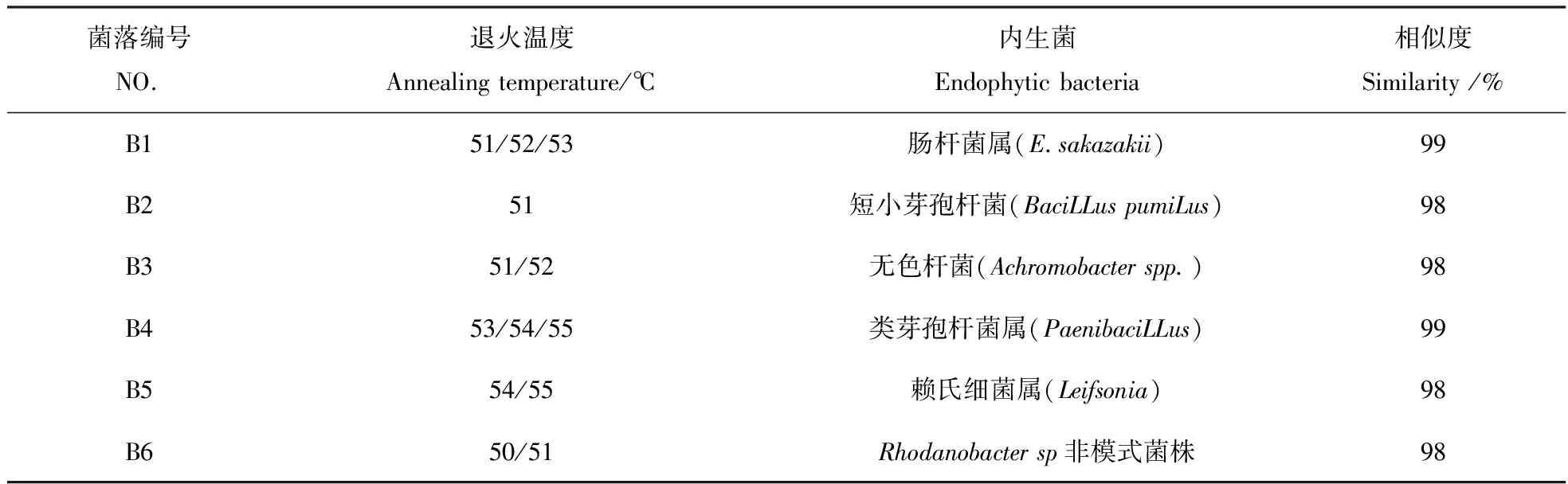
表2 马齿苋内生菌分子鉴定结果
3 讨论与结论
植物内生细菌的多样性众所周知,但不同植物之间也有一定的相似性。虽然之前没有关于马齿苋内生细菌的分离和鉴定的相关报道,但根据前人对其他陆生植物所作的研究可知,比较常见的属主要为:假单胞菌属(Pseudomonas)、芽孢杆菌属(BaciLLus)、肠杆菌属(Enterobacter)、以及土壤杆菌属(Agrobacterium)等[8~21]。本试验中从马齿苋中得到的菌种与他们的结果相符,而且本试验分离出的几种内生细菌,只是体外易培养的,菌落易被分辨的几种,不能代表马齿苋的全部内生细菌。
本试验成功的关键有两点:其一,排除表生菌的干扰。 用1%、3%、5% NaClO分别对材料处理1,3,5 min进行9 组试验,对照确定了最佳灭菌方法为5%次氯酸钠处理 5 min。其二,结合传统的形态学鉴定方法与现代分子学检测手段,结果更准确。有两方面有待完善:一,用培养基来培养内生细菌,不能保证所有生活在植物组织内的内生细菌全部被分离出来,可能有的内生细菌不能在人工培养基上生长,也有可能是植物正处在非内生性病原菌感染初期。 因此,建立与宿主植物内环境类似的生态模型,才能真实反映植物内生细菌的生物学特征; 二,不同植物的内生细菌数量差异较大而且具有可变性。因此,对植物内生细菌多样性研究还需综合多方面因素。
在以后的试验中,可以针对更多的野生植物进行内生细菌的分离与鉴定,加强各类植物内生细菌资源的研究。 这些研究从应用上看,将有助于发现新功能性菌株,促进植物的药用价值和经济价值的拓展;从理论上看,将有助于对植物内生菌的全面了解,促进菌植协同进化理论的发展,为植物功能性内生菌的筛选提供理论指导。本论文为这些后续工作提供了试验基础与参考。
参 考 文 献
[1]李英霞,孔维兰,陈萍,等.马齿苋药理研究新进展[J].时珍国医药,1999,10(9):7-12.
[2]朱丽,徐为公,赵广荣,等.马齿苋的研究现状与综合开发利用[J]. 河北林果研究,2006,21( 2):198-201.
[3]Patel JB,Leonard DG,Pan X,et al.Sequence-based identification of Mycobacterium species using the MicroSeq 500 16S rDNA bacteriaL identification system[J].Journal of Clinical Microbiology,2000,38(1):246-251.
[4]Woese CR.BacteriaL evoLution[J].Microbiol Rev,1987,51(2):221-271.
[5]程永宝.微生物学试验与指导[M].北京:中国医学科技出版社,1994:195-197.
[6]李琳,李槿年,余为一.细菌分类鉴定方法的研究概况[J].安徽农业科学,2004(3):45-60.
[7]Persing DH,Tenover FC,Tang YW,et al.Molecular microbiology:dignostic principles and practice[M].Washigton DC :American Society for Microbiology,2003:454-483.
[8]龙良鲲,肖崇刚,窦彦霞.防治番茄青枯病内生细菌的分离与筛选[J].中国蔬菜,2003,2:19-21.
[9]袁红旭,周立赖,周锦兰,等.富贵竹内生细菌群落的生物效应研究[J].中国生态农业学报,2005,13(1):95-97.
[10]芦云,罗明.哈密瓜内生细菌的分离及拮抗菌的筛选[J].石河子大学学报,2004,22:104-109.
[11]邱思鑫,何红,阮宏椿,等.具有抑菌促生作用的植物内生细菌的筛选[J].应用与环境生物学报,2004,10(5):655-659.
[12]何红,蔡学清,洪永聪,等.辣椒内生细菌的分离及拮抗菌的筛选[J].中国生物防治,2002,18(4):171-175.
[13]崔林,孙振,孙福在,等.马铃薯内生细菌的分离及环腐病拮抗菌的筛选鉴定[J].植物病理学报,2003,33(4):353-358.
[14]罗明,芦云,张祥林.棉花内生细菌的分离及生防益菌的筛选[J].新疆农业科学,2004,41(5):277-282.
[15]兰海燕,王长海,宋荣.棉花内生细菌及其研究进展[J].棉花学报,2003,12(2):105-108.
[16]高增贵,庄敬华,陈捷,等.玉米根系内生细菌种群及动态分析[J ].应用生态学报,2004,15(8):1344-1348.
[17]李庚花,杨民和,蒋军喜,等.茄科植物内生细菌的分离及拮抗菌的筛选[J].江西植保,2005,28(1):10-11.
[18]马冠华,肖崇刚.烟草内生细菌种群动态研究[M].微生物学杂志,2004,24(1):7-12.
[19]杨海莲,孙晓璐,宋未,等.水稻内生联合固氮细菌的筛选、鉴定及其分布特性[J].植物学报,1999,41(9):927-931.
[20]刘云霞,张青文,周明牂.水稻体内细菌的动态研究[J].应用生态学报,1999,10(6):735-738.
[21]王万能,肖崇刚.烟草内生细菌118防治黑胫病的机理研究[J].西南农业大学学报,2003,25(1):28-31.
