不同生态区糜子种质间叶片及光合特性的多样性分析
2014-03-25王瑞云季煦刘晓欢杨阳徐凤杰程冀南
王瑞云,季煦,刘晓欢,杨阳,徐凤杰,程冀南
(1.山西农业大学 农学院, 山西 太谷 030801; 2.农业部黄土高原作物基因资源与种质创制重点实验室, 山西 太原 030031;3.潞安矿业(集团)有限责任公司林业处, 山西 襄垣 046204)
表现型的可塑性(phenotypic plasticity) 是植物克服环境异质性在形态和生理方面发生的变化,具有生态适应对策性的意义。气孔器是植物体中调控光合、呼吸和蒸腾作用的结构,其在叶片表皮上的分布随植物的不同而不同,基本可以分为双面型气孔和单面型气孔两类。多数植物属于双面气孔型,且叶片背面的气孔数量明显多于腹面。研究表明,单面型气孔中,气孔器仅分布于上表皮的不多,仅有松属的红松亚属[1,2];气孔器仅分布于下表皮的物种很多,包括蔷薇科[3]、松柏科[2]、杉科[4~9]、泽米铁科[10]、龙脑香科[11]、无患子科[11]、茜草科[11]、藤黄科[11]、山矾科[11]、肉豆蔻科[11]、鼠李科[12]、豆科[12]、桦木科[12]、壳斗科[12]等。然而,更多研究发现,大多数植物属于双面气孔型,上、下表皮均存在气孔器,但上、下表皮的气孔密度不同。姚兆华等[13]研究发现,沙芥属3种植物的上、下表皮气孔密度差异不显著;冯丽贞等[14~18]分别对桉树、大豆、十字花科4种植物、古灰楸、委陵菜及菊花等进行研究发现这些植物上、下表皮气孔密度差异显著,且下表皮明显高于上表皮;相反,最新的研究表明梓树属的8个无性系、小麦、糜子等植物叶片的上表皮气孔密度明显高于下表皮[17,19,20]。以上研究说明,气孔器在不同的物种间存在遗传差异,即使是同一种植物,其生存的生态条件如果发生变化,气孔器的分布也会随之发生改变。Mott[21,22]研究发现,豚草在遮荫条件下,气孔器仅分布于下表皮,而在高光强下,则为气孔双面型,且随着光强的增加,腹面的气孔密度降低,背面的气孔密度增加。以往对气孔特征的研究涉及物种多、研究侧重面各有不同,但有关糜子的气孔特征研究很少。糜子是中国北方冷凉地区的抗旱耐瘠优势作物。冯晓敏等[23]研究了水分胁迫对糜子光合特性的影响,但是其试材仅有3个糜子品种,且研究时期为三叶一心的苗期,该时期功能叶片尚未发育成熟,气孔器仍处于发育阶段,不能最大限度发挥其生理功能。刘晓欢等[20]研究的糜子仅有5个品种,基因型太少,难以反映本物种的气孔特征。本研究选取来源于不同生态区的18个糜子种质资源,在叶片发育成熟期调查其光合生理特性,同时观察气孔密度等叶片性状特征,以期为糜子分类、抗逆机制研究及优异种质资源的发掘提供理论依据。
1 材料与方法
1.1 试验材料
选取来自6个糜子栽培生态区的18个糜子种质资源(表1),全部由中国农业科学院作物科学研究所提供。

表1 供试糜子种质及其来源
1.2 试验设计
于2013年7月在山西农业大学农学院农作站试验基地进行试验。试验田进行完全随机区组,每个品种分3个小区,每个小区为2 m×1 m规格,分为10列,每列播种20粒种子,株距约10 cm。
1.3 性状参数的测定
1.3.1 光合作用的测定
糜子叶片成熟期,于2013年8月9 日9:00~11:00 之间在自然光照下,用LI-6400XT光合仪测定各糜子种质旗叶的净光合速率(Pn) 、蒸腾速率(Tr) 、气孔导度(Gs)、胞间CO2浓度(Ci) 等,每个处理3次重复,取平均值。光照强度为 1000~1200 μmol·m-2·s-1,水分利用率(WUE)由Pn/Tr算得。
1.3.2 气孔密度和叶脉密度的测定
参照申鸽子等[19]的方法。
1.3.3 叶面积的测定
糜子属于禾本科作物,叶片为平行脉,叶片指数0.65。
叶面积/cm2= 叶长/cm×叶宽/cm×叶片指数
1.3.4 叶绿素含量的测定
用SPAD-502叶绿素测定仪测倒二叶和倒三叶,每个种质取3株。
1.4 数据分析
采用Microsoft Excel、SAS 统计软件,运用方差分析处理和分析数据,采用单因素方差分析(One-way ANOVA)比较不同生态区种质间的差异性,结果用平均值±标准误表示。
2 结果与分析
2.1 不同糜子种质主要光合特性的比较
从表2可以看出,不同糜子品种的光合特性Pn、Gs、Gi、Tr和WUE都有显著差异(P<0.05)。就Pn而言,14号最高,为35.91±2.02 μmol·m-2·s-1,16号品种最低,为9.71±2.34 μmol·m-2·s-1;就Tr而言,17号最大,为3.82±0.15 mmol·m-2·s-1,1号品种最小,为0.74±0.36 mmol·m-2·s-1。就WUE而言,1号最大,为27.97±0.96 μmol·mmol-1,16号品种最小,为0.24±0.14 μmol·mmol-1。各糜子品种的Tr与Pn的排序并不相同。因此,可以从光合生理方面筛选出高光合速率、低耗水量的品种。1号品种Tr最小、WUE最大,同时,Pn也较高,是较耐旱的品种,而16号品种Pn最小、WUE也最低,是较不耐旱的品种。

表2 糜子主要光合特性的比较
注:表内数据为平均值±标准误; 每列数据右侧字母不同者表示差异显著(P<0.05),表3同。
Note:Values are mean±SD.Values within a column followed by a different letter are significantly different atP<0.05.The same as table 3.
2.2 不同糜子种质叶片性状特征比较
测定了不同糜子种质的叶片相关性状。从表3可以看出,就倒二叶叶绿素含量而言,18个糜子品种的叶绿素含量介于25.37±1.3094~40.60±0.7000,其中6号最大,1号和6号之间差异不显著。就旗叶叶绿素含量而言,18个糜子品种的叶绿素含量介于26.57±0.6692~40.53±0.6936,其中17号最大,1号和17号之间差异不显著。就叶脉密度而言,18个糜子品种的叶脉密度介于4.36±0.0752~6.10±0.0578 条·mm-1,其中,11号最大。18个糜子品种的上表皮气孔密度介于55.73±6.6789~146.53±8.0087 个·mm-2,其中9号最大,11号最小,1号和11号之间差异不显著。18个糜子品种的下表皮气孔密度介于49.10±2.2984~120.83±3.6084 个·mm-2,其中1号最小,8号最大,16号和8号间差异不显著。18个糜子种质中,11个为上表皮气孔密度高于下表皮,6个下表皮气孔密度高于上表皮,1个上、下表皮气孔密度基本相等。说明糜子在长期的进化和演变中形成了(倒二叶、旗叶)叶绿素含量、叶脉密度和气孔密度的遗传多样性。其中,1号材料(倒二叶、旗叶)叶绿素含量均较高,气孔密度均较低。

表3 不同糜子种质叶片性状特征比较
2.3 不同糜子种质光合特性参数与叶片性状特征的相关性
对18个糜子种质光合特性参数与叶片性状特征的相关性进行了分析,由表4可以看出,在10个参数中,Pn分别与Tr和仅与WUE呈显著正相关;Tr与Ci和Tr均呈极显著正相关;Tr与Ci呈极显著正相关;CF与CS呈极显著正相关;USD与LSD呈极显著正相关。
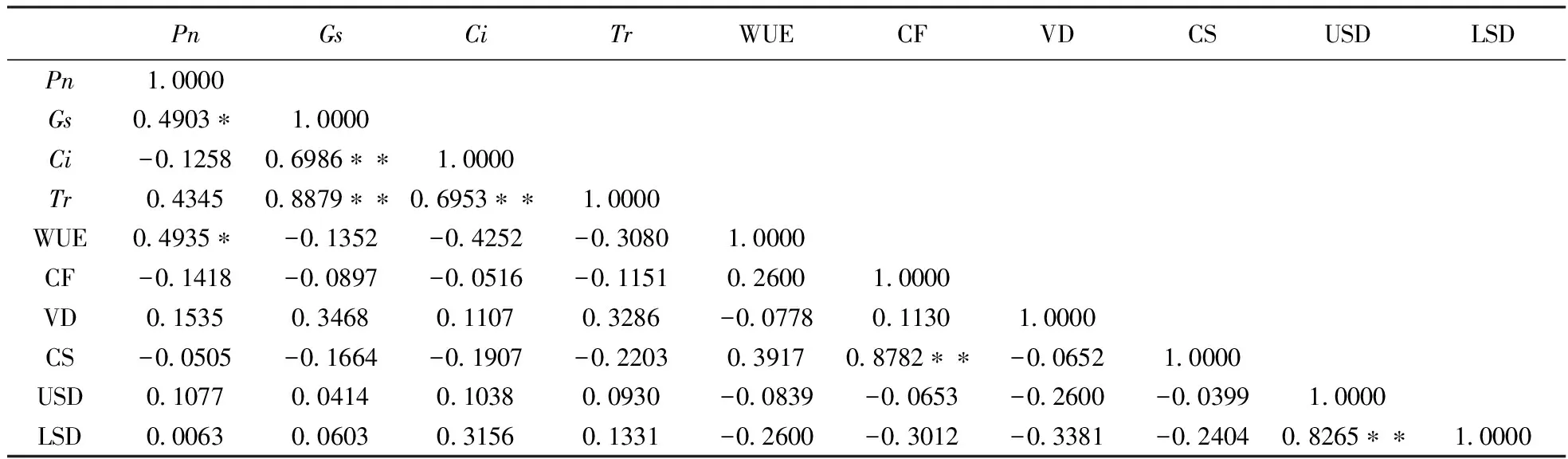
表4 糜子光合特性参数与叶片性状特征的相关性
注:表内每列数据右侧 *表示差异达显著水平(P<0.05); **表示差异达极显著水平(P<0.01)。
Note:Values within a column followed by * are significantly different atP<0.05, ** are significantly different atP<0.01.
3 结论与讨论
气孔器是植物茎、叶表皮上的附属结构,在叶片及非叶器官(主要是穗、穗下节间、旗叶鞘)上均有分布[24]。植物表皮上气孔器的大小、数量和分布是由物种内在基因型及所处的生态环境因子共同调控的。通常,气孔分布有单面型和双面型,上下表皮的气孔数有差异,气孔密度为5~1000 个·mm-2[25]。杨再强等[18]发现菊花的下表皮的气孔密度大于上表皮。小麦下表皮[19]、小麦上表皮[19]、杨树[26]、糜子上表皮[27]、桃树[28]、柑类[29]、楸树[17]、橘类[29]、滇楸[17]的气孔密度分别为48.33~55.42、67.17~79.07、76.7~139.4、128.26~142.38、144~446、400~500、600~700、700~800、850~1000 个·mm-2。本研究发现来自6个生态栽培区的18个糜子种质,气孔均属于双面型;且上表皮气孔数多于下表皮;上表皮气孔密度介于55.73±6.6789~146.53±8.0087 个·mm-2,下表皮气孔密度介于49.10±2.2984~120.83±3.6084 个·mm-2。这与本课题组之前对糜子的研究结果[20,27]一致。18个糜子种质中,来自宁夏的1号材料(八升半)上、下表皮的气孔密度均为最小,蒸腾小,水分利用率(WUE)最大,Pn较高,是较耐旱的种质;来自山西的16号材料(黄粮黍)上、下表皮气孔密度最大,蒸腾大,Pn最小、WUE最低,是较不耐旱的种质。气孔密度虽然属于静态性状, 但它会随光强、水分状况、生理状况和生育期的变化而变化[30]。冯晓敏等[23]研究发现抗旱程度不同的糜子对水分胁迫所做的应答有差异,强抗旱品种光合参数受水分胁迫影响小。虽然糜子本身比较耐旱,但是随着全球气温的逐渐升高、水资源的日益匮乏,筛选抗旱性强的优异糜子种质资源对保证全球粮食安全仍然具有非常重要的意义。
本研究发现糜子的叶脉密度和气孔密度间不存在相关性,这与之前对糜子的研究结果[27]一致,但与Tanaka等[31]对大豆的研究结果(叶脉密度和气孔密度呈正相关)不一致。究其原因,可能与物种内在的遗传特性有关,考虑到本研究试材(18份)偏少,又对70余份糜子种质资源进行了同样的研究,结果(未发表)仍然是叶脉密度和气孔密度间无相关性。刘晓欢等[20]对5个糜子品种的研究发现叶脉密度和上表皮气孔密度间呈极显著正相关(相关系数:0.9798),但是研究试材只有5份,不足以代表整个物种的特性。申鸽子等[19]对小麦的研究结果发现叶脉密度和下表皮气孔密度间呈显著负相关(相关系数:-0.9508),这可能与物种自身的光合特性存在差异有关,因为小麦属于C3植物,而糜子属于C4植物,相关机制有待进行深入的研究。
Gs是植物进行同化作用和蒸腾作用的重要生理指标,属于动态参数, 能够对各种生态因子的变化及时做出应答。气孔导度大有利于CO2的交换和叶肉CO2浓度的增加。本研究发现糜子叶片的Tr与光合特征因子Pn间的遗传差异存在极显著的正相关,这与Tanaka等[32]对大豆叶片、冯晓敏[23]对糜子、李茂松等[33]对小麦的研究结果类似。
本研究发现糜子的气孔导度和气孔密度间不存在相关性,这与蔡志全等[11]对7种热带雨林树木的研究结果一致。杨再强等[18]研究发现菊花的气孔导度与上表皮的气孔密度间不存在相关性,但是与下表皮的气孔密度间呈极显著正相关。说明不同物种气孔导度和气孔密度间的相关性不同。
本研究发现Tr与Ci显著正相关,这与金孝芳等[34]在茶树中的研究结果(Tr与Ci呈显著负相关)不一致,这可能与物种本身的特性有关。本研究发现,糜子不同种质间的WUE存在显著差异(P<0.05),这与冯晓敏[23]的研究结果一致。这一方面说明糜子种质的WUE存在遗传多样性,同时也表明该光合参数在一定程度上是受自身基因型调控的。
关于气孔密度的研究已经在拟南芥等植物中发现了4类调控因子,包括十字花科植物中发现的类枯草杆菌蛋白酶SDD1(STOMATAL DENSITY AND DISTRIBUTION 1)[35,36]、拟南芥促分裂原蛋白活化激酶级联(Mitogen-activated protein kinase, MAPK)、YODA gene (Mitogen-activated protein kinase kinase kinase,MAPKKK)、MAPKK(Mitogen-activated protein kinase kinase)[37,38]。气孔密度在糜子中的调控因子是什么基因?是否存在以上基因的同源基因,有待后续进一步的研究。
参 考 文 献
[1]桂耀林,李正理.中国松属(Pinus)针叶的比较解剖观察[J].植物学报,1963,11(1):44-66.
[2]邵邻相,张凤娟.6种松科植物叶表皮的扫描电镜观察[J].植物研究,2005,25(3):281-285.
[3]尹秀玲,温静,刘欣,等.蔷薇科12 属代表植物叶片气孔密度研究[J].北方果树,2008,1:4-6.
[4]Sterling C.Some features in morphology ofMetasequoia[J].American Journal of Botany,1949,36:461-471.
[5]斯行健.现代水杉叶部的表皮及小气孔的构造[J].中国科学,1951,2(2):239-243.
[6]姚壁君,胡玉熹.松柏类植物叶子的比较解剖观察[J].植物分类学报,1982,26(3):275-294.
[7]Srinivasan V,Friis E M.Taxodiaceous conifers from the upper cretaceous of Sweden[J].Biologiske Skrifter,1989,35:5-57.
[8]Liu Y J,Li C S,Wang Y F.Studies on fossilMetasequoiafrom northeast China and their taxonomic implications[J].Botanical Journal of the Linnean Society,1999,130:267-297.
[9]铁军,金山,李旭娇,等.濒危植物南方红豆杉叶片形态结构及气孔参数[J].东北林业大学学报,2008,36(9):24-27.
[10]苏俊霞,廖芬,黄玉源,等.泽米铁科三种植物的叶表皮特征[J].云南植物研究,2003,25(5):596-602.
[11]蔡志全,齐欣,曹坤芳.七种热带雨林树苗叶片气孔特征及其可塑性对不同光照强度的响应[J].应用生态学报,2004,15(2):201-204.
[12]郑淑霞,上官周平.近一世纪黄土高原区植物气孔密度变化规律[J].生态学报,2004,24(11):2457-2464.
[13]姚兆华,郝丽珍,王萍,等.沙芥属植物叶片的气孔特征研究[J].植物研究,2007,27(2):199-203.
[14]冯丽贞,刘玉宝,郭素枝,等.桉树叶片的解剖结构与其对焦枯病抗性的关系[J].电子显微学报,2008,27(3):229-234.
[15]Ciha A J,Brun W A.Stomatal size and frequency in soybeans[J].Crop Science,1975,15(3):309-313.
[16]魏岩,周桂玲.十字花科四属植物叶片的表皮特征[J].云南植物研究.1998,20 (4):407-412.
[17]赵秋玲,王军辉,马建伟,等.梓树属植物叶片的气孔特征[J].东北林业大学学报,2011,39(8):21-24.
[18]杨再强,张静,江晓东,等.不同R:FR值对菊花叶片气孔特征和气孔导度的影响[J].生态学报,2012,32(7):2135-2141.
[19]申鸽子,王瑞云,杨武德,等.五个小麦(Triticumaestivum)品种主要农艺性状的差异分析[J].山西农业大学学报:自然科学版,2013,33(5):378-382.
[20]刘晓欢,王瑞云,杜海娥,等.糜子(PanicummiliaceumL.)品种间农艺性状的形态解剖差异[J].山西农业大学学报:自然科学版,2013,33(4):295-298.
[21]Mott K A,Gibson A C,O′ Leary J W.The adaptive significance of amphistomatic leaves[J].Plant Cell Environ,1982,5:455-460.
[22]Mott K A,Michaelson O.Amphistomy as an adaptation to highlight intensity inAmbrosiacordifolia(Compositae) [J].Am J Bot,1991,78:76-79.
[23]冯晓敏,张永清.水分胁迫对糜子植株苗期生长和光合特性的影响[J].作物学报,2012,38 (8):1513-1521.
[24]张永平,王志敏,吴永成,等.不同供水条件下小麦不同绿色器官的气孔特性研究[J].作物学报,2006,32(1):70-75.
[25]Willmer C,Fricker M.Stomata 2nd edn[M].London:Chapman & Hall,1996.
[26]荐圣淇,赵传燕,赵阳,等.基于遥感图像处理技术胡杨叶气孔密度的估算及其生态意义[J].生态学报,2011,31(17):4818-4825.
[27]王瑞云,刘晓欢,申鸽子,等.5个糜子品种的形态指标差异分析[J].山西农业科学,2013,41(11):1167-1170.
[28]马之胜,贾云云,王建学,等.桃树叶片气孔大小的研究[J].江西农业学报,2008,20(5):30-31.
[29]李润唐,张映南,田大伦.柑橘类植物叶片的气孔研究[J].果树学报,2004,21(5):419-424.
[30]魏爱丽,董惠文,李雨春,等.小麦抗病性与气孔特性关系初探[J].作物杂志,2010(3):23-25.
[31]Tanaka Y,Fujii K,Shiraiwa T.Variability of leaf morphology and stomatal conductance in soybean [Glycinemax(L.) Merr.]cultivars[J].Crop Science,2010,50:2025-2032.
[32]Tanaka Y,Shiraiwa T,Nakajima A,et al.Leaf gas exchange activity in soybean as related to leaf traits and stem growth habit[J].Crop Science,2008,48:1925-1932.
[33]李茂松,王春艳,宋吉青,等.小麦进化过程中叶片气孔和光合特征演变趋势[J].生态学报,2008,28(11):5385-5391.
[34]金孝芳,贾尚智,石亚亚,等.不同绿茶品种(系)光合特性及叶绿素含量的比较研究[J].西南农业学报,2013,26(2):520-523.
[35]Berger D,Altmann T.A subtilisin-like serine protease involved in the regulation of stomatal density and distribution in Arabidopsis thaliana[J].Genes Dev,2000,14(9):1119-1131.
[36]Von Groll U,Berger D,Altmann T.The subtilisin-like serine protease SDD1 mediates cell-to-cell signaling during Arabidopsis stomatal development[J].Plant Cell,2002,14(7):1527-1539.
[37]Bergmann D C,Lukowitz W,Somerville C R.Stomatal development and pattern controlled by a MAPKK kinase[J].Science,2004,304(5676):1494-1497.
[38]Wang H C,Ngwenyama N,Liu Y D,et al.Stomatal development and patterning are regulated by environmentally responsive mitogen-activated protein kinases inArabidopsis[J].Plant Cell,2007,19(1):63-73.
