PEG模拟干旱胁迫对入侵植物牛膝菊(Galinsoga parviflora)抗氧化物酶系统的影响
2014-03-25董晶晶齐淑艳郭婷婷
董晶晶, 齐淑艳,2, 郭婷婷
(1. 沈阳大学 生命科学与工程学院, 辽宁 沈阳 110044;2. 辽宁省城市有害生物治理与生态安全重点实验室, 辽宁 沈阳 110044)
牛膝菊(Galinsogaparviflora)为菊科,属1年生草本植物,原产南美洲,1915年在中国云南宁蒗和四川木里采到标本,1964年在辽宁省大连市星海公园被发现,为东北地区新记录种[1].牛膝菊现在几乎遍布全国,适生于山坡、草地、田野、路旁、河堤等处,常常形成单优势种群落,表现出极强的竞争优势,危害旱田作物、蔬菜、果树,尤其是危害花卉、绿地、苗圃和公园,成为我国目前亟待控制的主要恶性杂草之一.牛膝菊为一种入侵性很强的物种,无论是在国外还是国内,都对其开展了深入的研究.到目前为止,对牛膝菊的研究主要包括分布特点和种群动态[2-3]、危害水平和控制技术[4]、化学成分及化感作用[5-7]、抗逆性及全球气候变化[8-9]等方面.抗氧化酶系统是植物应对各种环境胁迫的一个重要抗逆机制,在植物适应逆境的过程中扮演重要角色[10].本文研究牛膝菊在干旱胁迫下的生理生态特性变化,旨在了解该外来杂草在逆境条件下的生理适应机制,为预测其潜在的分布范围和有效治理该入侵种提供科学依据.
1 材料与方法
1.1 供试材料培养
牛膝菊种子采自沈阳大学校园,播种于装有混合土(V(草皮土)∶V(营养土)=1∶1)的塑料花盆内(直径为19 cm,高度为16 cm),每盆3株.牛膝菊幼苗在温室(昼夜温度25 ℃、空气相对湿度70%)中培养,定期浇水,经过56 d后,植株长到30~40 cm时,进行水分胁迫处理.
1.2 水分胁迫处理
分别配制质量分数为5%、10%、15%、20%、25%的PEG-6000溶液各300 mL,将植物根系完全浸入各梯度的溶液中进行处理,干旱胁迫处理持续4 d,每隔24 h进行生理指标的测定.每个处理重复3次,以蒸馏水处理作为对照(CK).
1.3 测定指标与方法
丙二醛(MDA)含量采用硫代巴比妥酸法测定[11];可溶性蛋白含量采用考马斯亮蓝法测定[12];超氧化物歧化酶(SOD)活性采用氮蓝四唑法(NBT)测定[13];过氧化物酶(POD)活性采用愈创木酚显色法测定[14].计算结果用每分钟内A470变化0.01为1个过氧化物酶活性单位(u·g-1)表示.
2 结果与分析
2.1 干旱胁迫对牛膝菊叶片MDA含量的影响
丙二醛(MDA)是植物膜脂氧化的最终产物,其含量的多少能反映膜的受损程度.图1表明,PEG质量分数在5%~20%区间随着干旱胁迫强度增加叶片MDA含量呈递增趋势,但PEG溶液质量分数达到25%时叶片MDA含量则有所下降,当PEG质量分数为20%时MDA含量达最大值(0.089 4 μmol/g),各干旱胁迫处理叶片MDA含量均高于CK.其中20%、25%的PEG-6000质量分数处理组与CK之间差异显著(P<0.05),其他处理组与CK之间差异不显著(P>0.05), 而各处理组间牛膝菊叶片中MDA的含量差异不显著(P>0.05)(见表1).干旱胁迫0~48 h,随着胁迫时间延长,各处理组MDA的含量呈递增趋势,干旱胁迫48~72 h,PEG-6000质量分数为25%、20%、5%溶液处理的牛膝菊叶片中MDA含量下降,差异不显著(P>0.05),而质量分数为10%、15%的PEG-6000溶液处理的牛膝菊叶片中MDA含量上升(P>0.05)(见图1).习金根等人对剑麻幼苗进行不同质量分数PEG处理时,剑麻幼苗叶片MDA的含量呈递增趋势,这一结论与本试验结论相符[15].还有学者曾经对燕麦幼苗进行干旱胁迫处理,结果表明燕麦幼苗中MDA的含量也是随着干旱胁迫强度的增强呈递增的趋势[16].

图1 干旱处理下牛膝菊叶片丙二醛质量摩尔浓度b的变化Fig.1 Changes in molal concentration of b in leaves of Galinsoga parviflora by the drought stress

表1 干旱处理下牛膝菊叶片生理指标的变化Table 1 The changes of physiologic indexes in leaves of Galinsoga parviflora by drought stress
注: 同列中不同小写字母表示处理间在0.05水平存在显著差异.
2.2 干旱胁迫对牛膝菊叶片可溶性蛋白含量的影响
可溶性蛋白是植物细胞内的保护性物质,它能有效调节植物细胞的原生质代谢水平.图2表明,随着干旱胁迫强度的增大,各处理组之间牛膝菊叶片可溶性蛋白含量均低于对照组(CK),且处理间差异不显著(P>0.05)(见表1).随着干旱胁迫时间延长,可溶性蛋白含量总体上呈现下降的趋势.胁迫时间在0~24 h,不同PEG质量分数处理,牛膝菊叶片中可溶性蛋白质量分数下降幅度较大,分别下降了质量分数35%、37%、38%、39%和36%;胁迫时间在24~72 h,不同PEG质量分数处理,牛膝菊叶片中可溶性蛋白质量分数变化不大,下降幅度平缓,说明牛膝菊对环境的改变呈适应状态,因此可溶性蛋白含量保持稳定(见图2). 有学者在干旱条件下对外来入侵植物铜锤草进行生理指标研究时发现,铜锤草中蛋白的含量随着干旱胁迫程度的增加和时间延长表现出下降的趋势[17].

图2 干旱处理下牛膝菊叶片可溶性蛋白含量变化Fig.2 The soluble protein contents of Galinsoga parviflora by the drought stress
2.3 干旱胁迫对牛膝菊叶片SOD活性的影响
SOD是植物体内清除活性氧自由基的保护酶,能使植物体在一定的胁迫范围内免受自由基的损伤.测定结果表明(见图3),随着干旱胁迫强度的增大,牛膝菊叶片中SOD活性呈先上升后下降的趋势,20%处理组的牛膝菊叶片SOD活性最高,为1 632.40 u·g-1.各处理组之间牛膝菊叶片SOD活性均高于对照组(CK),其中20% PEG-6000溶液处理的牛膝菊叶片中SOD活性与CK之间差异显著(P<0.05),其他处理组与CK之间则无显著性差异(P>0.05).各处理组间,5% PEG-6000溶液处理的牛膝菊叶片中SOD活性与20%PEG-6000溶液处理的牛膝菊叶片中SOD活性相比,具有显著差异(P<0.05),其他处理组间牛膝菊叶片中SOD活性差异不显著(P>0.05)(见表1).随着干旱胁迫的时间延长,0~24 h 时间段不同质量分数的PEG处理其叶片中SOD活性呈显著上升趋势,与CK相比分别提高了1.7、2.4、3.7、6和5.2倍,而20%、25%PEG SOD的活性达到最大,表明此时SOD活性达到最强;24~48 h时间段,PEG质量分数为5%、10%、15%处理组,叶片中SOD活性表现为上升趋势但平缓,分别提高了1.21、1.22和1.03倍,而PEG质量分数为20%和25%处理组则呈下降趋势,分别下降了81%和83%;48~72 h时时间段,PEG质量分数为5%、10%、15%处理组,叶片中SOD活性表现为下降趋势,而PEG质量分数为20%和25%处理组则呈上升趋势.质量分数20%的PEG-6000溶液处理各个时间段的牛膝菊叶片中SOD活性均高于质量分数25%的PEG-6000溶液处理组,这是由于干旱胁迫过大,质量分数25%PEG-6000处理组的牛膝菊植株不能很好地适应环境,在干旱胁迫初期,部分植物细胞失水死亡,因此SOD的活性也受到影响(图3).马丹炜等人在对加拿大飞蓬进行干旱胁迫的生理研究时发现,加拿大飞蓬叶片中的SOD活性变化是:上升—下降—上升,这一结论与本实验的结果不全相同,表明两种入侵植物在抗旱机理方面具有各自的保护机制.牛膝菊在干旱胁迫初期,SOD活性变化剧烈,能对外界环境变化快速作出反应,增加自身保护酶活性[18].

图3 干旱处理下牛膝菊叶片超氧化物歧化酶活性变化Fig.3 The activity of SOD of Galinsoga parviflora by the drought stress
2.4 干旱胁迫对牛膝菊叶片POD活性的影响
POD可作为组织老化的一种生理指标,它与SOD一起相互作用,清除植物体内的自由基离子.POD测定结果表明,随着干旱胁迫强度的增大,牛膝菊叶片中过氧化物酶活性变化呈现先上升后下降的趋势,其中质量分数20%PEG-6000溶液处理的牛膝菊叶片中POD活性是为所有处理组最高,为5.811 4 u·g-1.经质量分数25% PEG-6000溶液处理的牛膝菊叶片中POD变化值低于质量分数为10%、15%、20%的处理组,这是由于随着干旱胁迫程度加强,POD活性发生改变,酶失活.各处理组与对照组相比,牛膝菊叶片中POD活性无显著性差异(P>0.05),且各处理组间牛膝菊叶片中POD活性差异不显著(P>0.05)(见表1).随着干旱胁迫时间的延长, 胁迫初期(0~24 h),质量分数为10%、15%、20%PEG处理的牛膝菊叶片中POD活性呈现明显的上升趋势,而5%PEG和25%PEG处理,牛膝菊叶片中的POD呈现下降趋势;胁迫中期(24~48 h),各处理组的POD均呈下降趋势,其中质量分数为10%、15%、20%PEG处理的POD下降明显,分别下降了34%、14%和26%.胁迫后期(48~72 h),质量分数为15%、25%PEG处理组的POD活性呈明显上升趋势,而其他处理组的POD活性呈下降趋势.在PEG溶液处理0~24 h时,质量分数为10%、15%、20%PEG处理的牛膝菊叶片中POD活性有一个突增的趋势,这是牛膝菊内部诱导性表达生成POD的结果,牛膝菊在干旱逆境过强时,做出对环境适应性的改变,形成新的POD,维持自身生理结构[19].随着干旱胁迫时间的增加,牛膝菊为了适应环境的变化,激发内在保护机制,POD的活性出现明显的变化,与SOD协同作用,清除植物体积累的自由基负离子.当干旱胁迫达到更高时,POD的活性开始失活,所以各个时间点总体的变化不是很明显(见图4).李龙梅对二月兰进行生理生化研究时发现,随着处理时间的延长和胁迫程度的增加,二月兰的POD活性总体上也是呈现先上升后下降的趋势[20].
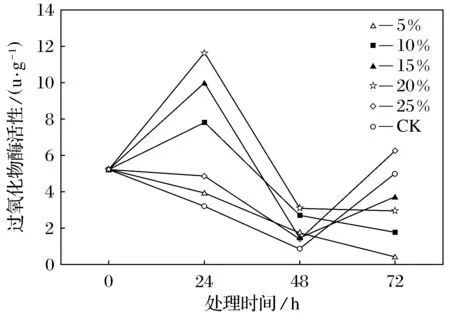
图4 干旱处理下牛膝菊叶片过氧化物酶活性变化Fig.4 The activity of POD of Galinsoga parviflora by the drought stress
3 结论与讨论
本试验探讨了在干旱胁迫下牛膝菊叶片抗氧化物酶系统的变化,结果显示,随着干旱胁迫强度的增加,MDA的含量、SOD活性和POD活性呈现先上升后下降的趋势,在PEG质量分数为20%时MDA的含量、SOD活性和POD活性达到最大值;可溶性蛋白含量随着胁迫强度的增加在15%时达最大值,PEG质量分数达25%时,MDA的含量、可溶性蛋白含量、SOD活性和POD活性降低.不同PEG质量分数处理,MDA的含量、SOD活性、POD活性(除5%PEG外)均高于CK,差异不显著(P>0.05),而不同PEG质量分数处理下可溶性蛋白的含量均低于CK,差异不显著(P>0.05).随着干旱胁迫时间的延长,0~24 h时,不同PEG质量分数处理下丙二醛含量、SOD活性显著增加,可溶性蛋白含量显著减少,而POD活性在质量分数10%~20%PEG处理下呈递增趋势;24~72 h时,不同PEG质量分数处理下丙二醛含量、可溶性蛋白含量、SOD活性变化较小,而POD活性在24~48 h时,10%~20%PEG处理下降显著.
植物在干旱逆境条件下,膜脂发生氧化,生成大量的丙二醛.丙二醛能使大分子物质发生交联,破坏细胞正常生理功能,因此,丙二醛是反映植株受损伤程度的重要指标.植株的受损伤程度越大,植株的抗旱能力越差,丙二醛的含量越高.PEG质量分数在5%~15%时,牛膝菊叶片中MDA含量上升,但与对照相比差异不显著,说明质量分数5%~15%PEG时的干旱胁迫对膜脂的伤害程度较低,牛膝菊能正常生长.PEG质量分数达20%~25%时,牛膝菊叶片中MDA含量急剧上升,说明高质量分数PEG胁迫已经对牛膝菊的膜系统造成严重伤害,细胞受到毒害作用非常大,造成植株的死亡.
植株在干旱逆境时,细胞内的蛋白和核酸等大分子物质发生聚合,导致植株细胞内可溶性蛋白的含量降低.细胞正常的生理功能受到影响[21-23].就本试验而言,牛膝菊叶片在干旱胁迫初期大量分泌可溶性蛋白,初步抵抗逆境.0~24 h时,经不同质量分数的PEG处理,可溶性蛋白的含量呈显著下降趋势.这是由于牛膝菊对PEG-6000溶液比较敏感,为了适应环境,其迅速做出相应机能的改变,大量蛋白发生聚集交联,蛋白消耗增多,植株自身代谢不能进行,自身的防御机能逐渐减弱最终导致植物死亡.
植物在干旱逆境的环境里,容易产生许多的活性氧自由基物质.这些物质的积累能够使植物细胞发生膜脂氧化作用,植物体内活性氧清除系统主要包括SOD、POD和CAT.其中SOD是存在于植物细胞中最重要的内源活性氧清除酶之一,SOD能够有效地将自由基负氧离子转化成过氧化氢,从而保护植物免受活性氧伤害,其酶活力与植物抗逆性关系密切.在其耐受范围内,水胁迫程度越严重,SOD活性越高.在PEG质量分数从5%~15%的变化过程中,SOD活性变化相对比较缓慢,说明当其胁迫质量分数在这一范围内时,牛膝菊能较好地生长,其体内产生的超氧化物负离子少,当胁迫质量分数超过20%时,SOD活性开始下降,说明此时PEG质量分数对于牛膝菊来说是重度胁迫由这种胁迫而产生的膜脂过氧化产物及超氧负阴离子对牛膝菊造成了很严重的损伤,导致其SOD自身活力严重下降.SOD活性在不同质量分数的PEG处理下均高于CK, 说明当干旱胁迫达到一定的积累时,其诱导牛膝菊产生大量的酶进行自我保护,这一结果与马丹炜等对加拿大飞蓬的研究结果一致[24].
POD是维持植物细胞正常生理的一种保护酶,一般认为抗旱性弱的种类,POD增加幅度较大.在干旱胁迫初期,外界环境变化诱导植株产生大量POD,并与SOD联合作用共同清除膜脂氧化产生的自由基离子,保护植株的正常生理功能[25-26].本试验中牛膝菊在不同程度的干旱胁迫下均能依靠POD活性来防止氧化物的毒害.在PEG质量分数由5%升至20%过程中,牛膝菊叶片中POD活性协同SOD活性上升,当PEG质量分数超过20%时,POD活性协同SOD活性下降,POD为SOD清除超氧负阴离子的后续反应酶,其变化趋势与SOD相一致.
从以上实验结果得出:牛膝菊随着处理时间的延长,在PEG质量分数为20%时,各项生理指标含量均达到最大值;当PEG质量分数为25%时,牛膝菊叶片中各种生理指标的含量均下降,表明质量分数20%PEG是牛膝菊抗旱的极限.20%PEG模拟的干旱水平换算成壤土土壤含水质量分数为28%~29%;换算成沙土土壤含水质量分数为9%~10%;换算成黏土土壤含水质量分数为52%~53%.因此当不同质地土壤含水质量分数低于20%PEG模拟的干旱水平时,不适合牛膝菊生长.
参考文献:
[ 1 ]李书心. 辽宁植物志:下册[M]. 沈阳:辽宁科学技术出版社, 1992:496.
(Li Shuxin. Liaoning Flora: Volume Two[M]. Shenyang: Liaoning Science and Technology Press, 1992:496.)
[ 2 ]潘争红,赵檑,黄荣,等. 牛膝菊中的萜类及甾醇类成分[J]. 云南大学学报:自然科学版, 2007,29(6):613-616.
(Pan Zhenghong, Zhao Lei, Huang Rong, et al. Terpenes and Sterols fromGalinsogaparviflora[J]. Journal of Yunnan University: Natural Sciences Edition, 2007,29(6):613-616.)
[ 3 ]郭振清,赵永光,张风娟,等. 入侵植物牛膝菊对白菜、萝卜、生菜、油菜种子和幼苗的化感作用[J]. 河北科技师范学院学报, 2008,22(3):13-16.
(Guo Zhenqing, Zhao Yongguang, Zhang Fengjuan, et al. Allelopathic Effects of the Invasive PlantGalinsogaparvifloraCav.Ic.et Descr. onBrassicapekinensisRupr.,RaphanussativusL.,LactucasativaL. Var.romanaHort. andBrassicaChinensisL.[J]. Journal of Hebei Normal University of Science and Technology, 2008,22(3):13-16.)
[ 4 ]马丹炜,范雪涛,葛方兰,等. 低温胁迫对辣子草水浸提液化感作用的影响[J]. 热带亚热带植物学报, 2008,16(6):526-530.
(Ma Danwei, Fan Xuetao, Ge Fanglan, et al. The Allelopathy of Aqueous Extracts fromGalinsogaparvifloraunder Low Temperature Stress[J]. Journal of Tropical and Subtropical Botany, 2008,16(6):526-530.)
[ 5 ]齐淑艳,徐文铎,文言. 外来入侵植物牛膝菊种群构件生物量结构[J]. 应用生态学报, 2006,17(12):2283-2286.
(Qi Shuyan, Xu Wenduo, Wen Yan. Bimass Structure of Exotic Invasive PlantGalinsogaparviflora[J]. Chinese Journal of Applied Ecology, 2006,17(12):2283-2286.)
[ 6 ]齐淑艳,徐文铎. 辽宁外来入侵植物种类组成与分布特征的研究[J]. 辽宁林业科技, 2006(3):11-15.
(Qi Shuyan, Xu Wenduo. Study on Types Composition and Distribution Characteristics of Alien Invasive Plants in Liaoning[J]. Liaoning Forestry Science and Technology, 2006(3):11-17.)
[ 7 ]何永福,陆得清,叶照春,等. 50%乙草胺对旱地杂草辣子草防除效果研究[J]. 植物保护, 2007,33(4):132-134.
(He Yong, Lu Deqing, Ye Zhaochun, et al. Effcacy of 50% Acetochlor EC for ControllingGalinsogaparuifloraCav in the Field[J]. Plant Protection, 2007,33(4):132-134.)
[ 8 ]范雪涛,马丹炜,向莎,等. 不同逆境条件下辣子草抗氧化酶系统的变化[J]. 应用与环境生物学报, 2008,14(5):616-619.
(Fan Xuetao, Ma Danwei, Xiang Sha, et al. Change in Antioxidant Enzymes ofGalinsogaparvifloraCav. under Environmental Stresses[J]. Chinese Journal of Applied & Environmental Biology, 2008,14(5):616-619.)
[ 9 ]齐淑艳,郭晓华,赵明. CO2与O3浓度升高对入侵植物牛膝菊叶片形态特征的影响[J]. 东北师大学报:自然科学版, 2009,41(2):149-153.
(Qi Shuyan, Guo Xiaohua, Zhao Ming. Effects of Elevated Carbon Dioxide and Ozone Concentrations on Leaf Morphological Characteristics of Invasive PlantGalinsonaparviflora[J]. Journal of Northeast Normal University: Natural Science Edition, 2009,41(2):149-153.)
[10]Prasad T K. Role of Catalase in Inducing Chilling Tolerance in Pre-EmergentMaizeSeedlings[J]. Plant Physiology, 1997,114(4):1369-1376.
[11]张慧茹. 生物化学试验原理和方法[M]. 银川:宁夏人民出版社, 1999:59-63.
(Zhang Huiru. Principles and Methods of Biochemical Experiments[M]. Yinchuan: Ningxia People’s Publishing House, 1999:59-63.)
[12]汪家政,范明. 蛋白质技术手册[M]. 北京:科学出版社, 2000:45-46.
(Wang Jiazheng, Fan Ming. Protein Technical Manuals[M]. Beijing: Science Press, 2000:45-46.)
[13]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社, 2000:167-169.
(Li Hesheng. The Experimental Principles and Techniques of Plant Physiology and Biochemistry[M]. Beijing: Higher Education Press, 2000:167-169.)
[14]张志良,瞿伟菁. 植物生理学实验指导[M]. 北京:高等教育出版社, 1990:154-155.
(Zhang Zhiliang, Qu Weijing. The Guidance of Plant Physiology and Experimental[M]. Beijing: Higher Education Press, 1990:154-155.)
[15]习金根,郑金龙,易克贤. 干旱胁迫对剑麻幼苗生理生化的影响[J]. 中国麻业科学, 2012,34(5):216-218.
(Xi Jingen, Zheng Jinlong, Yi Kexian. Effect of Drought Stress on Physiology and Biochemistry ofSisalSeedling[J]. Plant Fiber Sciences in China, 2012,34(5):216-218.)
[16]罗佳,叶鸿程,刘兴林,等. 水分胁迫对燕麦生理指标的影响[J]. 高原山地气象研究, 2012,32(3):59-61.
(Luo Jia,Ye Hongcheng,Liu Xinglin, et al. Effect of Water Stress on Physiological and Biochemical Index of Oats[J]. Plateau and Mountain Meteorology Research, 2012,32(3):59-61.)
[17]陈明林,王友保. 水分胁迫下外来种铜锤草和本地种酢浆草的生理指标比较研究[J]. 草业学报, 2008,17(6):52-59.
(Chen Minglin,Wang Youbao. A Comparative Study on the Physiological Properties of the Exotic SpeciesOxaliscorymbosaand the Native SpeciesOxaliscorniculataunder Water Stress[J]. Acta Prataculturae Sinica, 2008,17(6):53-56.)
[18]陈丽萍,范雪涛,马丹炜. 入侵植物辣子草对油菜幼苗抗氧化系统的化感效应[J]. 西南农业学报, 2008,21(2):332-334.
(Chen Liping, Fan Xuetao, Ma Danwei. Allelopathic Effects ofGalinsogaparvifloraCav. on Antioxidant Enzyme Systems in Rape Seedlings[J]. Southwest China Journal of Agricultural Sciences, 2008,21(2):332-334.)
[19]曹慕岚,罗群,张红,等. 入侵植物加拿大飞蓬(ErigeroncanadensisL.)生理生态适应初探[J]. 四川师范大学学报:自然科学版, 2007,30(3):387-390.
(Cao Mulan, Luo Qun, Zhang Hong, et al. Study on Ecophysioloical Adaptability of Invasive PlantErigeroncanadensisL.[J]. Journal of Sichuan Normal University: Natural Science, 2007,30(3):387-390.)
[20]李龙梅,王毅承,严海鸥. 二月兰对水分胁迫生理生化的响应[J]. 内蒙古农业大学学报:自然科学版, 2012,34(2):35-36.
(Li Longmei, Wang Yicheng, Yan Haiou. Changes of Physiological and Biochemical in Water Stress ofOrychopragmusviolaceus[J]. Journal of Inner Mongolia Agricultural University: Natural Science Edition, 2012,33(2):35-36.)
[21]康俊梅,杨青川,樊奋成. 干旱对苜蓿叶片可溶性蛋白的影响[J]. 草地学报, 2005,13(3):199-202.
(Kang Junmei, Yang Qingchuan, Fan Fencheng. Effects of Drought Stress on Induced Protein in the Different DroughtAlfalfaLeaf[J]. Acta Agrestia Sinica, 2005,13(3):201-202.)
[22]高京草,王慧霞,李西选. 可溶性蛋白、丙二醛含量与枣树枝条抗寒性的关系研究[J]. 北方园艺, 2010,2(23):18-20.
(Gao Jingcao, Wang Huixia, Li Xixuan. Relationship between Soluble Protein, MDA, and Jujube Tree Cold Hardiness[J]. Northern Horticulture, 2010,2(23):18-20.)
[23]何云,李贤伟,李西. 2种野生岩生植物叶片可溶性蛋白含量对低温胁迫的响应[J]. 安徽农业科学, 2008,36(18):7552-7553.
(He Yun, Li Xianwei, Li Xi. Response of Two Kinds of Wild Rock Plant Leaf Soluble Protein Content to Low Temperature Stress[J]. Journal of Anhui Agricultural Sciences, 2008,36(18):7552-7553.)
[24]范雪涛,马丹炜,于树华,等. 辣子草对3种农作物的化感作用[J]. 环境科学与技术, 2007,30(10):7-8.
(Fan Xuetao, Ma Danwei, Yu Shuhua, et al. Allelopathic Effects ofGalinsogaparvifloraon Crops[J]. Environmental Science and Technology, 2007,30(10):7-8.)
[25]王建华,刘鸿先,徐同. 超氧物歧化酶(SOD)在植物逆境和衰老生理中的作用[J]. 植物生理学通讯, 1989,1(1):1-7.
(Wang Jianhua, Liu Hongxian, Xu Tong. The Role of Superoxide Dismutase (SOD) in Stress Physiology and Senescence Physiology of Plant[J]. Plant Physiology Communications, 1989,1(1):1-7.)
[26]朱秀敏. 超氧化物歧化酶的生理活性[J]. 当代医学, 2011,17(15):26-27.
(Zhu Xiumin. The Physiological Activity of Superoxide Dismutase[J]. Contemporary Medicine, 2011,17(15):26-27.)
