氮源与其补加方式对1,3-丙二醇生物合成的影响
2014-03-25乔建援齐笑飞孙沛勇杜风光
乔建援,赵 峰,齐笑飞,孙沛勇,杜风光
(河南天冠企业集团有限公司 试验中心,河南 南阳473000)
0 引言
1,3-丙二醇(1,3-propanediol,以下简称PDO)是一种重要的精细化工原料,主要用作合成聚酯和聚氨酯的单体等[1]. 近几年的研究表明,以PDO 为单体合成的对苯二甲酸丙二醇酯(PTT)具有优良的加工、染色等性能[2],可以广泛地应用于纺织工业.最近十几年国际市场上甘油的生产过剩,也促进了甘油生物转化法生产PDO 的研究.和化学法相比,微生物转化法具有安全、环保和可持续发展性,特别是随着石化资源的日益枯竭,生物基化学品的研究不断升温,微生物转化法生产PDO 已成为研究的热点[3-4].
陶春平等研究表明[5]:培养基中氮浓度较低时,菌体生长和产物生成都会因氮源不足受到影响;氮源浓度较高时会导致菌体过度生长和副产物的大量生成,降低PDO 的最终浓度以及甘油生产1,3-丙二醇的转化率. 笔者在进行产业化评估时发现,以目前的培养基配方来进行产业化,不仅成本高,而且在氮源的添加方面没有一个较好的控制方式,这必将制约PDO 的产业化.
笔者从培养基成本及氮源的控制角度出发,研究了3 种不同的有机氮源、无机氮源用量情况以及不同的补加方式下对发酵法生产1,3-丙二醇的影响.
1 实验部分
1.1 菌株与培养基
克雷伯氏肺炎杆菌:河南天冠企业集团有限公司车用燃料生物技术国家重点试验室保存.
种子培养基(g/L)[6]:K2HPO4·3H2O 7.0,(NH4)2SO44.0,KH2PO42.0,MgCl2·6H2O 0.1,酵母浸粉1.0,微量元素液0.3 mL,pH 值7.0.
发酵培养基(g/L):K2HPO4·3H2O 6. 8,NaH2PO4·2H2O 1.38,(NH4)2SO43.5,MgSO4·7H2O 0.26,酵母浸粉1.0,微量元素液0.3 mL,pH 值7.0.
1.2 试剂和仪器
化学试剂均为市购,分析纯;酵母浸粉为安琪FM801;玉米浆粉为上海西王淀粉糖有限公司产品;全脂黄豆粉为本地黄豆经粉碎而成.
全自动发酵罐为上海国强生化装备有限公司出产.摇床采用上海智诚ZHWY -2112C 型. pH监测采用Mettler Inpro2000 型电极,M400 变送器.
1.3 培养方法
种子培养条件:三角瓶装液量50 mL/250 mL,摇床培养温度37 ℃,转速175 r/min ,培养时间12 h.
发酵采用50 L 全自动发酵罐,初始发酵培养基体积35 L,接种量1%(质量分数),初始甘油浓度25 g/L,发酵液pH 值6. 3,发酵温度37 ℃,转速120 r/min,风量为0.56 Nm3/h. 采用2 mol/L 的氢氧化钠溶液控制发酵过程中pH 值,过程流加甘油,发酵时间48 h.
1.4 分析方法
1.4.1 生物量
生物量通过测定发酵液在650 nm 下的吸光度值转换所得.分光光度计采用Unico722 型.
1.4.2 化学成分的测定
甘油、PDO 及副产物中的有机酸[7]采用高效液相色谱法测定.高效液相色谱为安捷伦1200.
1.4.3 氨氮的测定方法
氨氮的测定采用HJ 535—2009[8]中的碘化汞-碘化钾-氢氧化钠法测定,添加酒石酸钠钾来消除金属离子的影响. 分光光度计采用Unico722 型.
2 结果与讨论
2.1 初始氮用量对PDO 生物合成的影响
通过试验发现,如果降低初始氮用量,会延长菌体的对数生长期,且PDO 的最终含量也较高.因此,选择基础培养基中初始氮用量的50%、75%、100%(质量比)为条件,保持3 种条件下发酵全过程总氮用量相同,研究了初始氮用量对发酵的影响,结果如图1 所示.

图1 不同的初始氮用量对发酵的影响Fig.1 Effects of different initial nitrogen content in the fermentation
由图1 可知,当初始氮用量过低时,PDO 合成明显放慢,且操作中,补氮时间明显提前,在9 h左右就必须补入氮源,补氮后菌浓出现了快速提升.由于菌体处于亚健康状态,50%的初始氮用量下的最终PDO 的合成远低于另两种方式.而初始氮用量100%的条件下,菌体的增长明显较快,但PDO 的增长低于75%的状态.
同时测量了不同初始氮用量下的培养基在消毒前后的氨氮含量,如表1 所示. 从表1 可以看出,起始氮源用量高时,氨氮的损失也大,消毒后培养基的颜色也较深.因此认为,消毒时在高温的作用下氨氮与培养基中的糖分发生美拉德反应,从而损失了部分氨氮,产生了氨基糖,造成了发酵液颜色加深.

表1 不同初始氮用量下氮源的损失率Tab.1 The nitrogen loss rate of different initial nitrogen by disinfection treatment
2.2 纯无机氮对PDO 生物合成的影响
在做学术研究时,试验方案中可以采用优质的氮源为原料,但大生产中高成本将是一个新产品进入市场的关键制约因素.因此,笔者试验了纯无机氮源对PDO 生物合成的影响,结果如图2 所示.

图2 纯无机氮源对PDO 生物合成的影响Fig.2 Effects of pure inorganic nitrogen sources on PDO biosynthesis
试验组选用了初始氮用量的75%,两次间隙补加无机氮源,保持总氮用量不变,对照组也为初始氮用量的75%. 图2 的对比试验表明,纯无机氮对菌体生长基本没有影响,但PDO 合成速度低,且合成滞后,发酵终了PDO 的含量低.表明纯无机氮无法提供产物合成用的一些微量生物因子.
2.3 有机氮对PDO 生物合成的影响
针对工业中常使用的几种有机氮源,笔者选用安琪酵母浸粉、西王玉米浆粉、全脂黄豆粉等3 种有机氮源进行了对比试验,试验结果如图3 所示.
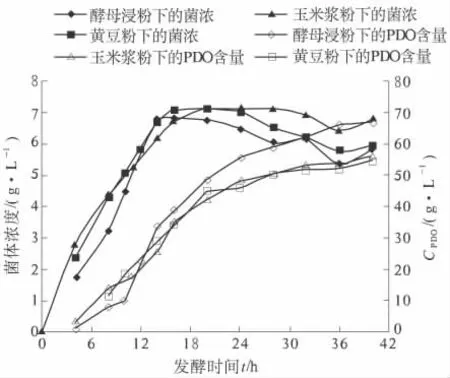
图3 等量有机氮下对发酵的影响Fig.3 Effect on Fermentation of equal amount of organic nitrogen
试验表明,相同用量下后两者比酵母浸粉差.因此,笔者对不同氮源的添加量进行了优化,结果如图4 所示.通过优化试验发现,3.0 g/L 玉米浆粉、2.5 g/L 的全脂黄豆粉与1.0 g/L 酵母浸粉的PDO 生物合成结果相当.但全脂黄豆粉虽提供了充足的有机物,却在发酵中产生了大量的泡沫,对发酵的影响较大,因此,玉米浆粉是PDO 产业化中的最佳选择.
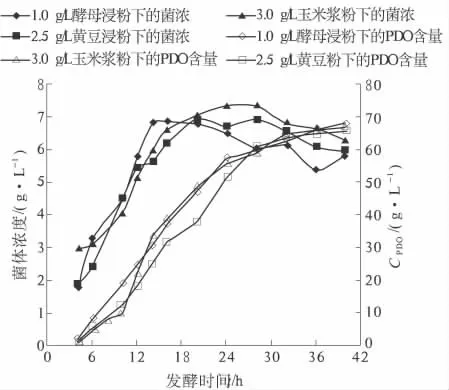
图4 优化后不同有机氮对发酵的影响Fig.4 Effect of different organic nitrogen on fermentation after optimizing
2.4 补加方式对PDO 生物合成的影响
为了分析氮源浓度对发酵的影响,笔者试验了3 种补加方式:二次间隙补料、连续稳定的补加、与pH 值耦合补加,试验结果如图3 所示. 试验表明:常用的二次间隙补料存在着氨氮浓度的起伏,对菌株的生长不利;而连续稳定的补加方式,在发酵中前期发酵液氨氮含量会逐渐下降,使PDO 合成较慢,而后期最终发酵液中氨氮含量的增加,不利于废水的处理.
随后笔者选用了与pH 值调控耦合的补加方式,分析了发酵过程pH 值与氮源消耗的变化规律.该补加方式前期主要产乙酸,乙酸有利于PDO 的生成[9],此时氮源消耗随碱液消耗的增大而增大,后期产乳酸,氮源消耗与碱液消耗基本没有关系.因此,笔者选择了前24 h 与pH 值的调控耦合补加氮源,而后期停止补加的方式,并取得较好的发酵结果,试验结果如图5.
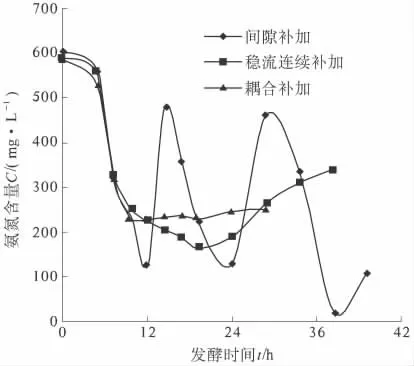
图5 3 种补加方式下氨氮的变化曲线Fig.5 Variation curves of ammonia nitrogen in three feeding mode
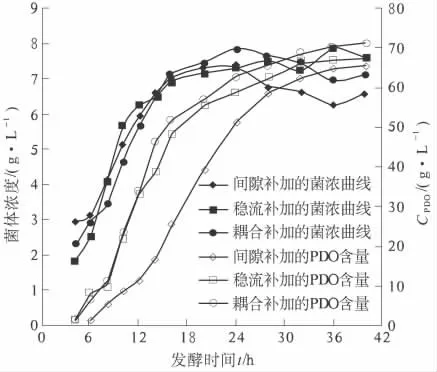
图6 3 种补加方式的发酵的影响Fig.6 Effects of three kinds of adding method in fermentation
试验表明:连续补加有利于氨氮含量的稳定,对菌株生长及PDO 生物合成有利;而与pH 值调控相耦合的补加方式,更有利于发酵料中氨氮含量的稳定,有利于大生产中的操控.试验证明,采用与pH 值调控相耦合的方式,PDO 的最终含量提高到72.5 g/L.
3 结论
(1)本试验表明,纯有机氮只能提供菌株生长需要的氮源,但无法提高PDO 的产量,说明必要的有机氮源添加是促进PDO 生物合成的有效方式.
(2)初始氮含量的控制不仅有效地减少氮源的损失,而且能促进菌株转化甘油为PDO,提高最终发酵液中PDO 的含量.氮源与糖类物质的美拉德反应所产生的物质是否会阻碍菌株合成PDO 仍有待研究.
(3)3.0 g/L 的玉米浆粉与1.0 g/L 的酵母浸粉均能有效地促进甘油转化为PDO.说明玉米浆粉可以成为工业大生产中的有机氮源,从而降低产品的生产成本.
(4)氮源的补加方式是PDO 生物合成的一个重要的影响因子,控制稳定的氮源浓度使得PDO的生物合成可以得到显著的提高. 采用与pH 值调控相耦合的补加方式能有效地稳定发酵液中的氮源浓度,使PDO 的最终含量达到72.5 g/L.
[1] 刘德华,刘宏娟,程可可. 微生物发酵法生产1,3-丙二醇研究进展[J].合成纤维,2005,(6):11 -15.
[2] ZHANG Zong-ming,HU Qiu-long. Statistical optimization of culture conditions for 1,3-propanediol by klebsiella pneumoniae AC15 via control composite design[J].Bioresonce Technology,2008,99:1052-1056.
[3] 刘婷,刘均洪,刘登. 微生物转化甘油生产1,3-丙二醇的研究进展[J].上海化工,2010(4):24 -27.
[4] 张文斗,孟宋冬,马春玲,等.微生物法生产1,3-丙二醇的研究进展[J]. 山东轻工业学院学报,2011(4):11 -14.
[5] 陶春平,刘朋波,宫衡,等. 控制氮源浓度提高1,3-丙二醇的发酵水平[J]. 化学与生物工程,2007,(5):38 -41.
[6] 徐佳杰,刘朋波,宫衡,等.1,3-丙二醇发酵过程中盐浓度的胁迫作用[J]. 生物工程学报,2008,24(6):1098 -11021.
[7] 张浩勤,张伟,刘金盾,等.气相色谱法测定牛粪厌氧发醇液中挥发性脂肪酸[J].郑州大学学报:工学版,2007(2):51 -53.
[8] 中国环境保护部. HJ 535—2009,水质 氨氮的测定纳氏试剂分光光度法[S].北京:中国环境科学出版社,2009.
[9] 张延平. 1,3-丙二醇生物合成过程中的辅因子代谢调控[D].北京:清华大学化工学院,2006.
