中缝大核对大鼠心脏伤害性感受的下行抑制性调控作用及其调控通路
2014-03-23牛利刚孔令恒朱娟霞杜剑青
孙 娜,牛利刚,孔令恒,朱娟霞,徐 燕,杜剑青
(1.西安医学院基础医学研究所生理学教研室,陕西 西安 710021;2.西安交通大学医学院生理学与病理生理学系,陕西 西安 710061)
脑干对脊髓背角伤害性信息的传入具有下行抑制性调控作用,电刺激中缝大核(nucleus raphe magnus,NRM)或者于NRM内注射谷氨酸或5-羟色胺(5-hydroxytryptamine,5-HT)等受体激动剂,可以对由伤害性躯体或者内脏刺激引起的脊髓伤害感受性反射或者脊髓背角神经元进行抑制性调节,而NRM的这种下行抑制性调节作用在解剖学上被认为是由脊髓背外侧束(dorsolateral funiculus,DLF)下行介导的[1-2]。另外有研究[3]显示:5-HT能神经元主要集中在脑干的NRM,其下行纤维可达脊髓胶质区/侧角和前脚,尤其是从NRM至脊髓后侧角的5-HT神经通路,因此脊髓内5-HT递质的释放被认为是脑干下行抑制系统参与镇痛作用的主要因素。然而,这些研究都是以躯体痛或者直肠和膀胱腹部内脏痛为研究靶点,而关于心脏痛的脑干下行性调节却少有研究。为了进一步探讨NRM对心脏伤害性感受的下行性调控作用以及参与其中的脊髓通路和5-HT受体系统的作用,本实验采用Jou等[4]人建立的大鼠心脏-躯体运动反射(cardiosomatic motor reflex,CMR)模型,以心包内注射致痛剂辣椒素(capsaicin,CAP)诱发背斜方肌(spinotrapezius,SPT)肌电(electromyogram,EMG)为指标,分析EMG的变化,探讨NRM对心脏伤害性感受的调节作用及其调控通路,为心绞痛的临床神经治疗研究提供有效的参考。
1 材料与方法
1.1 实验动物、主要试剂和仪器 实验选用成年、雄性、健康的Sprgue Dawley(SD)大鼠,体质量250~350g,由西安交通大学医学院实验动物中心提供,动物合格证号:0008366。大鼠在标准清洁级环境中饲养,室温20℃~25℃,12h昼夜循环光照,自由摄食饮水。在保证实验统计的基础上尽量减少实验动物使用的数目。戊巴比妥钠(美国Sigma公司)溶于生理盐水,配制成2×10-2g·mL-1溶液用于动物初始麻醉,1×10-2g·mL-1溶液用于动物麻醉维持;CAP(美国Sigma公司)溶于吐温80和无水乙醇混合溶液(按1∶1的配比)中,配制成1×10-3g·mL-1的母液,待实验当天用生理盐水稀释到浓度为1mg·L-1;麦角新碱(美国Sigma公司,5-HT受体拮抗剂)溶于二甲基亚砜溶液中,待麦角新碱完全溶解后,再将溶有麦角新碱的二甲基亚砜溶液与生理盐水按照3∶7的体积比混合,配制成浓度分别为3×10-3g·mL-1和5×10-3g·mL-1溶液。PowerLab信号采集与分析系统(澳大利亚AD Instruments公司),蠕动泵(BT100-2J,保定兰格恒流泵有限责任公司),小动物呼吸机(DW3000-B,淮北正华生物仪器设备有限公司),温度控制仪(原西安医科大学教学仪器厂),动物脑立体定位仪(SN-2N,日本Narishige公司),双线记忆示波器(VC-10)、双通道放大器(AVM-11)、刺激器(SEN-3301)和隔离器(SS-202J)(日本Nihon Kohden公司)。
1.2 实验方法 所有大鼠均以2×10-2g·mL-1戊巴比妥钠(45~55mg·kg-1)腹腔麻醉,行常规气管插管和颈外静脉、颈总动脉插管术后,制备CMR大鼠模型:于大鼠左侧上胸部第1到第3肋软骨处行开胸术,暴露胸腺和心脏,用玻璃探针在心包膜上开一小孔,将一内径0.051cm、外径0.094cm,长度14~16cm、远端有数个小洞的硅胶管顺胸腺的中线由之前在心包上所开的孔插入心包,导管顺左心室表面插入约2cm并缝合在胸腺和各层胸壁组织之间予以固定。心包内可反复注入和抽出液体。每一次从导管内抽出的液体均作为废弃液被处理,以免污染下一次实验。实验开始时,于T4~T6水平暴露大鼠左侧背斜方肌(spinotrapezius,SPT),插入同芯电极记录大鼠EMG反应,EMG信号经AVM-11双通道放大器(Nihon Kohden)放大后,由PowerLab软件采集和分析,滤波为1000~3000Hz。实验中维持大鼠于浅麻醉状态(1×10-2g·mL-1戊巴比妥钠,10~15mg·kg-1·h-1),体温保持(37.0±0.5)℃。
1.3 实验分组及处理方法 大鼠随机分为NRM电刺激组(n=8)、NRM电刺激联合DLF横断组(n=8)和NRM电刺激联合5-HT受体拮抗剂鞘内微注射组(n=18)。①NRM电刺激组:为实现电刺激大鼠NRM区的目的,根据Paxions &Watson图谱,将一根外径0.45mm的钢制导管植入大鼠脑干NRM区上方2mm处(前囟后9.4~11.8mm,脑表面下7.0~7.4mm,中线旁开0~0.5mm)。同芯刺激电极经此导管进入NRM区,使其尖端位置长于导管尖端2mm。每只大鼠在行NRM电刺激前,先行单纯CAP(0.2mL,1mg·L-1)心包内注射,其诱发的EMG活动作为基础对照;间隔50min,给予大鼠NRM电刺激(75μA)及心包内CAP注射,观察NRM电刺激对心包内注射CAP所诱发EMG反应的影响;50min后,再次心包内注射CAP,观察EMG恢复情况,作为后对照。为保证实验数据的准确,每次CAP刺激后,用温生理盐水冲洗心包腔5~6次,每次0.2mL,去除心包内残留的CAP,每次心包CAP刺激时间间隔50min,以避免药物耐受性现象的出现。②NRM电刺激联合DLF横断组:为实现观察脊髓下行调控路径的目的,对大鼠实施C1~C3节段的开锥板术并将硬脊膜完全剥离,暴露脊髓组织,实验需要时用精细眼科剪解剖学横断DLF。实验过程:CAP心包内注射,记录EMG活动作为基础对照;50min后行NRM区电刺激(75μA)及心包内CAP注射,记录EMG以观察NRM的下行性调控作用;继而用精细眼科剪实现DLF解剖学阻断,50min后再次行NRM区电刺激(75μA)及心包内CAP注射,记录EMG活动以判断DLF横断对NRM下行性调控作用的影响。DLF被横断后,血压下降,但50min内血压便得以恢复至基线水平。③NRM电刺激联合5-HT受体拮抗剂鞘内微注射组:为观察5-HT受体拮抗剂麦角新碱在NRM下行性抑制性调控中的作用,对大鼠实施脊髓鞘内置管术,即将一根规格为PE10的导管通过枕骨大孔植入至脊髓T3~T5节段,插入深度为3.5~4.0cm,为后期脊髓内药物注射做准备。实验过程:先行CAP心脏刺激记录EMG活动作为基础对照;继而NRM电刺激(75μA)及心包内注射CAP,记录EMG以观察NRM的下行性调控作用;间隔50min,鞘内注射溶媒(10μL)或麦角新碱(30或50μg,10μL),15min后,行NRM区电刺激(75μA)及心包内CAP注射,记录EMG活动以观察麦角新碱鞘内注射对NRM电刺激的影响;50min后,行NRM区电刺激(75μA)并心包内注射CAP,记录EMG以判断药物作用的持续时间。实验结束后,将实验中所记录的EMG用PowerLab软件进行频率直方图处理。当放电频率高于3imp·s-1时,作为放电的开始;当放电频率低于3imp·s-1时,则作为放电的终止,从而得到每次CAP心包内注射所诱发的肌电反应总个数(total number of motor unit discharges,TMUD)。每只大鼠第1次心包内注射CAP所诱发的肌电反应的TMUD被标化为100%,作为基础对照(control),其后续肌电反应均以第1次心包内注射CAP所诱发的肌电反应的TMUD为分母进行标化,以消除大鼠个体间的差异。电刺激后肌肉放电单位数高于基础对照110%或者低于对照90%,视为有意义,可计入统计范畴[5]。
1.4 统计学分析 采用SPSS 10.0统计学软件进行统计分析。各组大鼠CAP诱发的背斜方肌EMG的变化率以表示,组内各处理因素之间的比较采用单因素方差分析,两两比较采用SNK-q检验。
2 结 果
2.1 NRM电刺激下大鼠CMR的变化 当给予NRM 75μA的高强度电刺激时,大鼠EMG反应为基础对照的(48.15±6.10)%,明显低于基础对照(P<0.05);间隔50min后,后对照恢复良好,为基础对照的(96.16±1.63)%,与基础对照比较差异无统计学意义(P>0.05)。NRM对CAP诱发的EMG反应抑制性调节效应的原始肌电实例图见图1A,NRM电刺激位点组织再建图见图1B。
2.2 NRM电刺激作用下大鼠CMR下行抑制性调节脊髓通路的变化 于C1-C2脊髓节段行双侧DLF横断术,解剖学阻断脊髓DLF下行通路。DLF阻断前,75μA电刺激NRM的抑制效应为基础对照的(52.08±6.60)%(P<0.05);DLF阻断后,NRM电刺激的抑制效应消失,为基础对照的(91.82±2.42)%(P>0.05);DLF阻断前NRM电刺激所产生的肌电效应与DLF阻断后比较差异有统计学意义(P<0.05)。DLF横断面积实例图见图2。
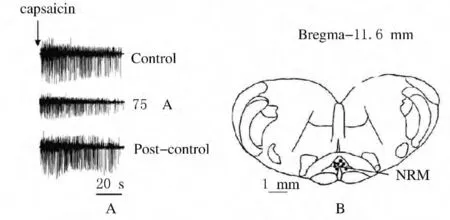
图1 电刺激NRM对CAP诱发EMG的抑制性调节效应原始肌电实例图(A)及NRM电刺激位点组织再建图(B)Fig.1 Raw traces of NRM stimulation-induced inhibitory modulation of EMG responses to CAP from one rat(A)and locations of electrical stimulation sites in NRM(B)

图2 脊髓C2节段DLF横断面积实例图Fig.2 DLF transection area at C2level of spinal cord
2.3 麦角新碱对NRM电刺激下行抑制性调节的翻转效应 NRM电刺激联合鞘内微量注射5-HT受体拮抗剂麦角新碱(30和50μg)后所产生的EMG反应与NRM电刺激比较差异有统计学意义(P<0.05),但仍未恢复至基础对照水平(P<0.05);NRM电刺激联合鞘内注射麦角新碱溶媒所产生的EMG反应与NRM电刺激比较差异无统计学意义(P>0.05)。
3 讨 论
本实验结果显示:电刺激NRM可以对CMR产生抑制调节作用;DLF横断实验表明NRM的下行抑制性调节是经脊髓通路DLF实现的;鞘内注射5-HT受体拮抗剂麦角新碱部分翻转了NRM的下行性抑制效应,说明5-HT参与了NRM对心脏伤害性感受的下行抑制性调节。
表1 麦角新碱鞘内注射对NRM下行抑制性调控作用的影响Tab.1 Influence of methysergide intrathecal administration in descending inhibitory modulation of NRM(n=6,,η/%)

表1 麦角新碱鞘内注射对NRM下行抑制性调控作用的影响Tab.1 Influence of methysergide intrathecal administration in descending inhibitory modulation of NRM(n=6,,η/%)
*P<0.05compared with control;△P<0.05compared with NRM stimulation.
Group ide+NRM stimulation NRM stimualtion Methysergide 30μg 100.0046.94±4.12*71.50±2.66*△47.05±5.01 EMG Program:Control NRM stimulation Methyserg*Methysergide 50μg 100.0044.77±4.44*70.76±4.67*△51.00±3.94*Vehicle 100.0043.10±6.91*42.15±5.51*42.00±4.33*
目前,大多数学者认为脑干内源性下行抑制系统主要由中脑导水管周围灰质(periaqueductal gray,PAG)、延髓头端腹内侧核群(rostral ventromedial medulla,RVM)和一部分脑桥背外侧网状结构组成,经脊髓DLF下行对延髓和脊髓背角痛觉感受性信息的传入产生抑制性调制[6]。而NRM为RVM核群内最重要的一个核团,是内源性镇痛系统的一个重要的中继站。在NRM内存在3类神经元:“停止”神经元(off-cell)、“启动”神经元(on-cell)和“中性”神经元(neutral cell)。许多研究[7-10]发现:当给予NRM高强度的电刺激(50~200μA)时,可以通过激活off-cell,抑制oncell,从而对躯体或内脏伤害性刺激起到抑制性调节作用,如甩尾反射、热板反射和直肠/膀胱-躯体运动反射等,然而这些有关的研究均局限于躯体痛和腹部脏器痛,有关心脏伤害性感受的研究很少。本实验采用了一种新的动物模型,通过CMR证明了NRM对心脏伤害性感受同样具有抑制性调节作用。
另外许多资料证实脊髓DLF参与痛觉下行抑制调节。Chandler等[11]研究报道脊髓电刺激(spinal cord stimulation,SCS)可以抑制由心脏内注射缓激肽(bradykinin,BK)引起的胸段脊髓丘脑束神经元的兴奋活动。Zhou等[1]研究报道:NRM对内脏伤害性感受的抑制性调节效应是通过脊髓DLF介导的;在大鼠直肠放置膨胀气囊产生内脏伤害性刺激,观察脊髓背角神经元的电活动,当给予NRM高强度电刺激(50~200μA)时,可减少脊髓背角神经元的神经冲动,而在横断DLF后,这种抑制效应随即消失。本实验结果也提示:双侧DLF横断后,NRM对CMR的下行性抑制性调节被阻断,与以往研究结果一致。综合以往的研究资料以及本实验结果,本文作者认为:高强度的电刺激可能主要激活了NRM内off-cell,而off-cell的神经冲动主要通过脊髓DLF下行发挥调节作用。
解剖学研究发现NRM约50%的神经元为5-HT能神经元,Potrebic等[12]采用抗体微电极技术发现NRM内的off-cell/on-cell/neutral-cell均呈5-HT免疫阳性反应,其中5-HT免疫阳性反应在neutral-cell分布最多,off-cell次之,on-cell最少。而这些5-HT能神经元80%以上为缝-脊投射神经元,即其投射纤维主要经脊髓DLF下行,分布于同侧脊髓后角,可通过轴-轴突触影响脊髓后角的伤害性感受神经细胞的活动,从而在痛觉调制中发挥镇痛作用。然而,5-HT对脊髓伤害性反应的调控是复杂的,可能产生抑制作用,也有可能产生易化作用,这可能归因于激活的受体亚型不同、药物注射的剂量不同或者伤害性刺激类型不同。有研究[13-16]显示:脊髓的5-HT1、5-HT2和5-HT3受体与镇痛效应有关。麦角新碱作为非选择5-HT1和5-HT2受体的拮抗剂被广泛使用。本研究通过鞘内注射麦角新碱部分翻转了电刺激NRM对CMR的抑制作用,提示5-HT及其受体参与NRM对CMR的下行性抑制作用,即高强度电刺激可能主要激活了NRM内的off-cell,off-cell的神经冲动通过脊髓DLF通路下行,促使大量的5-HT释放至脊髓背角,导致脊髓背角感觉神经元超极化,从而明显提高了疼痛的阈值,而一旦麦角新碱阻断了脊髓背角感觉神经元上的5-HT受体,导致5-HT的抑制作用减弱或消失。即使鞘内注射高浓度的麦角新碱(50μg)也没有完全阻断NRM对CMR的抑制效应,这说明还有其他脊髓受体参与了源自NRM的抑制性调节过程。研究[14]显示:虽然NRM内5-HT能神经元为主导,但是还有不到50%的神经元为去甲肾上腺素(norepinephrine,NE)、多种神经肽和γ-氨基丁酸(γ-aminobutyric acid,GABA)能神经元,其中5-HT与NE、5-HT与阿片肽、5-HT与GABA以及GABA与阿片肽等也多有共存现象,而这些神经元的活动之间存在着复杂的构筑关系,至今还不十分清楚。
综上所述,本实验中给予NRM电刺激可以减弱大鼠SPT的紧张性反应,而DLF和5-HT下行纤维系统参与NRM对CMR下行性抑制性调节。临床上许多患者在经历过心绞痛后,会出现上胸部肌肉紧张性的增加,这与本实验中的大鼠模型相似。本研究结果将为心绞痛的临床神经治疗研究提供有效的基础研究资料。
[1]Zhuo M,Gebhart GF.Facilitation and attenuation of a visceral nociceptive reflex from the rostroventral medulla in the rat[J].Gastroenterology,2002,122(4):1007-1019.
[2]Sengupta JN,Mickle A,Kannampalli P,et al.Visceral analgesic effect of 5-HT4receptor agonist in rats involves the rostroventral medulla(RVM)[J].Neuropharmacology,2014(79):345-358.
[3]Steeds CE.The anatomy and physiology of pain[J].Basic Sci,2013,31(2):49-53.
[4]Jou CJ,Farber JP,Qin C,et al.Intrapericardial algogenic chemicals evoke cardiac-somatic motor reflexes in rats[J].Auton Neurosci,2001,94(1/2):52-61.
[5]韩 曼,孙 娜,刘晓华,等.脊髓NMDA受体对心包内注射缓激肽诱发大鼠心脏-躯体运动反射的调节作用[J].吉林大学学报:医学版,2012,38(5):832-835.
[6]Millan MJ.Descending control of pain[J].Neurobiology,2002,66(6):355-474.
[7]Urban MO,Smith DJ.Role of neurotensin in the nucleus raphe magnus in opioid-induced antinociception from the periaqueductal gray[J].J Pharmacol Exp Ther,1993,265(2):580-586.
[8]Zhuo M,Gebhart GF.Biphasic modulation of spinal nociceptive transmission from the medullary raphe nuclei in the rat[J].J Neurophysiol,1997,78(2):746-758.
[9]Randich A,Mebane H,DeBerry JJ,et al.Rostral ventral medulla modulation of the visceromotor reflex evoked by urinary bladder distension in female rats[J].J Pain,2008,9(10):920-926.
[10]Zhuo M,Sengupta JN,Gebhart GF.Biphasic modulation of spinal visceral nociceptive transmission from the rostroventral medial medulla in the rat[J].J Neurophysiol,2002,87(5):2225-2236.
[11]Chandler MJ,Brennan TJ,Garrison DW,et al.A mechanism of cardiac pain suppression by spinal cord stimulation:implications for patients with angina pectoris[J].Eur Heart J,1993,14(1):96-105.
[12]Potrebic SB,Mason P,Fields HL.The density and distribution of serotonergic appositions onto identified neurons in the rat rostral ventromedial medulla[J].J Neurosci,1995,15(5Pt 1):3273-3283.
[13]Xie DJ,Uta D,Feng PY,et al.Identification of 5-HT receptor subtypes enhancing inhibitory transmission in the rat spinal dorsal horn in vitro[J].Molecular Pain,2012,8(58):1-12.
[14]Jeong CY,Choi JI,Yoon MH.Roles of serotonin receptor subtypes for the antinociception of 5-HT in the spinal cord of rats[J].Eur J Pharmacol,2004,502(3):205-211.
[15]Mallet C,Daulhac L,Bonnefont J,et al.Endocannabinoid and serotonergic systems are needed for acetaminophen-induced analgesia[J].Pain,2008,139(1):190-200.
[16]Han M,Liu XH,Sun N,et al.Lateral reticular nucleus modulates the cardiosomatic reflex evoked by intrapericardial capsaicin in the rat[J].Eur J Neurosci,2013,37(9):1511-1518.
