二苯乙烯苷对肿瘤坏死因子α诱导人脐静脉内皮细胞NF-κB核转位的影响
2014-03-23姚文娟顾承静孟国梁王慧敏
姚文娟,顾承静,孟国梁,金 翔,王慧敏,张 伟
(南通大学医学院药理系,江苏南通 226001)
二苯乙烯苷对肿瘤坏死因子α诱导人脐静脉内皮细胞NF-κB核转位的影响
姚文娟,顾承静,孟国梁,金 翔,王慧敏,张 伟
(南通大学医学院药理系,江苏南通 226001)
目的探讨二苯乙烯苷(TSG)对肿瘤坏死因子α(TNF-α)诱导的内皮细胞损伤的保护性作用及其对内皮细胞NF-κB核转位的影响。方法取新生儿脐带分离原代人脐静脉内皮细胞(HUVEC),用因子Ⅷ鉴定内皮细胞。按照分组,HUVEC分别与TNF-α60μg·L-1,TNF-α+TSG 1,10,25,50和100μmol·L-1进行孵育,TSG预孵24 h,再加TNF-α处理3 h。显微镜观察TSG对TNF-α诱导HUVEC的保护性作用,MTT法检测细胞存活率,免疫荧光法检测细胞NF-κB的核转位现象。结果因子Ⅷ相关抗原检测显示,分离的细胞为内皮细胞。显微镜观察显示,TSG对TNF-α诱导的HUVEC损伤具有明显的抑制作用,TSG 100μmol·L-1使内皮细胞形态几乎接近正常组水平。MTT结果显示,TSG可显著提高TNF-α诱导后的细胞存活率,并呈浓度依赖性(r=0.9657,P<0.01)。免疫荧光检测表明,TNF-α诱导NF-κB发生核内转移,TSG作用后可抑制这种核转位,TSG 100μm ol·L-1处理组的核转位抑制作用最明显。结论TSG可能通过抑制NF-κB的激活发挥保护血管内皮的作用。
二苯乙烯苷;动脉粥样硬化;NF-κB;肿瘤坏死因子α;人脐静脉内皮细胞;核转位
DO l:10.3867/j.issn.1000-3002.2014.01.004
动脉粥样硬化(atherosclerosis,AS)是由多种病因造成的始发于动脉壁内膜的一系列复杂分子和细胞改变的总结果,血管内皮功能损伤、单核/巨噬细胞浸润、泡沫细胞形成和内膜层平滑肌细胞增殖等都为其主要的病理特征[1]。血管内皮对维持心血管稳态非常重要,血管内皮损伤是形成AS的初始阶段。肿瘤坏死因子α(tumor necrosis factorα,TNF-α)是促使内皮细胞活化的一种重要的刺激因素,而血管内皮细胞是其作用的主要靶细胞之一,由TNF-α引起的血管内皮细胞损伤在许多炎症性疾病的发病中具有重要意义[2]。
核转录因子是1986年由Sen和Baltimore在淋巴细胞中发现的一种能够与免疫球蛋白K轻链基因的增强子序列特异性结合的核因子,调控免疫球蛋白K轻链的转录,是普遍存在于真核生物细胞浆中的快反应转录因子[3]。新近的研究发现,NF-κB也存在于血管内皮细胞、血管平滑肌细胞中,并与AS的发生与发展有关[4-5]。以NF-κB转录因子家族为调控中心的内皮细胞活化及炎症基因诱导途径有可能成为有关危险因子促AS形成的共同途径[6]。
二苯乙烯苷(2,3,5,4′-tetrahyd roxystilbene-2-O-β-D-glucoside,TSG)是何首乌的主要活性成分。研究发现,TSG通过调节多种靶分子如一氧化氮合酶、细胞间黏附分子1、血管细胞黏附分子1、血管内皮生长因子、基质金属蛋白酶2和基质金属蛋白酶9等显著减少AS导致的内膜增厚及脂质沉积[7-9]。研究还发现,TSG通过调节丝裂原活化细胞外调节激酶-细胞外信号调节激酶1/2和一氧化氮/cGMP/蛋白激酶G信号通路关键蛋白及NF-κB活性,抑制血管平滑肌细胞(vascular smooth muscle cells,VSMC)增殖,起到抑制AS的作用[10-12]。本研究通过建立TNF-α诱导人脐静脉内皮细胞损伤模型,观察TSG对内皮细胞NF-κB信号通路激活的影响。
1 材料与方法
1.1 药品和试剂
TSG购于中国药品生物制品检定所。重组TNF-α(rTNF-α)购自加拿大Biosource公司,LOT:M092404B5。M199培养基为美国Gibco产品,胎牛血清为GibcoBRL产品。NF-κB抗体和红色荧光染料标记的羊抗兔IgG抗体均购自美国CST公司。因子Ⅷ相关抗原免疫组织化学检测试剂盒购自北京中杉金桥生物技术有限公司。噻唑蓝(MTT)和二甲亚砜(DMSO)为美国Sigma公司产品。
1.2 人脐静脉内皮细胞的培养和鉴定
取健康产妇的新生儿脐带20~30 cm,剪去破损部分,用无菌磷酸盐缓冲液(PBS)反复冲洗至静脉腔内无血,注入预温的1.25 mg·L-1的胰蛋白酶EDTA消化液(胰蛋白酶2.5 mg·L-1与EDTA 0.2 mg·L-1的混合液)8~10 m L,37℃下消化10~15 m in。收集消化液,室温离心10 m in(3 000×g)后弃上清,加入完全M199培养液,重新混悬细胞后,接种到用明胶2 m g·L-1包被过的培养瓶中,送入37℃培养箱中进行培养,将第2~3代细胞用于实验。内皮细胞的鉴定采用DAB免疫组织化学法,在6孔培养板内放置无菌的0.5 cm×0.6 cm盖玻片,每孔中种植密度为1×105的细胞悬液2 m L。待细胞生长至近融合状态时,取出玻片,PBS冲洗3次放入乙醇∶丙酮混合液(1∶1)中固定10 m in后,自然晾干。滴加因子Ⅷ相关抗原多抗工作液,37℃孵育60 m in。PBS冲洗浸泡10 m in后晾干,加入辣根酶标记的羊抗兔IgG,37℃孵育40 m in,PBS冲洗3次,DAB显色,显微镜下观察。
1.3 TNF-α诱导人脐静脉内皮细胞损伤模型建立及分组给药
待细胞生长至80%融合后,加入TSG 1,10,25,50和100μm ol·L-1预孵细胞24 h,再加入TNF-α60μg·L-1处理3 h。
1.4 MTT检测细胞存活
在细胞培养结束前4 h,每孔加300μL MTT(5 g·L-1)工作液,继续37℃培养4 h,终止培养,小心地吸净孔内培养液,加入100μL DMSO溶液,振荡混匀10 m in。选择570 nm波长,在多标记细胞计数酶标仪上检测各孔的吸光度(A570nm)值。
1.5 免疫荧光观察NF-κB核转位
培养液吸弃,用PBS漂洗2~3次,加入冰冻的乙醇80 m L·L-1室温固定10 m in,液体盖过瓶底即可。然后再用PBS漂洗2次,加入0.5 m L·L-1Triton X-100室温10 m in,PBS洗净后加入BSA 0.5 g·L-1室温封闭1 h,然后加入NF-κB一抗(1∶50)于室温1 h,PBS漂洗2次,再加入带有红色荧光染料的二抗(1∶100)室温孵育30 m in,每孔300μL。用PBS漂洗干净各孔,以尽量去掉红色的本底背景,加入DAPI使核着色,避光室温孵育5~10 m in。置于荧光倒置显微镜下观察,NF-κB呈红色荧光,细胞核被染成蓝色,核转位时红色荧光主要分布于细胞核内。
1.6 统计学分析
2 结果
2.1 鉴定分离培养的原代人脐静脉内皮细胞
分离的人脐静脉内皮细胞镜下观察为贴壁细胞,呈圆形或椭圆形,为典型的“铺路石”样生长(图1A),表明所分离培养的人脐静脉内皮细胞生长状态良好。因子Ⅷ相关抗原检测显示,胞浆内分布褐色颗粒,证实培养的细胞为内皮细胞(图1B)。
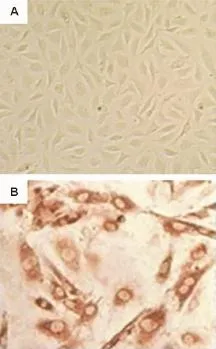
Fig.1 Cultivated human umbilical vein endothelial cells(HUVEC)observed by inverted microscope(×200).A:normal HUVEC;B:detection of factor Ⅷ expression.Brown granules were distributed in the cytoplasm of HUVEC.
2.2 TSG对TNF-α诱导的内皮细胞损伤形态的影响
显微镜观察结果如图2所示,TNF-α对细胞有明显的损伤作用,细胞形态变得不规则,非“铺路石”样生长,而且细胞数量减少(图2B)。TSG对TNF-α诱导的细胞损伤有明显的抑制作用(图2C~G),尤其是TSG 50和100μmo l·L-1对内皮细胞的保护作用显著,如图2F和图2G,细胞形态正常,生长状态恢复“铺路石”样生长,细胞数量增多。
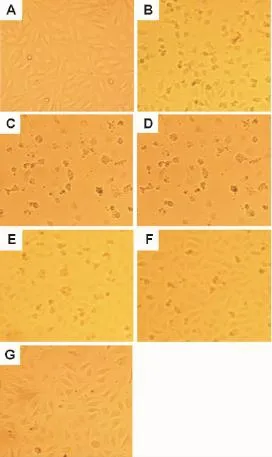
Fig.2 Effect of 2,3,5,4′-tetrahydroxystilbene-2-O-β-D-glucoside(TSG)on HUVEC morphology induced by TNF-αby microscope(×200).HUVEC were pretreated with TSG 1,10,25,50 and 100μmol·L-1for 24 h before treatment of TNF-α60μg·L-1for another 3 h.A:the norm al control group;B:TNF-α60μg·L-1;C:TNF-α60μg·L-1+TSG 1μmol·L-1;D:TNF-α60μg·L-1+TSG 10μm ol·L-1;E:TNF-α60μg·L-1+TSG 25μm ol·L-1;F:TNF-α60μg·L-1+TSG 50μmol·L-1;G:TNF-α60μg·L-1+TSG 100μmol·L-1.
2.3 TSG对TNF-α诱导的内皮细胞存活率的影响
MTT检测结果显示,TNF-α显著降低内皮细胞的存活率(P<0.01)(表1)。TSG作用后,细胞存活率逐渐上升,TSG 50μm o l·L-1组细胞存活率为(71.9±2.6)%(P<0.01),100μmo l·L-1组细胞存活率为(94.1±2.3)%(P<0.01)。
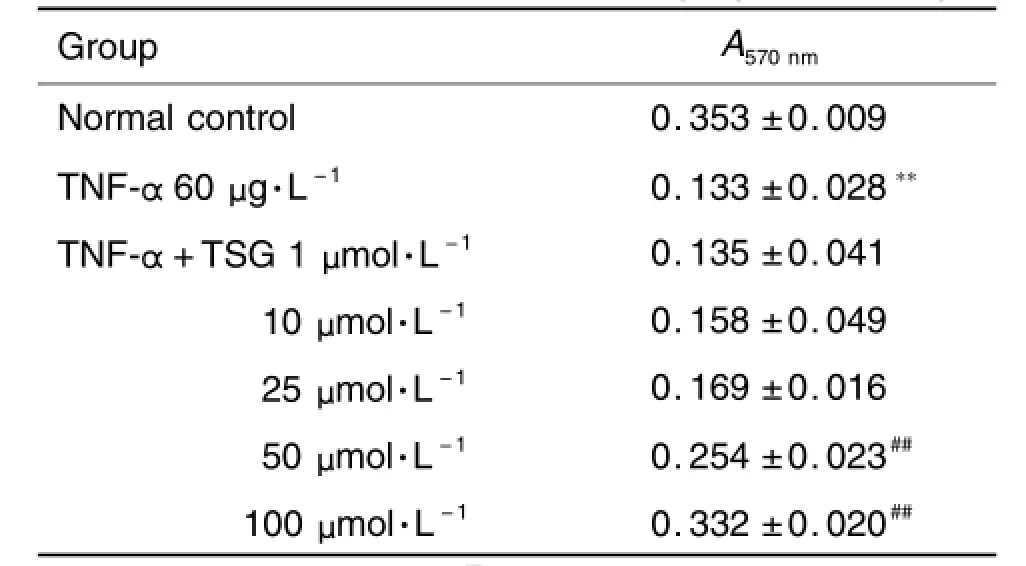
Tab.1 Effect of TSG on cell viability by MTT assay
2.4 TSG对TNF-α诱导的内皮细胞NF-κB核转位的影响
结果如图3所示,与正常组相比,TNF-α的作用使NF-κB主要在细胞核内出现(红色荧光主要分布于细胞核内),即发生核转位(图3B),而正常组的细胞浆和细胞核中均有NF-κB的分布(图3A)。加入TSG后,随着TSG浓度增加,NF-κB核转位现象得到抑制,NF-κB逐渐往细胞浆中扩散,即细胞浆中红色荧光越来越强(图3C~G),当TSG浓度达到100μm o l·L-1时,细胞浆中的NF-κB分布最多(图3G)。
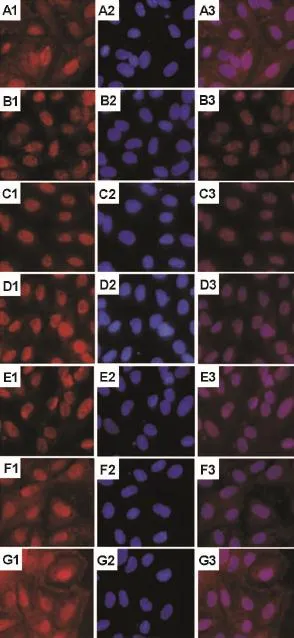
Fig.3 Effect of TSG on NF-κB nuclear trans location induced by TNF-αin HUVEC by immunofluorescence analysis(×200).See Fig.2 for the treatment.A:normal control group;B:TNF-α60μg·L-1;C:TNF-α60μg·L-1+TSG 1μmol·L-1;D:TNF-α60μg·L-1+TSG 10μmol·L-1;E:TNF-α 60μg·L-1+TSG 25μmol·L-1;F:TNF-α60μg·L-1+TSG 50μm ol·L-1;G:TNF-α60μg·L-1+TSG 100μm ol·L-1.1:immunofluorescence of NF-κB;2:DAPI coloring of nucleus;3:merge picture of 1 and 2.
3 讨论
AS发生过程中,血管内皮损伤是关键因素之一,各种因素引起的血管内皮损伤均可使血管壁通透性增加,引起白细胞和血小板黏附,并释放各种活性因子,导致内皮进一步损伤,最终形成AS斑块。因此,保护血管内皮免受各种刺激因子损伤是抗AS的重要一环[1-2]。研究表明,TSG具有较强的抗AS药理活性[7-12],TSG能明显抑制AS大鼠主动脉斑块中的炎症因子、基质金属蛋白酶和细胞黏附分子等的表达,并能抑制血管平滑肌细胞的增殖和迁移。但是,关于TSG对血管内皮细胞保护性作用的研究还未见报道,本研究通过体外构建内皮细胞损伤模型,发现TSG可以显著减轻TNF-α对内皮细胞的损伤性作用,且呈浓度依赖性。有研究发现,NF-κB与内皮细胞激活密切相关,当内皮细胞被激活后,不仅出现形态学改变,而且表达一些表面蛋白和一些可溶性介质,NF-κB激活所导致的一系列黏附分子表达也是AS发生之关键所在,因而NF-κB的激活被认为是血管内皮细胞受损的始动机制之一[4-6]。正常情况下,NF-κB处于未激活状态,主要存在于胞浆中,当受到细胞因子如TNF-α刺激时,NF-κB就会从胞浆中转移到胞核中。为进一步观察TSG对TNF-α刺激后NF-κB核转位的影响,本研究通过免疫荧光观察了NF-κB的表达。结果表明,TSG可以有效抑制TNF-α诱导的内皮细胞NF-κB核转位现象,并呈浓度依赖性。因此,TSG很可能通过抑制NF-κB的激活来抑制黏附分子等蛋白的表达,从而起到保护血管内皮细胞的作用,也从另一方面阐明了TSG抗AS发生与发展的机制之一。
[1] Gotto AM,Farmer JA.Atherosclerosis:pathogenesis,morphology,and risk factors[M]∥Textbook of Cardiovascular Medicine.3 rd ed,Baltimore;Lippincott Williams and Wilkins,2007:1593-1613.
[2] Barath P,Fishbein MC,Cao J,Berenson J,Helfant RH,Forrester JS.Detection and localization of tumor necrosis factor in human atheroma[J].Am J Cardiol,1990,65(5):297-302.
[3] Baeuerle PA,Baltimore D.NF-kappa B:ten years after[J].Cell,1996,87(1):13-20.
[4] Read MA,Whitley MZ,Williams AJ,Collins T. NF-kappa B and Ikappa B alpha:an inducible regulatory system in endothelial activation[J].J Exp Med,1994,179(2):503-512.
[5] Hajra L,Evans AI,Chen M,Hyduk SJ,Collins T,Cybulsky MI.The NF-kappa B signal transduction pathway in aortic endothelial cells is primed for activation in regions predisposed to atherosclerotic lesion formation[J].Proc Natl Acad Sci USA,2000,97(16):9052-9057.
[6] Krishnaswamy G,Kelley J,Yerra L,Smith JK,Chi DS.Human endothelium as a source of multifunctional cytokines:molecular regulation and possible role in human disease[J].J Interferon Cytokine Res,1999,19(2):91-104.
[7] Zhang W,Xu XL,Wang YQ,Wang CH,Zhu WZ.Effects of 2,3,4′,5-tetrahydroxystilbene 2-O-beta-D-glucoside on vascular endothelial dysfunction in atherogenic-diet rats[J].Planta Med,2009,75(11):1209-1214.
[8] Zhang W,Wang CH,Li F,Zhu WZ.2,3,4′,5-Tetrahydroxystilbene-2-O-beta-D-glucoside suppresses matrix metalloproteinase expression and inflammation in atherosclerotic rats[J].Clin Exp Pharmacol Physiol,2008,35(3):310-316.
[9] Wang YQ,Shen Y,Wang CH,Li F,Zhang W.Effects of 2,3,4′,5-tetrahydroxystilbene-2-O-β-D-glucoside on expressions of intercellular adhesion molecule-1,vascular cell adhesion molecule-1 and vascular endothelial growth factor in aorta of atherosclerotic rats[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2008,22(5):329-335.
[10] Xu XL,Huang YJ,Wang YQ,Chen XF,Zhang W.2,3,4′,5-Tetrahydroxystilbene-2-O-β-D-glucoside inhibits platelet-derived growth factor-induced proliferation of vascular smooth muscle cells by regulating the cell cycle[J].Clin Exp Pharmacol Physiol,2011,38(5):307-313.
[11] Xu XL,Huang YJ,Chen XF,Lin DY,Zhang W.2,3,4′,5-Tetrahydroxystilbene-2-O-β-D-glucoside inhibits proliferation of vascular smooth muscle cells:involvement of NO/cGMP/PKG pathway[J].Phytother Res,2012,26(7):1068-1074.
[12] Xu XL,Zhang W,Huang YJ,Wang YQ.Effect of 2,3,4′,5-te trahydroxystilbene-2-O-β-D glucoside on proliferation and antioxidation of vascular smooth muscle cells[J].Chin Pharmacol Bull(中国药理学通报),2010,26(7):934-939.
Effect of 2,3,5,4′-tetrahydroxystilbene-2-O-β-D-glucoside on NF-κB nuclear trans location in tumor necrosis factor-α-induced human umbilical vein endothelial cells
YAO Wen-juan,GU Cheng-jing,MENG Guo-liang,JING Xiang,WANG Hui-ming,ZHANG Wei
(Department of Pharmacology,Medical College,Nantong University,Nantong 226001,China)
OBJECTlVETo investigate the protective effect of 2,3,5,4′-tetrahydroxystilbene-2-O-β-D-glucoside(TSG)on human umbilical vein endothelial cells(HUVECs)and on NF-κB nuclear translocation.METHODSHUVECs were isolated from the newborn umbilical cord and identified by factor Ⅷ.They were incubated with TNF-α60μg·L-1,and TNF-α+TSG 1,10,25,50 and 100μmol·L-1,respectively.They were treated with TSG for24 h before treatment with TNF-α for anthor 3 h.Protective effects of TSG on HUVECs induced by TNF-α were observed under a m icroscope.Cell viability of HUVECs was analyzed by MTT assay.NF-κB nuclear translocation was tested by immunofluorescence.RESULTSFactorⅧanalysis revealed that the isolated cells were HUVECs.Microscopic observation indicated that TSG significantly inhibited TNF-α-induced dysfunction in HUVECs.The cell morphology of the group p retreated with TSG 100μm ol·L-1was similar to that of the normal group.MTT analysis indicated that TSG notably improved cell viability after treatement with TNF-αin a concentration-dependent manner(r=0.9657,P<0.01).The immunofluorescence results showed that TSG inhibited NF-κB nuclear translocation induced by TNF-α.TSG 100μmo l·L-1had the most obvious inhibitory effect on NF-κB nuclear translocation induced by TNF-α.CONCLUSlONTSG can protect vascular endothelial cells by inhibiting NF-κB activation.
2,3,5,4′-tetrahydroxystilbene-2-O-β-D-glucoside;atherosclerosis;NF-κB;tumor necrosis factor-α;human umbilical vein endothelial cells;nuclear translocation
ZHANG Wei,E-mail:zhangwei0430@aliyun.com
R972
A
1000-3002(2014)01-0024-05
Foundation item:The project supported by National Natural Science Foundation of China(81202879);Ta lent Recruitment Foundation of Nantong University(122091);Natural Science Foundation of Nantong City(BK2012087);and Nantong Science and Technology Development Project(BK2011044)
2013-09-30 接受日期:2013-11-23)
(本文编辑:乔 虹)
国家自然科学基金资助项目(81202879);南通大学人才引进启动费项目(122091);南通市应用研究计划(BK2012087);南通市科技计划项目(BK2011044)
姚文娟(1983-),女,江苏南通人,博士,讲师,主要从事心血管药物药理研究,Te l:(0513)85051728,E-mail:juanwenyy@aliyun.com。
张 伟,E-mail:zhangwei0430@aliyun.com
