外源性硫化氢对胰岛素抵抗脂肪细胞葡萄糖转运体4表达的影响
2014-03-23杨非柯刘竟芳陈伟何新平卢桂静
杨非柯 刘竟芳 陈伟 何新平 卢桂静
.基础研究.
外源性硫化氢对胰岛素抵抗脂肪细胞葡萄糖转运体4表达的影响
杨非柯 刘竟芳 陈伟 何新平 卢桂静
目的 观察外源性硫化氢(H2S)对3T3-L1脂肪细胞胰岛素抵抗(IR)的影响,并探讨其机制。方法 用高糖高胰岛素培养3T3-L1脂肪细胞,建立IR细胞模型,外源性H2S供体NaHS (10-5、10-4和10-3mol/L)处理IR 3T3-L1细胞12、24和48 h。MTT法检测细胞活力,葡萄糖氧化酶法检测培养液中的葡萄糖消耗量,2-脱氧-[3H]-D-葡萄糖摄入法检测葡萄糖的摄取。实时定量PCR和Western blot检测葡萄糖转运体4(Glut4)的表达。结果 与对照组比较,IR模型组细胞葡萄糖消耗和摄取量以及Glut4 mRNA和蛋白的表达显著降低(均为P<0.05)。与对照组比较,所有浓度的NaHS均未影响细胞活力。与IR模型组比较,NaHS(10-4和10-3mol/L)处理24和48 h显著增加细胞葡萄糖消耗和摄取量以及Glut4 mRNA和蛋白的表达(均P<0.05)。结论 外源性H2S改善了高糖高胰岛素诱导的脂肪细胞的IR,其机制可能与H2S上调Glut4的表达有关。
硫化氢; 胰岛素抵抗; 高糖; 高胰岛素; 葡萄糖转运体4型
硫化氢(hydrogen sulfide,H2S)被称为第三种气体信号分子,广泛分布于心血管、内脏和神经系统等[1-2]。研究显示,H2S在胰岛素抵抗(insulin resistance,IR)发生和发展过程中发挥重要作用[3]。本研究应用硫氢化钠(sodium hydrosulfide,NaHS)作为H2S供体,观察外源性H2S对3T3-L1脂肪细胞IR的影响,并探讨其机制。
1 材料和方法
1.1 材料
3T3-L1前脂肪细胞购自中国医学科学院基础医学研究所细胞库。3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine,IBMX)、地塞米松、NaHS、重组人胰岛素和四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)购自Sigma公司。高糖和低糖DMEM培养基、胎牛血清、RNA酶抑制剂、逆转录酶(M-MuLV)试剂盒、Trizol、Hot Star Taq Master Mix试剂盒购自Invitrogen公司。羊抗小鼠葡萄糖转运体4(glucose transporter 4,Glut4)单克隆抗体和辣根过氧化物酶标记兔抗羊二抗购自Santa Cruz公司。增强化学发光法试剂盒购自Pierce公司。
1.2 方法
1.2.1 脂肪细胞的培养、诱导分化和分组 用10%胎牛血清的DMEM高糖培养基于37℃、5% CO2和饱和湿度条件下培养3T3-L1前脂肪细胞。状态良好的细胞接种于培养板,待细胞生长融合2 d后加入含胰岛素(1 mg/L)、地塞米松(1.0 μmol/L)、IBMX(0.5 mmol/L)和10%胎牛血清的DMEM高糖培养基培养48 h,换液后,再用含胰岛素(1 mg/L)和10%胎牛血清的DMEM高糖培养基继续培养48 h。换液后,以10%胎牛血清的DMEM高糖培养基继续培养,每2 d换液1次,诱导分化8~10 d后,90%~95%的3T3-L1细胞呈现脂肪细胞表型,用于后续实验。实验分为对照组、IR模型组、NaHS(10-5、10-4和10-3mol/L)处理IR 3T3-L1细胞12、24和48 h组。
1.2.2 IR脂肪细胞模型建立 含10%胎牛血清的DMEM低糖培养基培养诱导分化成熟的3T3-L1脂肪细胞48 h。更换培养液,用无血清的DMEM低糖培养基继续培养12 h。更换培养液,用含10-7mol/L胰岛素和10%胎牛血清的DMEM高糖培养基培养24 h,建立IR脂肪细胞模型。
1.2.3 细胞活力的检测 细胞用胰酶消化后,制成细胞悬液,将细胞密度调整为5×104个/ml,接种于96孔培养板,每孔均200 μl培养液。37℃、5%CO2和饱和湿度条件下培养24 h,更换培养液,无血清培养液继续培养24 h。各实验组处理结束后,每孔加入MTT溶液20 μl,培养箱中继续培养4 h,更换培养液,加入200 μl DMSO,充分振荡使晶体溶解。用酶标仪测定波长为490 nm的每孔吸光度值(A值)。
1.2.4 葡萄糖消耗量的检测 将96孔板中诱导分化成熟的3T3-L1脂肪细胞以含0.2%牛血清白蛋白(bovine serum albumin,BSA)和25 mmol/L葡萄糖的DMEM培养液培养12 h。各实验组处理结束后,更换培养液,用葡萄糖氧化酶法检测培养液中的葡萄糖含量,空白对照组(未接种细胞)糖含量的均值作为基础值,计算各实验组细胞的葡萄糖消耗量。
1.2.5 葡萄糖摄取的检测 各实验组处理结束后,在24孔板中每孔加入含或不含10-7mol/L胰岛素的KRP缓冲液,在37℃下继续培养30 min。然后加入l ml含0.5 μCi/ml 2-脱氧-[3H]-D-葡萄糖的KRP缓冲液,在37℃下继续孵育10 min。用预冷的含葡萄糖(10 mmol/L)的PBS快速清洗3次,终止反应,然后加入1 m l NaOH(0.1mol/L)孵育2 h使细胞充分裂解。取适量的细胞裂解液,在液闪计数仪上测定闪烁值。以10 μmol/L的细胞松弛素B作为对照,同样的方法计算出细胞对2-脱氧-[3H]-D-葡萄糖的非特异性摄取率,所有数据均减去此值,作为各实验组细胞的葡萄糖摄取率。
1.2.6 实时定量PCR检测Glut4 mRNA的表达各实验组处理结束后,收集细胞。用Trizol法提取细胞总RNA。以不同处理实验组的细胞总RNA为模板,Oligo(dT)15为引物进行逆转录反应,合成cDNA。将cDNA样品进行梯度稀释,取适量的cDNA样品分别进行实时定量PCR反应。反应总体系为30 μl:cDNA 2 μl,SYBR Premix Ex TaqTM8 μl,上下游引物(10 mol/L)各0.5 μl,dNTP Mix(2×) 8 μl,用无菌去离子水补足30 μl。PCR反应条件为:95℃10 s,94℃10 s,60℃60 s,共40个循环。每次扩增均以无菌去离子水替模板作为空白对照。Glut4引物序列为:上游:5'-GGCTGTGAGTGAGTGCTIT-3',下游:5'-GGTITCTGCTCCCTATCGT-3'。以β-actin作为内参,β-actin引物序列为:上游:5'-GCATCTTCATGCACCAGCT-3',下游:5'-GAGGCTGTAAGCAATGCTTG-3'。采用2-ΔΔCT法处理实时定量PCR数据,以对照组为100%对Glut4 mRNA的表达进行定量分析。
1.2.7 Western blot检测Glut4的表达 收集各实验组细胞,用冷的PBS清洗涤3次。加入RIPA蛋白裂解液1 m l,吹打数次,裂解细胞30 min后,4℃,15 000 g/min离心10 min,取上清,提取细胞的总蛋白。BAC法测定上清蛋白质浓度。取100 μl蛋白质样本经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离后,采用半干转法将蛋白质转移至硝酸纤维素膜上,丽春红染色观察转移效果并确定蛋白标准位置。用含10%脱脂奶粉的TBST溶液室温下封闭2 h。TBST缓冲液洗膜3次,加入羊抗小鼠Glut4 (1∶200)和β-actin(1∶400)一抗,4℃下过夜。洗膜3次后加入辣根过氧化物酶标记的兔抗羊二抗,4℃下孵育4 h。洗膜3次,加入ECL试剂盒,X线片曝光。显影和定影后,扫描仪扫描电泳条带,凝胶图像分析系统对电泳条带进行光密度积分值分析,以Glut4与内参β-actin的光密度积分值之比作为Glut4的相对蛋白表达水平。
1.3 统计学方法
2 结果
2.1 3T3-L1脂肪细胞IR模型的鉴定
与对照组比较,高糖高胰岛素组细胞的葡萄糖消耗量显著降低,葡萄糖转运明显抑制(均为P<0.05),表明IR脂肪细胞模型建立成功,见图1。
2.2 NaHS对IR 3T3-L1脂肪细胞活性的影响
如表1所示,NaHS(10-5、10-4和10-3mol/L)处理IR 3T3-L1脂肪细胞12、24和48 h均没有影响IR 3T3-L1脂肪细胞的活力(均为P>0.05)。
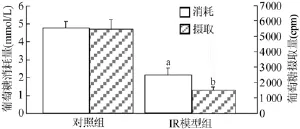
图1 高胰岛素对3T3-L1脂肪细胞葡萄糖消耗量和葡萄糖摄取的影响,与对照组比较,abP<0.05
2.3 NaHS对IR 3T3-L1脂肪细胞葡萄糖消耗影响
如表2所示,与IR脂肪细胞模型组比较,NaHS (10-4和10-3mol/L)处理细胞24和48 h以时间和剂量依赖的方式增加了IR 3T3-L1脂肪细胞葡萄糖的消耗量(均为P<0.05)。
2.4 NaHS对IR 3T3-L1脂肪细胞葡萄糖摄取影响
NaHS(10-4和10-3mol/L)处理细胞24和48 h与IR脂肪细胞模型组比较以时间和剂量依赖的方式增加了IR 3T3-L1脂肪细胞对葡萄糖的摄取量(均为P<0.05),见表3。
2.5 NaHS对IR 3T3-L1脂肪细胞Glut4表达影响
与IR脂肪细胞模型组比较,NaHS(10-4和10-3mol/L)处理细胞48 h以剂量依赖的方式增加了IR 3T3-L1脂肪细胞G1ut4 mRNA和蛋白的表达(均P<0.05);NaHS(10-3mol/L)处理细胞24和48 h以时间依赖的方式增加了IR 3T3-L1脂肪细胞G1ut4 mRNA和蛋白的表达(均P<0.05)。见图2、3。
表1 NaHS对IR 3T3-L1脂肪细胞活性的影响(¯±s)
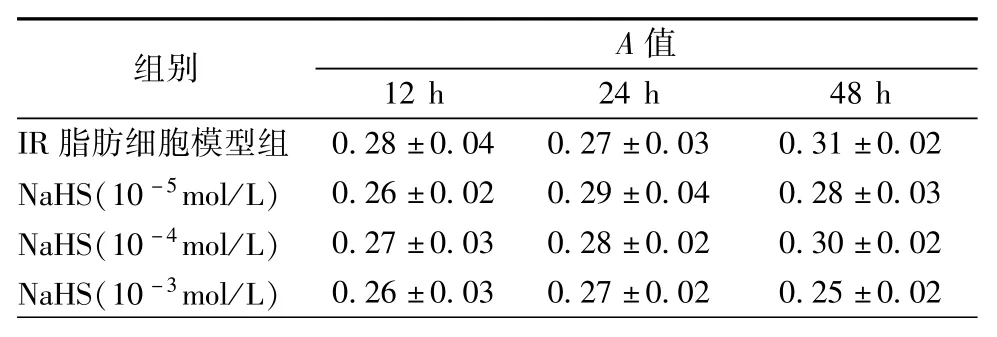
表1 NaHS对IR 3T3-L1脂肪细胞活性的影响(¯±s)
组别A值12 h 24 h 48 h IR脂肪细胞模型组0.28±0.04 0.27±0.03 0.31±0.02 NaHS(10-5mol/L)0.26±0.02 0.29±0.04 0.28±0.03 NaHS(10-4mol/L)0.27±0.03 0.28±0.02 0.30±0.02 NaHS(10-3mol/L)0.26±0.03 0.27±0.02 0.25±0.02
表2 NaHS对IR 3T3-L1脂肪细胞葡萄糖消耗的影响(¯±s)
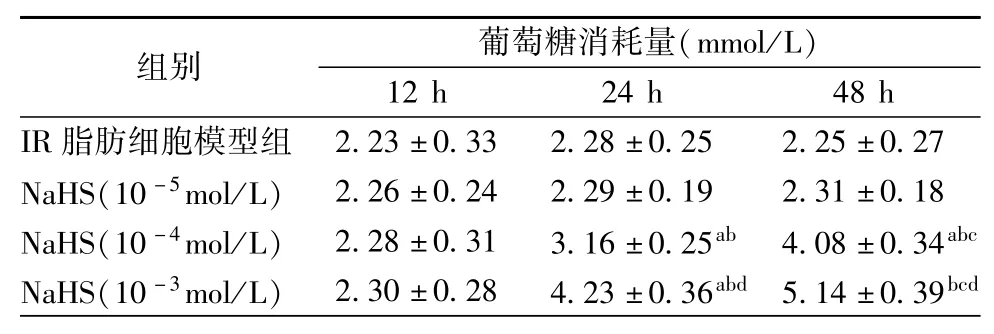
表2 NaHS对IR 3T3-L1脂肪细胞葡萄糖消耗的影响(¯±s)
注:与模型组比较,aP<0.05;与NaHS(10-5mol/L)组或12 h组比较,bP<0.05;与24 h组比较,cP<0.05;与NaHS(10-4mol/L)组比较,dP<0.05
组别葡萄糖消耗量(mmol/L) 12 h 24 h 48 h IR脂肪细胞模型组2.23±0.33 2.28±0.25 2.25±0.27 NaHS(10-5mol/L)2.26±0.24 2.29±0.19 2.31±0.18 NaHS(10-4mol/L)2.28±0.31 3.16±0.25ab4.08±0.34abcNaHS(10-3mol/L)2.30±0.28 4.23±0.36abd5.14±0.39bcd
3 讨论
IR是2型糖尿病、高血压和肥胖等疾病的“共同土壤”,改善IR是防治糖尿病等疾病的重要途径[4]。高血糖、高胰岛素、高游离脂肪酸血症和氧化应激等因素均可诱导IR[5]。本研究中用含10-7mol/L胰岛素的高糖DMEM培养液诱导3T3-L1脂肪细胞产生IR,结果显示3T3-L1脂肪细胞葡萄糖消耗和摄取量均显著降低,表明高糖高胰岛素诱导3T3-L1细胞产生IR。
表3 NaHS对IR 3T3-L1脂肪细胞葡萄糖摄取的影响(±s)
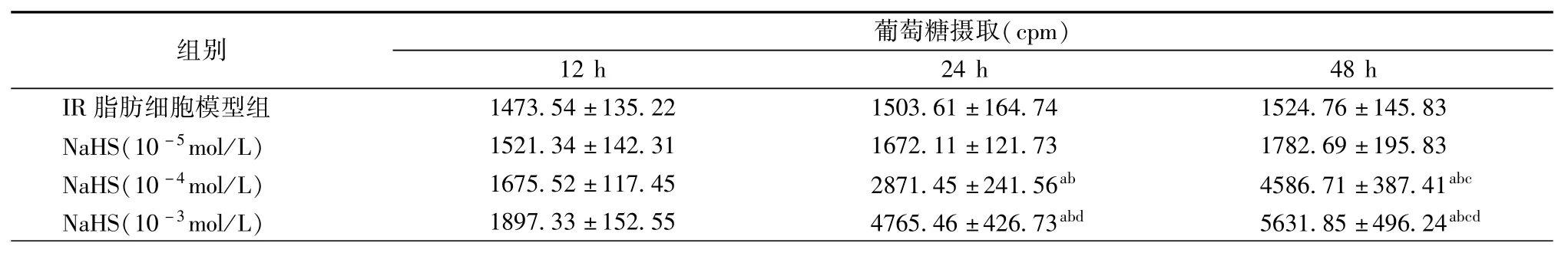
表3 NaHS对IR 3T3-L1脂肪细胞葡萄糖摄取的影响(±s)
注:与模型组比较,aP<0.05;与NaHS(10-5mol/L)组或12 h组比较,bP<0.05;与24 h组比较,cP<0.05;与NaHS(10-4mol/L)组比较,dP<0.05
组别葡萄糖摄取(cpm) 12 h 24 h 48 h IR脂肪细胞模型组1473.54±135.22 1503.61±164.74 1524.76±145.83 NaHS(10-5mol/L)1521.34±142.31 1672.11±121.73 1782.69±195.83 NaHS(10-4mol/L)1675.52±117.45 2871.45±241.56ab4586.71±387.41abcNaHS(10-3mol/L)1897.33±152.55 4765.46±426.73abd5631.85±496.24abcd
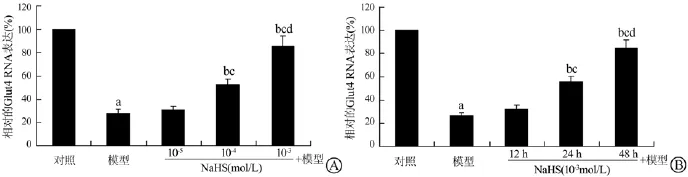
图2 NaHS对IR 3T3-L1脂肪细胞G1ut4 mRNA表达的影响
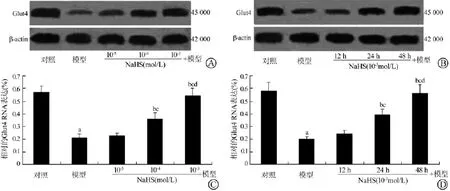
图3 NaHS对IR 3T3-L1脂肪细胞G1ut4蛋白表达的影响
研究表明H2S和NO、CO一样,符合作为细胞内及细胞间信使物质的标准,被认为是第三种气体信号分子。哺乳动物细胞中的胱硫醚β合成酶、胱硫醚1裂解酶和半胱氨酸转移酶等催化可产生内源性H2S[6]。H2S在体内存在有两种形式,即气体H2S和NaHS形式。NaHS在体内液体环境中可离解为钠离子和硫氢根离子,而硫氢根离子与体内的氢离子结合生成H2S,H2S和NaHS之间形成一种动态平衡[7]。NaHS比H2S更容易保证溶液中H2S浓度的稳定和准确度,因此常使用NaHS作为外源性H2S的供体。H2S的生理和病理生理作用目前尚未完全阐明,它不仅在生理条件下参与了许多机体生理功能的调节,而且还参与许多疾病的病理过程[8-9]。研究表明糖尿病患者血清H2S水平明显降低,与IR的程度呈负相关[10]。体外研究发现外源性H2S能增加正常脂肪细胞对葡萄糖的摄取[11]。本研究的结果显示与IR模型组比较,外源性H2S供体NaHS显著增加IR 3T3-L1脂肪细胞葡萄糖消耗和摄取量,这些表明H2S能改善脂肪细胞IR。
脂肪细胞是外周胰岛素敏感组织之一,大部分葡萄糖依赖Glut4转运进入细胞内,胰岛素结合于其受体后,通过下游的PI3K/Akt和CAP/Cbl信号转导通路,使胞质内的Glut4迅速转位至细胞膜,参与葡萄糖转运。这一转导通路上的缺陷是导致IR的重要原因[12]。本研究的结果显示,伴有IR的3T3-L1脂肪细胞中Glut4的表达明显降低,而NaHS处理显著增加了IR的3T3-L1细胞中Glut4的表达。这些结果表明H2S改善IR的作用可能是通过上调IR的3T3-L1细胞中Glut4的表达而最终实现的。
总之,外源性H2S改善了高糖高胰岛素诱导的脂肪细胞的IR,其机制可能与H2S上调Glut4的表达有关。
[1]Köhn C,Dubrovska G,Huang Y,et al.Hydrogen sulfide: potent regulator of vascular tone and stimulator of angiogenesis[J].Int J Biomed Sci,2012,8:81-86.
[2]Huang W,Chen S,Yang M,et al.The effect of endogenous HS on the kidney of the diabetic nephropathic rats[J].Chin J Diatbetea,2009,17:943-945.(in Chinese)黄雯,陈桑,杨敏,等.硫化氢对糖尿病大鼠肾脏病变的减缓作用[J].中国糖尿病杂志,2009,17:943-945.
[3]Patel M,Shah G.Possible role of hydrogen sulfide in insulin secretion and in development of insulin resistance[J].J Young Pharm,2010,2:148-151.
[4]Yi P,Lu FE,Chen G,et al.Molecular mechanism of insulin resistame induced by FFAs in 3T3-L1 adilmeytes through activatiag IKKβ[J].Chin J Diatbetea,2008,16:221-224.(in Chinese)易屏,陆付耳,陈广,等.游离脂肪酸诱导3T3-L1脂肪细胞胰岛素抵抗的分子机制[J].中国糖尿病杂志,2008,16: 221-224.
[5]Guo HH,Ling WH,Xia M,et al.Anthocyanin attenuates oxidative stress-induced insulin resistance in 3T3-L1 adipocytes[J].Chin J Diatbetea,2010,18:650-653.(in Chinese)郭红辉,凌文华,夏敏,等.花色苷对氧化应激诱导脂肪细胞胰岛素抵抗的改善作用[J].中国糖尿病杂志,2010,18: 650-653.
[6]Renga B.Hydrogen sulfide generation in mammals:the molecular biology of cystathionine-β-synthase(CBS)and cystathionine-γlyase(CSE)[J].Inflamm Allergy Drug Targets,2011,10:85-91.
[7]Medeiros JV,Bezerra VH,Lucetti LT,et al.Role of KATP channels and TRPV1 receptors in hydrogen sulfide-enhanced gastric emptying of liquid in awake mice[J].Eur J Pharmacol,2012,693:57-63.
[8]Dongó E,Hornyák I,Benko Z,et al.The cardioprotective potential of hydrogen sulfide in myocardial ischemia/reperfusion injury[J].Acta Physiol Hung,2011,98:369-381.
[9]Streeter E,Ng HH,Hart JL.Hydrogen sulfide as a vasculoprotective factor[J].Med Gas Res,2013,3:9.
[10]Okamoto M,Yamaoka M,Takei M,et al.Endogenous hydrogen sulfide protects pancreatic beta-cells from a high-fat diet-induced glucotoxicity and prevents the development of type 2 diabetes[J].Biochem Biophys Res Commun,2013,442:227-233.
[11]Xue R,Hao DD,Sun JP,et al.Hydrogen sulfide treatment promotes glucose uptake by increasing insulin receptor sensitivity and ameliorates kidney lesions in type 2 diabetes[J].Antioxid Redox Signal,2013,19:5-23.
[12]Zhu S,Sun F,Li W,et al.Apelin stimulates glucose uptake through the PI3K/Akt pathway and improves insulin resistance in 3T3-L1 adipocytes[J].Mol Cell Biochem,2011,353:305-313.
Effects of extrogenous hydrogen su lfide on the exp ression of glucose transporter 4 in 3T3-L1 adipocytes w ith insulin resistance
Yang Feike1,Liu Jingfang1,Chen Wei1,He Xinping1,Lu Guijing2.
1 Department of Geriatric Medicine,Changsha Central Hospital,Changsha 410004,China;2 Department of Cardiovascular Medicine,Xiangya Hospital,Central South University
Objective To investigate the effect of extrogenous hydrogen sulfide(H2S)on the expression of glucose transporter 4(Glut4)in 3T3-L1 adipocytes with insulin resistance and explore the mechanism.M ethods 3T3-L1 adipocytes were incubated with high glucose and insulin to induce insulin resistance.The cells were treated with different concentrations of sodium bisulfide(NaHS)(10-5,10-4and 10-3mol/L)for 12,24 and 48 h.MTT assay was used to detect the cell viability.The glucose consumption in the medium was measured by glucose oxidase method.The glucose uptake was tested by 2-deoxy-[3H]-D-glucose method.The mRNA and protein expressions of Glut4 were measured by Real-time PCR and Western-Blot.Results Compared with control group,the glucose consumption and uptake and expressions of Glut4 were significantly decreased in the IR model group(all P<0.05).Compared with control group,NaHS(10-5,10-4and 10-3mol/L)did not affect the cell viability.Compared with model group,the glucose consumption and uptake and expressions of Glut4 were significantly increased by treatment with NaHS(10-4and 10-3mol/L)for 24 and 48 h(all P<0.05).Conclusions Extrogenous H2S improves IR induced by high glucose and insulin in 3T3-L1 adipocytes,and the mechanism may be related with up-regulation of Glut4 by H2S.
Hydrogen sulfide; Insulin resistance; High glucose; High insulin; Glucose transporter type 4
Liu Jingfang,Email:yangfeike@126.com
2013-12-10)
(本文编辑:周白瑜)
10.3969/j.issn.1007-5410.2014.02.016
长沙科技计划项目(K120749-31)
410004长沙市中心医院老年医学科(杨非柯、刘竟芳、陈伟、何新平);中南大学湘雅医院心血管内科(卢桂静)
刘竟芳,电子信箱:yangfeike@126.com
This work was supported by a grant from the Epidemiological Investigation of Geriatric Diseases and Community-Based Interventions in Changsha City(No.K120749-31)
