一种适用于RAPD分析的微量山茶DNA提取方法的建立
2014-03-22范晶李仲芳2高明辉伏秦超
范晶李仲芳,2高明辉伏秦超
(1. 乐山师范学院生命科学学院,乐山 614004;2. 天水师范学院生命科学与化学学院,天水 741001)
一种适用于RAPD分析的微量山茶DNA提取方法的建立
范晶1李仲芳1,2高明辉1伏秦超1
(1. 乐山师范学院生命科学学院,乐山 614004;2. 天水师范学院生命科学与化学学院,天水 741001)
为建立一种满足RAPD-PCR分析的简便且高产率微量山茶基因组DNA提取方法,探索了在无液氮条件下,采用简化试验步骤的改良CTAB、SDS和Triton X-100方法分别提取山茶新鲜和干燥叶片DNA,通过光谱扫描和测定DNA在波长230 nm,260 nm和280 nm时的吸光度,比较不同DNA提取方法、材料保存方法以及材料用量对DNA提取效率的影响。结果表明,干燥叶片比新鲜叶片更适合作为DNA提取材料,改良CTAB法在提取干燥山茶DNA时纯度和产率较理想,其A260/A280值为1.595-1.736,每克叶片可得到230-295 μg DNA,高质量DNA经RAPD-PCR扩增可获得清晰扩增条带。100 mg干燥山茶叶片适合获得高纯度和高产率的DNA,增加材料用量可增大DNA总量,但也增加了DNA中杂质含量。
DNA提取 RAPD 山茶 改良CTAB方法
山茶(Camellia japonica L.)属于山茶科山茶属常绿灌木,是原产于中国的珍贵花卉,在中国十大名花中排名第七,具有很高的景观价值,广泛应用于园林绿化、室内盆栽、立体景观和插花艺术。我
国山茶主要集中在云南、四川、广西和广东等地,川茶花分布于四川盆地,品种繁多,占据了全国山茶20%的资源,在中国茶花中独具一格[1]。乐山位于四川盆地西南部,介于北纬2828-2956,东
经10215'-10415',是全国绿化模范城市、中国优秀旅游城市和国家园林城市。据文献报道,乐山现发现63个山茶品种,其中包括珍贵的峨眉红山茶、怒江红山茶、金沙江红山茶和杜鹃红山茶等山茶原种资源[2]。关于乐山地区山茶的研究,目前主要集中在资源调查和利用同工酶酶谱进行分类学研究[3,4]。然而,乐山山茶遗传多样性方面还缺少系统研究。快速获得高质量和高产率DNA是开展山茶群体遗传结构和多样性分析的重要前提,常规DNA提取方法通常包含液氮研磨样品、反复离心抽提、乙醇沉淀和洗涤DNA等步骤,上述过程操作步骤较多,在进行大规模样品的DNA提取时工作量较大,不能适应大批量样品的快速检测。山茶还富含多糖、多酚及其他次生代谢物质,这些物质可严重干扰所提取DNA的产率及质量[5]。本研究在参考已报道常规CTAB、SDS和Triton X-100 DNA提取方法基础上[6-8],通过简化试验步骤和替换部分实验试剂,探索了改良的DNA提取方法,同时通过比较不同DNA提取方法、不同材料保存方法和不同材料用量对DNA提取效果的影响,最终建立了一种简便、高产率的微量山茶DNA提取改良方法,为后续开展乐山地区山茶群体遗传多样性研究奠定了基础。
1 材料与方法
1.1 材料
供试山茶材料有七心红山茶、浙江红山茶、四季红山茶、栀子茶、复色骄傲、复色三月茶、三月茶和窄叶西南。PCR buffer、MgCl2、Taq DNA聚合酶、dNTPs等RAPD-PCR反应试剂购自Takaka公司,随机扩增引物序列为5'-TGATCCCTGG- 3',由上海英俊公司(Invitrogen)合成,其他化学试剂为国产分析纯试剂。
1.2 方法
1.2.1 基因组DNA提取 DNA提取方法参考已发表文献[6-8],并对操作步骤进行了优化,主要体现在免去常规DNA提取时使用液氮、采用更常规和经济的石英砂进行样品研磨;减少氯仿/异戊醇等试剂抽提和离心取上清次数;减少材料用量以便降低DNA中杂质含量;为减少所获得微量DNA的损失,在异丙醇沉淀DNA后,采用无水乙醇代替75%乙醇洗涤DNA 1次。
改良CTAB法参考已发表文献并加以改良[6]。取石英砂磨碎后的100 mg山茶叶片,放入1.5 mL Eppendorf管中,加入750 μL 65℃预热的2% CTAB提取液和15 μL β-巯基乙醇,轻轻上下颠倒混匀后放置65℃水浴锅中保温50 min,期间每隔10 min左右摇匀1次。从水浴锅中取出离心管,加入450 μL氯仿∶异戊醇(24∶1)进行抽提,摇匀后12 000 r/min离心10 min,转移500 μL上清液至一个干净离心管中,加入10%体积的3 mol/L醋酸钠溶液和等体积的预冷异丙醇,混匀后于-20℃放置2 h沉淀DNA。12 000 r/min离心10 min弃上清,所获得DNA沉淀用500 μL无水乙醇洗涤一次,12 000 r/min离心5 min后去除无水乙醇,于空气晾干DNA沉淀,溶解于50 μL无菌水并保存于-20℃备用。
改良SDS法参照分子生物学实验指导并加以改良[7]。取100 mg石英砂磨碎的山茶粉末叶片装入1.5 mL Eppendorf中,加入750 μL经65℃预热的SDS细胞DNA提取液,上下颠倒轻轻混匀,65℃水浴50 min,期间每10 min左右将离心管摇匀1次,将离心管从水浴锅中取出并加入235 μL的5 mol/L KCL溶液,冰浴20 min后12 000 r/min离心5 min,将750 μL上清液转入新的1.5 mL离心管中,加入等体积氯仿/异戊醇(24∶1)进行DNA抽提,12 000 r/min离心10 min后取上清并转移至新的离心管中,加等体积预冷异丙醇,-20℃放置2 h沉淀DNA,后续步骤同改良CTAB法。
改良Triton X-100法参照并改良了田杰的方法[8]。取石英砂研磨的山茶叶片粉末100 mg装入1.5 mL Eppendorf管中,加入750 μL的Triton X-100 DNA提取液,轻轻混匀后放置65℃水浴50 min,每10 min左右摇匀1次,之后从水浴锅中取出离心管,加入60%体积的氯仿/异戊醇(24∶1)混匀,12 000 r/min离心10 min取500 μL上清,加等体积异丙醇并混匀,-20℃放置2 h沉淀DNA,后续步骤同改良CTAB法。
1.2.2 DNA提取效果检测 分别取10 μL改良CTAB、SDS和Triton-X100法提取的DNA,转入比色皿中并用无菌水补至2 mL,使用UV1901紫外分光光度计测量230 nm、260 nm和280 nm波长时吸
光度判断DNA的浓度及产率,根据A260nm/A280nm、A260nm/A230nm比值判断所制备DNA的纯度,参考吴波等文献计算DNA的浓度和产率,DNA浓度(μg/mL)=稀释倍数×OD260×50,DNA产率(μg/g)=DNA浓度(μg/mL)×体积(mL)/叶片重量(g)[9]。
1.2.3 RAPD-PCR扩增及琼脂糖凝胶电泳 RAPDPCR扩增反应体系为20 μL,其中含1×PCR Buffer、200 μmol dNTP、2 mmol MgCl2、0.8 μmol上下游引物、lU Taq DNA聚合酶和1 μL DNA模板。PCR扩增条件为94℃预变性4 min;94℃变性1 min,37℃退火1 min,72℃延伸2 min,共45个循环;72℃延伸10 min。PCR扩增结束后,扩增产物用0.8%浓度的琼脂糖凝胶电泳进行检测。
2 结果
2.1 提取方法对DNA提取效果的影响
为了确定适合微量山茶叶片DNA提取的方法,我们采用改良CTAB、SDS和Triton X-100方法分别提取100 mg七心红山茶叶片DNA,通过紫外分光光度计进行DNA光谱扫描和测定230 nm、260 nm和280 nm波长时的吸光度。结果显示3种方法中,改良Triton X-100方法的DNA产率最高,改良CTAB方法次之,改良SDS方法最低。但在DNA纯度方面,A260/A280和A260/A230比值显示改良CTAB方法>改良Triton X-100方法>改良SDS方法(表1),该结果和DNA光谱扫描结果一致(图1)。改良的CTAB方法(图1-a)和改良SDS方法(图1-b)提取的DNA光谱扫描结果显示两者在波长260 nm时均有一个比较明显的DNA吸收峰,说明均成功提取到DNA。但改良SDS方法提取的DNA在230 nm和280 nm波长时还分别有一个比较明显的吸收峰,说明DNA中含有一定比例的盐、糖和蛋白质等杂质(图1-b)。而Triton X-100提取的DNA光谱扫描结果显示扫描曲线偏离基线较严重,说明提取物中除了含有较高浓度的DNA外,还含有较高浓度的杂质(图1-c),综合来看,改良CTAB方法最适合作为微量山茶DNA的提取方法。

表1 不同方法对DNA提取效果的影响
2.2 材料保存方法对DNA提取效果的影响
为了探明山茶保存状态对DNA提取的影响,本研究采用改良CTAB法分别提取200 mg新鲜叶片和干燥叶片的DNA。光谱扫描结果显示干燥叶片(图1-d)和新鲜叶片(图1-e)提取物在260 nm处均有吸收峰,说明均能提取DNA,DNA吸光度结果表明干燥叶片DNA产率高于新鲜叶片,且干燥叶片A260/A280比值大于新鲜叶片对应比值(表1),表明干燥叶片更适合作为DNA提取材料。
2.3 材料用量对DNA提取效果的影响
为了探索山茶用量对提取DNA的影响,我们采用改良的CTAB方法分别提取了100和200 mg山茶干燥叶片DNA。结果显示,增加材料的用量可以虽然可以增加提取DNA的总量(表1),但会导致DNA中杂质含量增多,光谱扫描结果图1-a显示100 mg山茶叶片提取的DNA在波长260 nm时有一个比较明显的DNA吸收峰。图1-d显示200 mg山茶叶片提取产物在230 nm、260 nm和280 nm波长处各有一个比较明显的DNA吸收峰,说明提取的DNA中含有较大含量的杂质,其纯度低于100 mg叶片提取的DNA,因此,控制材料用量是获得高纯度DNA的关键。
2.4 RAPD-PCR扩增结果
为了验证改良CTAB方法提取的DNA能否满足分子标记遗传学分析,我们提取了7个硅胶干燥且低温保存时间长达131 d的山茶叶片基因组DNA,
采用一个随机扩增引物对其进行RAPD-PCR扩增。图2结果显示,以7个山茶样品的DNA为模板进行扩增,均能得到清晰的DNA条带并显示出基因多态性,说明本研究建立的改良CTAB法适用于山茶分子遗传标记分析。
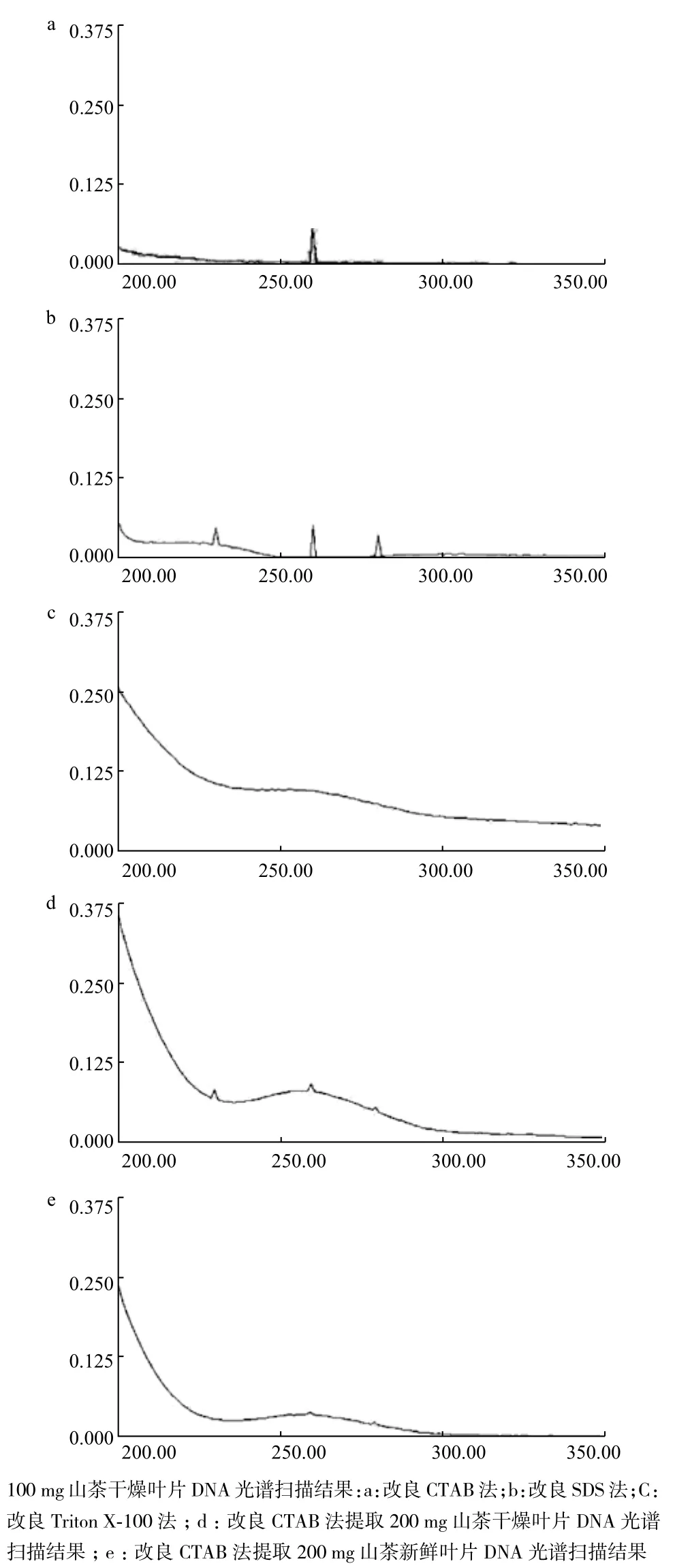
图1 3种方法提取DNA的光谱扫描结果

图2 7个山茶样品的RAPD-PCR扩增结果
3 讨论
分子标记技术现已广泛应用于植物遗传育种和系统进化研究,由于研究时需要涉及到较大数量样品,因此,建立一种操作步骤简单的适合较大群体遗传分析的DNA提取方法受到广大研究人员的重视[10]。目前,通过已有文献报道的方法能够提取出山茶DNA并进行遗传标记分析[11,12],但普遍存在使用液氮和操作步骤复杂等可改进之处,同时不同DNA提取方法还存在各自的优缺点和最佳应用范围。刘婵等[13]采用CTAB、改良CTAB、SDS、改良SDS 4种方法提取滇山茶基因组DNA,结果发现改良CTAB为最佳DNA提取方法,SDS法不能较好提取DNA,他们在运用改良CTAB方法提取DNA时,首先采用液氮磨碎样品,然后用氯仿-异戊醇-乙醇溶液抽提上清2-3次,RNaseA消化去除RNA,最后采用99.5%的冷乙醇沉淀DNA,76%的乙醇洗涤DNA,操作步骤相对较为复杂。Yang等[14]采用改良SDS法提取大果油茶嫩叶基因组DNA,通过添加高浓度醋酸钾溶液沉淀蛋白质-SDS复合物和RNA、70%乙醇洗涤DNA去除盐等杂质以及RNA酶消化DNA中的RNA等步骤,获得进行ISSR-PCR分析的DNA。本研究采用3种简化试验步骤的改良CTAB、SDS和Triton X-100方法提取DNA,结果显示改良的CTAB、SDS和Triton-X100三种方法均能成功提取出微量山茶DNA,但以改良CTAB方法提取的DNA效果最佳(表1,图1)。在本研究改良CTAB方法中,改进步骤主要表现为采用常用的石英砂代替液氮对材料进行研磨,减少氯仿/异戊醇
抽提和离心取上清次数,在进行DNA沉淀时,采用异丙醇代替乙醇进行DNA沉淀,主要是考虑了2个因素:第一,异丙醇沉淀DNA效率高于乙醇;第二,异丙醇沉淀可减少DNA受多糖和杂蛋白污染的程度。由于提取DNA时使用的是微量材料,为减少DNA的损失,我们还对2个实验步骤进行了改进:第一,异丙醇沉淀DNA时加入10%体积的3M醋酸钠溶液,其原理是用阳离子Na+可中和DNA分子上的负电荷,以便降低DNA分子之间的同种电荷排斥力,促进DNA发生聚合并形成沉淀。第二,我们采用无水乙醇代替75%乙醇洗涤DNA,一方面可以减少DNA再次溶解于水而导致进一步损失;另一面是考虑到沉淀DNA的异丙醇不容易挥发,而无水乙醇挥发更快,可促进DNA更快干燥。
高质量基因组DNA的获得是进行山茶分子遗传多样性研究的关键步骤,由于山茶细胞内含有大量的多糖、酚类和色素等物质[15]。它们可干扰所获得基因组DNA的质量,严重时可导致PCR扩增失败,而通过减少材料用量来降低DNA中杂质含量是较好的选择。试验中我们以100和200 mg山茶叶片为材料进行DNA提取,结果显示100和200 mg材料均能获得较高DNA产率,每克叶片DNA可分别达到295 μg和230 μg。谭晓风等[16]采用改良CTAB法提取32个山茶DNA时,每克叶片DNA提取产率最高为110 μg。倪穗等[17]采用改良CTAB法提取红山茶基因组DNA时,每克鲜组织可得到50 μg左右的总DNA。
野外采集材料往往存在一些客观条件制约,表现尤为突出的是所采集的样品不能及时带回实验室进行处理,因此试验样品的处理和保存对于成功开展后续分析具有重要的意义。林立等[18]在进行中日5个岛屿山茶种群遗传多样性研究时,采用冰袋对山茶嫩叶进行保鲜运输。周阿涛等[19]在进行云南山茶序列多态性分析时,DNA提取时使用的样品是常温保存且变色硅胶干燥的山茶新鲜叶片。本研究中,同时比较了新鲜叶片和硅胶干燥叶片的DNA提取效果,发现硅胶干燥叶片提取DNA的产率和纯度均优于新鲜叶片。骆文华等[20]在提取广西火桐基因组DNA时也得到类似结果,他们发现保存时间90 d的硅胶干燥叶片的DNA产率高于新鲜叶片,但DNA纯度相当。代文娟等[21]认为硅胶干燥保存时间在10 d至l0个月之间的植物叶样最适合提取DNA,此阶段样品所得DNA得率高且纯度较好。本研究应用改良CTAB方法提取了7个保存时间为131 d的硅胶干燥山茶样品的基因组DNA,RAPDPCR结果显示各个样品提取的DNA能够扩增出条带并显示出较好的遗传多样性。本研究为下一步开展乐山山茶群体遗传结构研究奠定了基础。
4 结论
采用光谱扫描和测定DNA吸光度比较改良CTAB、SDS和Triton X-100法提取山茶DNA的效率,结果表明本研究的建立的改良CTAB法适合作为山茶DNA的提取方法,DNA完整性较好,A260/A280值介于1.595-1.736,DNA产率较其他文献报道方法有较大提高,每克叶片DNA含量可达230-295 μg。干燥叶片比新鲜叶片更适合作为DNA提取材料,在无液氮条件下,采用改良CTAB法提取100 mg山茶干燥叶片DNA,所得DNA的纯度和产率均较为理想,且能够满足RAPD-PCR遗传分析。本研究建立了一种简便且高产率的微量山茶DNA提取方法,可简化试验处理过程、降低实验成本、有效提高大批样品的检测效率。
[1]陈睿, 鲜小林, 秦帆, 等. 四川观赏用山茶资源及景观应用研究[J]. 北方园艺, 2012, 11:97-101.
[2]李仲芳, 杨霞, 谢孔平, 等. 乐山茶花品种资源调查报告Ⅱ[J].南方农业学报, 2012, 43(9):1357-1362.
[3]李仲芳, 杨霞, 高彦明. 乐山茶花品种资源调查报告[J]. 北方园艺, 2011(20):86-89.
[4]胡欢, 杨述章, 李仲芳, 等. 30种茶花过氧化物酶同工酶分析[J].四川师范大学学报, 2013, (2):296-301.
[5]Umar KM, Mohammed AS, Radu S, et al. Extraction and isolation of PCR amplifiable genomic DNA from Camellia sinensis(L.)Kuntze[J]. Food, Agriculture and Environment, 2011, 9(3-4):529-532.
[6]陈析丰, 查笑君, 范文杰, 等. 山茶花叶片DNA提取及RAPD反应体系的研究[J]. 植物研究, 2007, 27(2):219-220.
[7]魏群. 分子生物学实验指导[M]. 北京:高等教育出版社,
2007:113-114.
[8]田杰, 罗科. 水稻总DNA的快速制备[J]. 应用与环境生物学报, 2004, 10(2):143-145.
[9]吴波, 高丹, 潘超美, 等. 不同方法提取吴茱萸叶片基因组DNA和RNA的比较[J]. 安徽农业大学学报, 2012, 39(1):111-115.
[10]戴剑, 洪德林, 张大栋, 等. 一种快速高效的DNA提取方法研究[J]. 麦类作物学报, 2011, 31(3):437-442.
[11]李娟, 江昌俊, 王朝霞. 中国茶树初选核心种质遗传多样性的RAPD分析[J]. 遗传, 2005, 27(5):765-771.
[12]Chen SX, Qi GN, Li H, et al. Rapid establishment of polymerase chain reaction-restriction fragment length polymorphism(PCRRFLP)system for chloroplast DNA in tea[Camellia sinensis(L.)O. Kuntze][J]. African Journal of Biotechnology, 2012, 11(33):8181-8188.
[13]刘婵, 王博, 段青, 等. 滇山茶基因组 DNA 不同提取方法效果比较[J]. 江苏农业科学, 2011, 6:49-50.
[14]Yang CF, Chen BL, Huang CM, et al. Isolation of genomic DNA and establishment of ISSR reaction system for Camellia crepnelliana Tutch[J]. Journal of Southern Agriculture, 2011, 42(3):233-235.
[15]Lin JK, KudrnaD, Rod AW. Preparation of high molecular weight(HMW)genomic DNA from tea plant(Camellia sinensis)for BAC library construction[J]. Journal of Agricultural Science and Technology, 2009, 3(1):1-10.
[16]谭晓风, 漆龙霖, 黄晓光, 等. 山茶属植物叶片DNA抽提[J].中南林学院学报, 1999(4):75-77.
[17]倪穗, 田敏, 李纪元. 红山茶高质量基因组DNA的提取[J].宁波大学学报, 2007, 20:163-167.
[18]林立, 倪穗, 李纪元, 等. 中日5个岛屿山茶种群遗传多样性研究[J]. 广西植物, 2012, 32(3):298-303.
[19]周阿涛, 岳亮亮, 李旻, 等. 云南山茶(Camellia reticulata)nrDNA nrDNA ITS序列多态性分析[J]. 植物科学学报, 2013, 31(1):1-10.
[20]骆文华, 黄仕训, 马虎生, 等. 广西火桐基因组DNA提取方法的研究[J]. 湖北农业科学, 2013, 52(20):5060-5062.
[21]代文娟, 唐文秀, 邓涛, 等. 狭叶坡垒基因组总DNA的提取和纯化方法研究[J]. 生物技术通报, 2011(7):101-105.
(责任编辑 狄艳红)
Establishment of a DNA Extraction Method Suitable for RAPD Analysis of Trace Arnounts of Camellia japonica L.
Fan Jing1Li Zhongfang1,2Gao Minghui1Fu Qinchao1
(1. College of Life Science,Leshan Normal University,Leshan 614004;2. College of Life Science and Chemistry,Tianshui Normal University,Tianshui 741001)
To explore a simple and high yield method for preparing DNA suitable for RAPD analysis, trace fresh and dried leaves of Camellia japonica L. were used as materials. Moreover, the improved CTAB, SDS and Triton X-100 methods without using liquid nitrogen were compared. The efficiencies of different DNA extraction methods, the effects of material preservation and material amounts on DNA qualities were compared based on the absorbance spectrum and ratio of absorbance at 230 nm, 260 nm and 280 nm by Ultraviolet Spectrophotometry. Results showed that dried materials were more suitable for DNA extraction than fresh materials. The improved CTAB protocol for isolating DNA from dried leaf tissues gave satisfied results, with the ratio of A260/A280 ranged from 1.595 to 1.736. Furthermore, the DNA yield reached 230 to 295 μg per gram of leaf. Finally, clear amplified bands were detected by RAPD-PCR. High quality and high yield genomic DNA could be prepared from 100 mg dried leaves of Camellia japonica L., an increase in materials leads to the increased in DNA amount, however, impurity was also increased.
DNA extraction RAPD Camellia japonica L. Improved CTAB protocol
10.13560/j.cnki.biotech.bull.1985.2014.12.011
2014-06-174
乐山师范学院科研项目(Z1201),乐山师范学院峨眉山生物多样性保护与利用研究所科研项目(12S01)
范晶,男,博士,副教授,研究方向:植物分子生物学;E-mail:fanjing972001@sohu.com
