吡草醚原药对大鼠胚胎及胎仔发育的影响
2014-03-22宋世震樊柏林唐晓荞孙凡中刘春霞
万 力, 宋世震, 樊柏林, 刘 瑶, 唐晓荞, 孙凡中, 刘春霞,*
1. 湖北省疾病预防控制中心 应用毒理湖北省重点实验室,武汉 430079 2. 武汉科技大学医学院公共卫生学院,武汉 430065
吡草醚(pyraflufen-ethyl)是一种新型苯基吡唑类苗后除草剂,在小麦以及各种杂草间有很好的选择性,尤其对猪殃殃等阔叶杂草有很好的防效[1-3],已在农业生产中得到广泛的运用。作为新型低毒除草剂,吡草醚目前的主要应用形式是以悬浮剂喷洒于田间,可在杂草和小麦表面沉积,最终依靠生物的富集作用以不同的代谢形式进入人群的食物链中。加之小麦在农产业中的重要地位,人群的食用同样会摄入吡草醚或代谢产物[4]。随着吡草醚在农业生产中应用的日益广泛,其安全性受到研究者的关注,现有的研究资料均表明吡草醚为环境友好型农药,毒性低,环境污染小[5],但国内外关于吡草醚毒性的研究资料大多以环境中植物、小型动物为对象[6-8],对啮齿类动物一般毒性及特殊毒性资料尚少,同时致畸试验是农药登记必不可少的一方面。根据吡草醚原药对大鼠急性经口LD50>464.00 mg·kg-1,急性经皮LD50大于2 150.00 mg·kg-1的试验结果,本研究小组依据《GB 15670-1995 农药登记毒理学试验方法》[9]设计试验,旨在通过经口染毒受孕大鼠,研究吡草醚对雌鼠及胚胎可能产生的影响,为吡草醚的安全管理提供参考。
1 材料和方法(Materials and methods)
1.1 材 料
1.1.1 受试物:吡草醚原药,白色固体,纯度95%。
1.1.2 对照品:阴性对照品为1%羧甲基纤维素钠溶液,为国产分析纯试剂(国药集团化学试剂有限公司),阳性对照品为维生素A胶丸(每1万IU维生素A相当于3 000 μg),国药控股星鲨制药(厦门)有限公司。
1.1.3 实验动物SPF级wistar大鼠,雌性136只,200~250 g,雄性68只,230~260 g。动物体重差异不超过平均体重的20%,大鼠及饲料均由湖北省实验动物研究中心提供,实验动物及饲料生产许可证号:SCXK(鄂)2008-0005。动物质量合格证号:No.00008559。
1.1.4 仪器:Motic SMZ168-BL体视显微镜(麦克奥迪实业集团有限公司)。
1.2 剂量设计及动物分组
设3个剂量组,分别为高、中、低剂量组(即464.00、92.80、18.56 mg·kg-1),1个阳性对照组,给予维生素A(13 000 μg·kg-1),1个阴性对照组,给予等容量1%羧甲基纤维素钠溶液。雌鼠交配成功后按体重平均分到各实验组,每组动物数约为20只。
1.3 试验方法
大鼠饲养于本单位SPF级大鼠实验室,实验动物使用许可证号:SYXK(鄂)2008-0014。实验室温度20~26 ℃,湿度40%~70%。试验方法按照《GB 15670-1995 农药登记毒理学试验方法》中“致畸试验”的规范方法进行。实验动物按雌、雄比例为2:1同笼交配,次日清晨阴道涂片检查雌鼠,发现精子即确定为受孕第0天(E0)。在雌鼠妊娠第6~15天灌胃给予受试物,连续共10 d,并分别在受孕第0、6、9、12、15、20天称孕鼠体重,妊娠第19.5天,处死孕鼠剖腹取出子宫称重;剖开子宫观察胎鼠状况,记录总着床数,活胎、死胎和吸收胎数;逐一检查胎鼠有无畸形;测量体长(身长+尾长)、体重;再将每窝胎鼠的1/2置于Bouins液中固定,两周后切片检查内脏是否有畸形;另1/2胎鼠剥皮去内脏和脂肪,经茜素红溶液染色,透明后检查骨骼是否有畸形。
1.4 数据统计处理方法
实验数据用Microsoft Excel软件建立数据库,SPSS11.5统计软件处理,计量资料采用方差分析(ANVOA)和Dunnett检验,计数资料采用X2检验和确切概率计算法,显著性检验水平α=0.05。
2 结果(Results)
2.1 一般状况及对体重的影响
染毒期间,阴性对照组及低、中剂量组大鼠一般状况良好,未见明显的异常症状和体征;高剂量组和阳性对照组大鼠孕期体重(妊娠后期)及增重降低,与阴性对照组比较,差异有显著性(p<0.05),低、中剂量组大鼠孕期体重及增重与阴性对照组比较,差异无显著性(p>0.05),结果见表1。高剂量组孕鼠在灌胃给予受试物期间有两只死亡,大体解剖可见子宫内有胎鼠,各脏器外观无异常。
2.2 对胚胎发育的影响
中、高剂量组和阳性对照组胎鼠重量减轻,与阴性对照组比较,差异有显著性(p<0.01),高剂量组和阳性对照组胎鼠体长减短,与阴性对照组比较,差异有显著性(p<0.01)。低剂量组胎鼠体重和体长与阴性对照组比较,差异无显著性(p>0.05),阳性对照组外观畸形主要表现为脑膨出、四肢短等,结果见表2。

表1 吡草醚原药对母鼠孕期体重的影响Table 1 Effects on body weight of female pregnant rats
注:*,**分别表示与对照组比较p<0.05,p<0.01。
Note: Compared with control group,*p<0.05,**p<0.01.
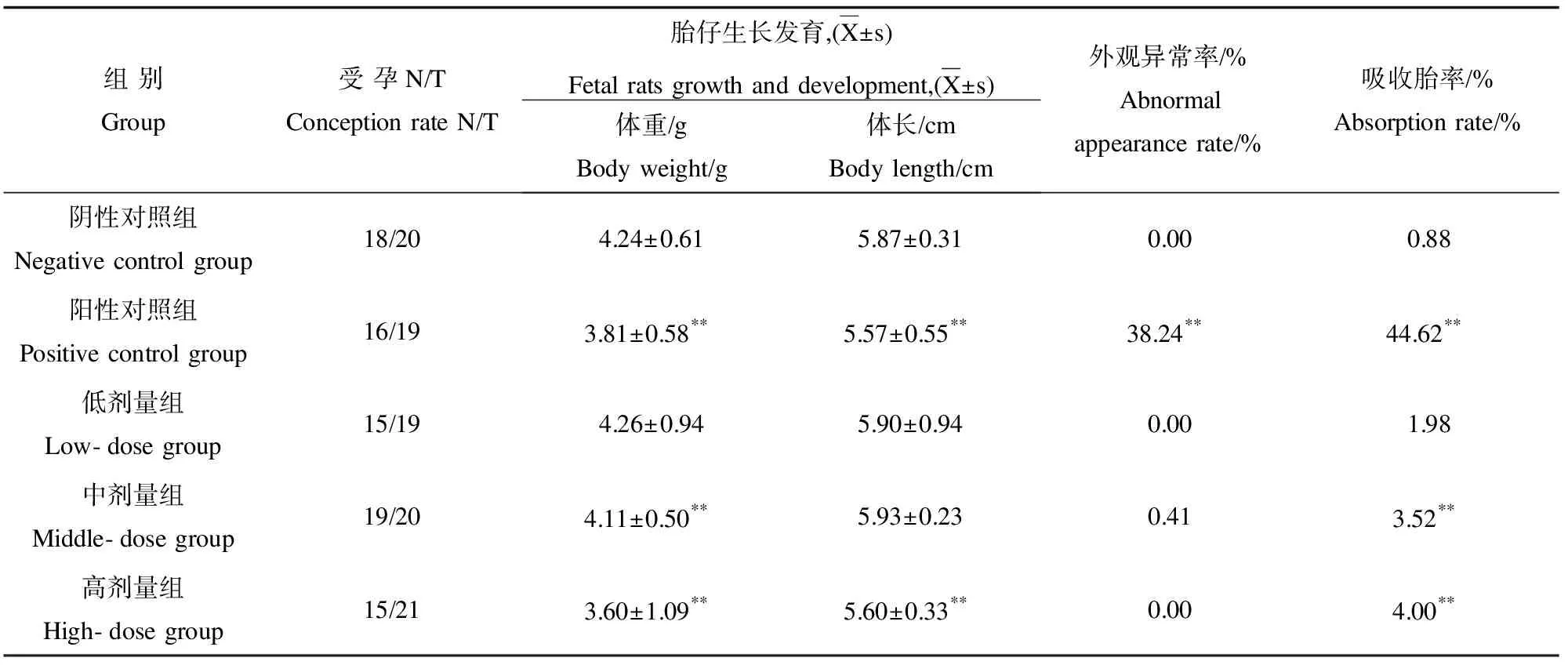
表2 吡草醚原药对胚胎发育的影响Table 2 Effects on embryo development
注:*,**分别表示与对照组比较p<0.05,p<0.01;N/T:受孕雌鼠个数/交配成功雌鼠个数。
Note: Compared with control group,*p<0.05,**p<0.01; N/T:Number of pregnant rats/Number of copulated rats.
2.3 对胎鼠内脏和骨骼发育的影响
中剂量组和阳性对照组胎鼠内脏畸形主要表现在脑室发育不全及异常,与阴性对照组比较,差异有显著性(p<0.01);胎鼠骨骼畸形检查时,阳性对照组和吡草醚原药中、高剂量组胎鼠骨骼畸形主要表现为头顶间骨及后头骨例数异常、胸骨缺失及钙化不全,例数与阴性对照组比较,差异有显著性(p<0.01),结果见表3。
3 讨论(Discussion)
目前市场上除草剂种类繁多,化学除草剂多数是长残留型,它们在土壤中的残留期一般可达36个月以上,从而使土壤、地下水、空气均受到污染。这些影响最终将不同程度地危害人类生存的环境。有文献报道,除草剂残留中毒造成一牧业发展有限公司怀孕母羊流产,死亡等,蒙受经济损失。同时除草剂残留污染环境和食品对人类健康会造成严重的影响,严重者可致肿瘤、孕妇流产、女性不孕等疾病[11-12]。所以对新型除草剂致畸作用的研究,对于新型农药的管理及其引起疾病的预防是有重要意义的。
本试验阳性对照组为维生素A,可导致雌鼠吸收胎率升高,胎仔体重、体长降低,骨骼、内脏畸形例数升高,与对照组比较,差异有显著性(p<0.05,p<0.01),有明显的致畸作用,证明本实验体系有效。受试物吡草醚原药可引起中、高剂量组雌鼠的吸收胎率(分别为3.53%和4.00%)升高,可推断在高于或等于中剂量(92.80 mg·(kg·d)-1)的染毒水平下,胚胎在子宫内存活及发育将明显受到影响;在高剂量(464.00 mg·(kg·d)-1)染毒水平下,雌鼠体重增长于妊娠第15天(胚胎硬腭闭合期)及以后较阴性对照组明显降低,同时,中、高剂量组胎仔体重明显降低,满足剂量-反应关系,具有一定毒理学意义。胚胎硬腭闭合期是胚胎整体发育最快速阶段[10],提示临近硬腭闭合期时,中、高剂量组胚胎于子宫内发育速度受影响;另一方面,在高于或等于中剂量(92.80 mg·(kg·d)-1)染毒水平下,吡草醚可造成胚胎-胎仔的内脏发育、骨骼钙化不全,但仅有中剂量组表现出胎仔内脏畸形例数升高,低、高剂量组无明显异常,不满足剂量-反应关系,故认为没有毒理学意义;低、中、高剂量组的头骨异常比例分别为3.23%、16.95%、16.30%;胸骨异常比例分别为7.53%、22.03%、33.70%,呈明显的剂量-反应关系。有研究表明大鼠骨骼的重要发育阶段为妊娠中期,且与骨化生长有关的因子的高表达时间为E11~E14[13],但吡草醚是否主要影响大鼠妊娠中期的骨骼发育,还需要进一步的试验证明。
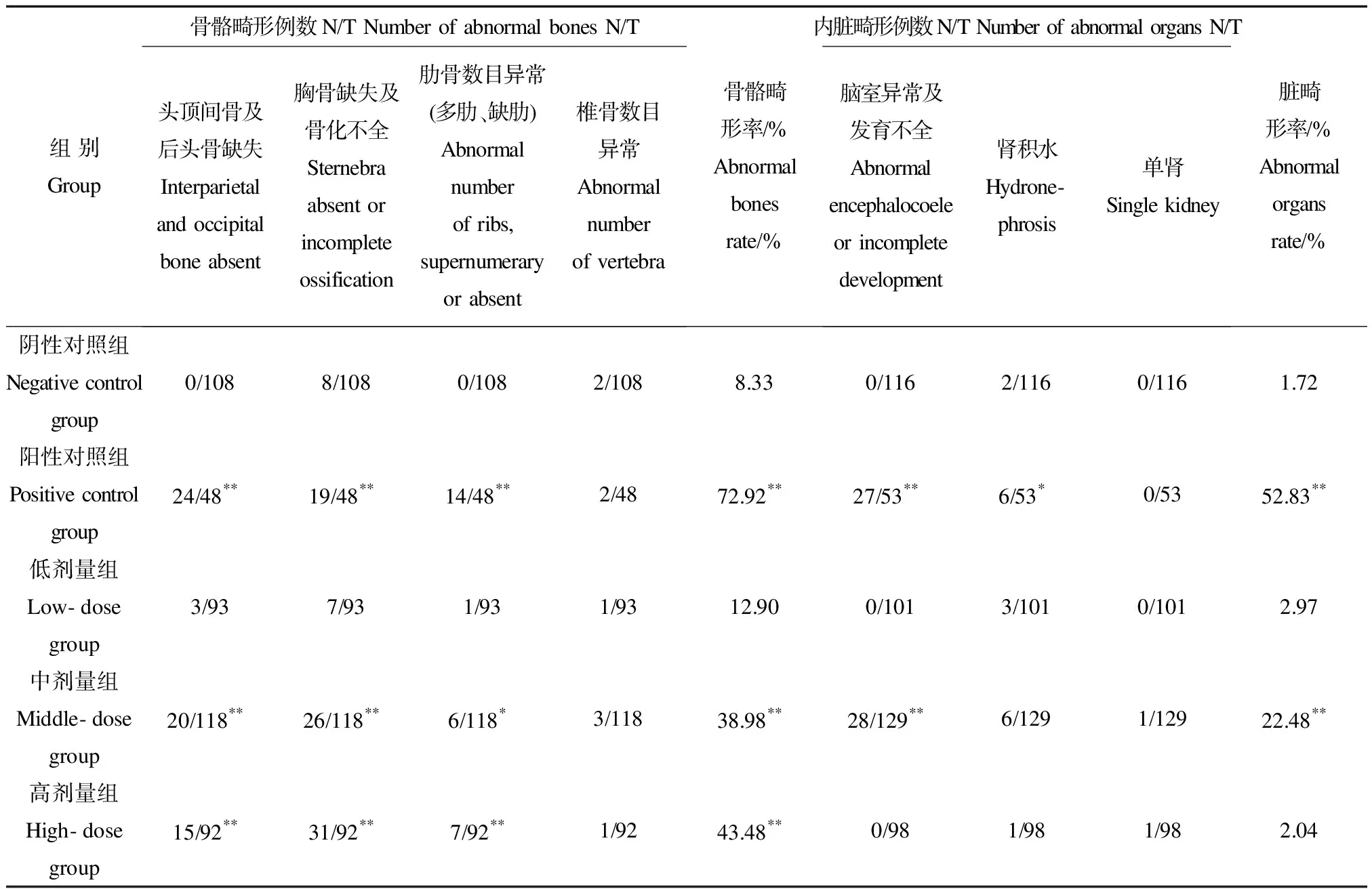
表3 吡草醚对胎鼠骨骼和内脏发育的影响Table 3 Effects on bones and organs development of embryo
注:*,**分别表示与对照组比较p<0.05,p<0.01;N/T:各项指标的活胎数/该组活胎总数。
Note: Compared with control group,*p<0.05,**p<0.01; N/T:number of lived fetus within index/total number of lived rats within group.
根据本试验结果,吡草醚原药大鼠致畸试验未观察到有害作用剂量为18.56 mg·(kg·d)-1,最小致畸剂量为92.80 mg·(kg·d)-1。吡草醚以及相关代谢产物经环境迁徙或转移最终会进入生活环境被人群所接触,此结果可为确定该除草剂安全接触限值提供依据。
参考文献:
[1] 陈占荣, 秦建华, 汪金源, 等. 霸草灵防除麦田阔叶杂草的效果[J]. 杂草科学, 2001, ( 3): 15-17
Chen Z R, Qin J H, Wang J Y, et al. Effectiveness of pyraflufen-ethyl for control of broad leaf weedsin wheat fields [J]. Weed Sciences, 2001, (3): 15-17 (in Chinese)
[2] 刘慧君, 乔五忠, 冯秀斌. 吡草醚水解动力学的研究[J]. 环境科学导刊, 2009, 28(2): 4-7
[3] 杨国璋. 麦田用除草剂吡草醚(pyraflufen-ethy)[J]. 世界农药, 2011, 33(6): 55-56
[4] Wang H L, Li J Z, Hu J Y. Pyraflufen-ethyl residues in soil by solid phase extraction andhigh-performance liquid chromatography with UV detection [J]. Analytic science, 2006, 22(12): 1589-1592 (in Chinese)
[5] 冯建国, 赵哲伟, 张小军, 等. 环境友好型农药剂型的应用研究现状[C]. 中国化工学会农药专业委员会第十五届年会论文集, 2012: 57-60
[6] 张一宾. 以吡草醚和哒螨灵为例看欧-美对环境和水生生物的风险评价[J].世界农药, 2007, 29(5): 28-34
[7] 王彦华, 俞卫华, 杨立之, 等. 22种常用除草剂对蚯蚓(Eiseniafetida)的急性毒性 [J]. 生态毒理学报, 2012, 7(3): 317-325
Wang Y H, Yu W H, Yang L Z, et al. Acute toxicity of twenty-two commonly used herbicides to earthworm (Eiseniafetida) [J]. Asian Journal of Ecotoxicology, 2012, 7(3): 317-325 (in Chinese)
[8] Wang Y, Wu S, Chen L, et al. Toxicity assessment of 45 pesticides to the epigeic earthwormEiseniafetida[J]. Chemosphere, 2012, 88(4): 484-491
[9] 国家技术监督局.GB15670-1995农药登记毒理学试验方法 [S]. 北京:中国标准出版社,1996
[10] Liberati T A, Roe B J, Feuston M H. An oral (gavage) control embryo-fetal development study in the Wistar Hannover rat [J]. Drug and Chemical Toxicology, 2002, 25(1): 109-130
[11] 张辉, 唐国强. 除草剂产生危害的原因及其防控措施[J]. 现代农业科技, 2011, (17): 174-175
[12] 沈大忠. 除草剂的危害及预防措施 [J]. 农技服务, 2011, 28(12): 1688-1689
[13] 冉黎, 张全波, 陆长青, 等. 大鼠胚胎胸椎发育中转化生长因子β1、骨形成蛋白2和Smad4的表达及意义 [J] . 解剖学杂志, 2008, 31(2): 197-200
Ran L, Zhang Q B, Lu C Q, et al. Expression of TGF-β1, BMP-2 and Smad4 in the development of the thoracic vertebrae of rat embryo and its significance [J]. Chinese Journal of Anatomy, 2008, 31(2): 197-200 (in Chinese)
