水质监测多参数的标定研究
2014-03-21闫云浩
陈 岩,闫云浩,谭 婷,郭 宏
(1.北京工商大学计算机与信息工程学院,北京 100048;2.昆山诺金传感技术有限公司,江苏昆山 215300)
0 引言
传统的水质监测方法主要有2种:一种是人工采样,采用手持便携式监测仪或实验室分析;另一种是在特定区域建设水质自动监测站。前者采样频率低,劳动强度大,无法实时监控,不能反映水体水质参数的连续动态变化。后者能实现水质自动监测。但存在投资成本高、建设周期长、需铺设电缆和征地建站等局限性,其覆盖水域不可能很广,无法实施多点监测[1],但是这种传统的检测方式已不能适应当前的市场需求[2]。文中通过对采集参数与溶液浓度、温度的规律的探索,提出了水质监测系统数据采集的标定方法。
1 实验部分
1.1实验原理
pH是溶液中氢离子活度的一种标度,也就是通常意义上溶液酸碱程度的衡量标准[3]。pH值越趋向于0表示溶液酸性越强,反之,越趋向于14表示溶液碱性越强,在常温下,pH=7的溶液为中性溶液。
电导率是物质传送电流的能力,是电阻率的倒数[4]。在液体中常以电导(电阻的倒数)来衡量其导电能力的大小。水的电导是衡量水质的一个很重要的指标。根据水溶液中电解质的浓度不同,则溶液导电的程度也不同[5]。通过测定溶液的导电度来分析电解质在溶解中的溶解度。
溶解氧是指溶解在水或液体中的分子态氧,通常记作DO,用每升水里氧气的毫克数表示[6]。水中溶解氧的多少是衡量水体自净能力的一个指标也是水中生物生存不可缺少的条件。
1.2实验仪器与试剂
主要仪器:电子天平,酸式滴定管(50 mL),250 mL烧杯(3个),称量瓶,碱式滴定管(50 mL)、容量瓶、锥形瓶、台秤。
试剂:38%浓度的浓盐酸,固体NaOH。
1.3实验步骤
1.3.1配制一定浓度的盐酸
用量筒量取VmL的浓盐酸(38%),然后注入事先盛少量蒸馏水的烧杯中,然后将其稀释到NmL,稀释后转入足够大的容量瓶中定容。将所配溶液转入洁净的试剂瓶中,用玻璃瓶塞塞住瓶口,摇匀,贴好标签,待标定。
1.3.2配制一定浓度的NaOH溶液
称Mg氢氧化钠放在烧杯中,加入PmL蒸馏水溶解,然后倒入足够大的容量瓶里,分3次洗烧杯,将溶液全部倒入容量瓶里,最后用水稀释至刻度线,摇匀,即得到所需浓度的氢氧化钠溶液。表1给出配制溶液的容量及其各种所需的浓度。

表1 配制溶液的容量及其各种所需的浓度
2 实验结果与分析
2.1盐酸浓度与pH值的关系
从实验数据可以得出pH值和盐酸浓度近似呈线性关系,在pH<4时,盐酸浓度随着pH值的增大而线性减小,当pH>4时,盐酸浓度的微小变化引起pH的变化比较大。表2给出盐酸浓度以及对应的pH值。
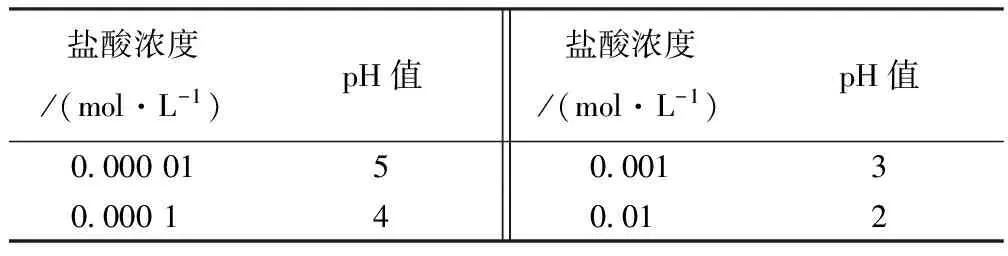
表2 盐酸浓度以及对应的pH值
2.2NaOH浓度与pH值的关系
pH值与NaOH浓度近似呈线性关系,在pH<11时,NaOH溶液的浓度发生微小变化就引起pH值的较大变化,当pH>11时,NaOH浓度随着pH值的增大而线性增加。表3给出NaOH浓度以及对应的pH值[8]。

表3 NaOH浓度以及对应的pH值
2.3溶液的酸碱度与温度的关系
溶液的pH值不仅与浓度有关,而且也与温度有关,通过实验可知,当溶液的pH值特别小的时候,温度影响特别小,当pH酸性稍微强一点的时候,pH值会随着温度的增大而增大,当溶液属于碱性的时候,pH值会随着温度的增大而线性减小。表4为溶液的pH随着温度的变化规律。
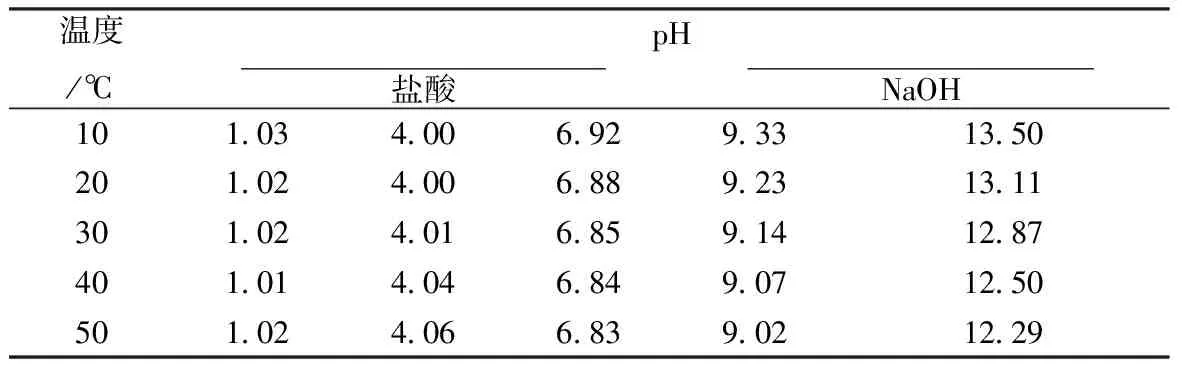
表4 溶液的pH随着温度的变化规律
根据实验数据得出溶液的pH随着温度的变化规律,当溶液处于强酸时,pH值随着温度的升高而变小,在20~40 ℃左右时,pH值变化基本处于不变。当溶液处于中度强酸时,pH值随着温度的升高而变大。当溶液处于中性和碱性时,pH值随着温度的变化升高而线性变小。通过计算得出,pH值随着温度变化的平均相对误差为2.0%。
2.4NaOH溶液的浓度与电导率的关系
NaOH溶液浓度与电导率存在一定的关系,由实验数据所得,溶液的浓度越大,则溶液的电导率就越大,并且溶液的浓度和电导率存在线性关系[9]。如表5给出NaOH溶液浓度和电导率的关系数据。
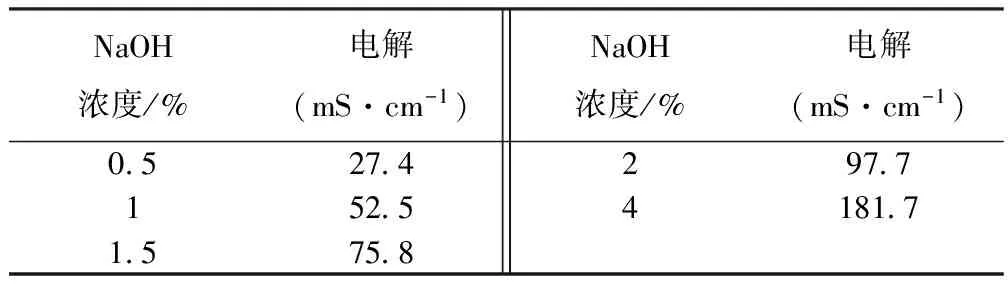
表5 NaOH溶液浓度和电导率(mS/cm)的关系
2.5NaOH溶液的电导率与温度的关系
NaOH溶液的电导率随着温度的升高会有所下降,当NaOH溶液的浓度比较小时,温度对NaOH溶液的电导率影响比较小,当NaOH溶液浓度比较大时,对溶液的电导率影响比较大[10]通过实验数据可得,溶液在相同温度下,在不同浓度下,电导率的相对误差是线性下降的[11]。如表6给出NaOH溶液浓度和温度的关系数据。
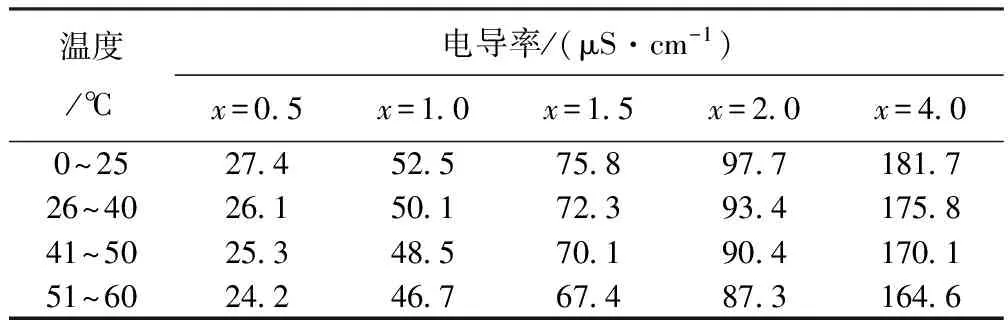
表6 NaOH浓度、温度以及电导率(μS/cm)的关系
注:x为NaOH浓度,%。
根据实验数据得出随着NaOH溶液浓度的增加,电导率的相对误差随之减小,通过对表中数据的计算,电导率随着温度变化的平均相对误差为4.3%。
2.6水的溶解氧与温度的关系
由实验数据可得,水的溶解氧在0 ℃是最大的,通过对多组数据进行实验,发现水的溶解氧是随着温度线性减小的[12]。如表7给出水的溶解氧与温度关系。

表7 水的溶解氧(mg/L)与温度(℃)的关系
根据表中数据得出,溶解氧随着温度变化的平均相对误差为9.6%。
3 结论
该研究对pH值、电导率、溶解氧等参数进行了大量现场测试和标定,保证了数据的准确性。试验结果表明:研究中同时考虑浓度和温度对参数标定的影响,大幅度提高了标定性能的稳定和误差的准确性。
参考文献:
[1]谷春英,姚青山.基于无线传感器网络水质监测系统仿真设计.计算机仿真,2013,30(5):340-343.
[2]AILAMAKI A,FALOUTSOS C,VANBRIESEN J,et al. An environmental sensor network to determine drinking water quality and security.SCM SIGMOD Record,2003,32(4):47-52.
[3]徐艳伟,杜晓旭,齐云霞,等.温度对牛奶pH值影响的研究.轻工科技,2013(3):21-51.
[4]杨书娟.生产过程中乳化液电导率和PH值变化情况分析.南方金属,2013(3):40-43.
[5]李颖慧,邓小蕾,孙红.基于无线传感器网络的温室栽培营养液电导率监测系统.农业工程学报,2013,29(9):170-177.
[6]倪霞.影响水中溶解氧测定的几个重要因素.农技服务,2013(1):71-75.
[7]刘彬,张缓缓,金庆辉,等.溶解氧的测定.化学传感器,2011,31(4):39-43.
[8]陈华凌,陈岁生,张仁政.基于Zigbee无线传感器网络的水环境监测系统.仪表技术与传感器,2012(1):71-73.
[9]朱亚明,丁为民.一种在线检测溶解氧的方法.电子测量技术,2009,32(7):122-124.
[10]丁凡,周永明.基于Zigbee的多路温度数据无线采集系统设计.仪表技术与传感器,2013(8):72-78.
[11]CHENG K L,ZHU D M.On Calibration of pH meters,sensors,2005(5):,209-219.
