太平洋牡蛎(Crassostrea gigas)担轮幼虫的超低温保存研究*
2014-03-19韩龙江刘清华纪利芹温海深张国范
韩龙江 刘清华 纪利芹 温海深① 黄 雯 张国范 李 军①
(1. 中国科学院海洋研究所 青岛 266071; 2. 中国海洋大学水产学院 青岛 266003; 3. 中国科学院大学 北京 100049)
自Ploges(1949)发现甘油在细胞低温保存中有抗冻作用后, 生物细胞和组织的低温冷冻保存研究迅速展开, 形成了一门新兴学科—低温生物学(cryobiology)。低温生物学主要是研究在超低温(-196°C)条件下生物的形态结构、生理生化等生命现象的变化规律以及细胞、组织、器官乃至整个生物体活性保存的一门边缘学科, 其在贝类配子和胚胎冷冻保存中应用较为广泛。有关海产贝类精子的低温冷冻保存, 自20世纪70年代初就有报道, 目前在牡蛎、鲍鱼等经济贝类上已有陆续开展, 其中在一些海产贝类的精子保存中取得了比较好的效果, 如Smith等(2001)研究了长牡蛎(Crassostrea gigas)的精子、卵和胚胎的低温冷冻保存。Yang等(2012)在弗吉尼亚牡蛎(Crassostrea virginica)精子冷冻中发现, 以无钙Hank’s液作为稀释液时, 10%的DMSO(二甲基亚砜)和PG(丙二醇)对精子冷冻保存效果最好。Adams等(2004)发现添加有0.45mol/L海藻糖的DMSO对太平洋牡蛎精液冷冻效果较好。从20世纪90年代开始,我国学者对重要海水养殖贝类, 如太平洋牡蛎(Crassostrea gigas) (李赟等, 2002)、香港牡蛎(Crassostreahongkongensis) (丁兆坤等, 2013)、栉孔扇贝(Chlamys Farreri) (李纯等, 2000)、九孔鲍(Haliotis diversicolor)(蔡明夷等, 2008)等进行了精子超低温保存研究, 先后建立了10多种海洋贝类的精子冷冻保存技术, 将冷冻精子技术进行了推广和应用, 对冻精生理活性、结构及功能、遗传稳定性等方面进行了初步探讨(李赟等, 2002)。过去20多年贝类精子超低温保存研究工作的积累, 为今后太平洋牡蛎胚胎冷冻保存技术的建立和应用以及低温损伤机理的系统研究奠定了良好的科研基础(张岩等, 2004)。贝类胚胎的保存特别是对于牡蛎早期幼虫的超低温保存技术的研究已有二十多年的历史, 如Renard(1991)、Chao等(1994,1997)率先开展了对牡蛎胚胎的冷冻保存研究。随后Gwo(1995)、Smith等(2001)、Paniagua等(2001)、Choi等(2003)等陆续开展了超低温保存牡蛎幼虫的相关研究, 并取得了较好的效果。
贝类配子、胚胎是海水养殖生产、优良品种培育、及海洋渔业可持续发展的重要物质基础, 随着海水养殖业的快速发展, 贝类种质保护严重滞后的负面效应越来越严重。忽视贝类种质保护及品种选育工作会造成贝类种质退化、生长速度减缓、对病害和环境胁迫的防御能力降低, 从而导致巨大的经济损失, 因此优良贝类种质保存已成为我国海水养殖业中亟待攻克的重要问题。开展贝类种质的超低温冷冻保存技术的研究、建立健全我国贝类种质库对于维持我国贝类种质资源的稳定、保护贝类遗传多样性、开展贝类遗传改良和生物技术育种都具有重要的意义(孙振兴等, 2005; 于海涛, 2004)。本实验测定了不同浓度抗冻保护剂对太平洋牡蛎担轮幼虫的毒性作用及其冷冻保存的影响, 采用程序降温仪来严格控制降温速率;借助计算机辅助分析系统采集图像视频, 测定了不同抗冻保护剂在三种浓度下对太平洋牡蛎担轮幼虫的毒性并筛选出了一种太平洋牡蛎担轮幼虫的冷冻保存方法, 结果可靠稳定, 对贝类种质保存具有重要的借鉴作用。
1 材料与方法
1.1 太平洋牡蛎担轮幼虫的采集
实验所用的太平洋牡蛎于性成熟季节(2013年7月)购自青岛崂东海珍品良种培育有限公司, 壳高9.0—11.2cm, 壳宽5.5—6.0cm, 数量120只。暂养于中国科学院海洋研究所海洋贝类增养殖与生物技术实验室100L水族箱内, 暂养期间水温16—18°C, 每天换水一次。实验时选择性腺饱满的牡蛎, 解剖后取精液与卵子, 按精卵比80∶1混合于20°C过滤海水(混合前卵子在过滤海水中活化30min, 精液在过滤海水中活化5min), 2h后取受精卵(100个以上)统计受精率, 然后转移进50L塑料桶继续培养, 混合14h后统计孵化率。显微镜观察大约14h后太平洋牡蛎胚胎进入担轮幼虫期, 开始实验。
1.2 实验方法
将发育到担轮期的太平洋牡蛎幼虫用200目的筛绢过滤浓缩, 装入50mL的离心管中备用, 选取6种不同的抗冻保护剂PG(丙二醇)、DMSO(二甲基亚砜)、EG(乙二醇)、GLY(甘油)、MeOH(甲醇)、DMA(二甲基乙酰胺)与混有浓缩过太平洋牡蛎担轮幼虫的天然海水配成三个不同的浓度(5%、10%、15%), 置于4°C冰箱预冷20min后检测太平洋牡蛎担轮幼虫活力作为抗冻保护剂毒性实验指标; 将不同浓度抗冻保护剂中的太平洋牡蛎担轮幼虫吸入0.25mL的麦管中(法国IMV卡苏公司), 封口粉封口后置于4°C冰箱中平衡20min, 待抗冻保护剂充分渗入担轮幼虫体内后立即放入程序降温仪中(型号Kryo-360-1.7), 采用分步降温程序降温: -1°C/min的降温速率从0°C降至-15°C, 平衡5min后再以-3°C/min的降温速率降至-40°C, 平衡2min, 以-15°C/min降至-80°C后以-20°C/min降至-180°C后直接投入液氮中保存。每一实验组设三个平行, 实验重复三次。
1.3 太平洋牡蛎担轮幼虫活力测定
抗冻保护剂毒性实验中太平洋牡蛎担轮幼虫活力的测定: 用移液枪吸取100μL的海水于干净载玻片上, 吸取5μL担轮幼虫加入其中, 混匀, 显微镜检测活力, 采用计算机辅助精子分析(computer-assisted sperm analysis, CASA)系统随机取三个视野采集太平洋牡蛎担轮幼虫运动状态的视频文件, 统计运动率。
超低温保存实验中太平洋牡蛎担轮幼虫活力的测定: 太平洋牡蛎担轮幼虫在液氮中保存2周后取出,将存有太平洋牡蛎担轮幼虫的麦管直接放入28°C水浴中解冻5—10s, 观察到麦管内液体呈透明状后立即取出, 用剪刀剪开两端待里面的液体完全流到载玻片上, 置于显微镜下观察, 采用CASA系统随机取三个视野采集太平洋牡蛎担轮幼虫运动状态的视频文件, 统计运动率。
1.4 数据处理
统计所得的数据采用SPSS17.0软件进行单因素方差分析(ANOVA)并采用Duncan氏进行多重范围比较分析,P<0.05表示显著差异, 所有结果均以平均值±标准差表示。
2 结果
2.1 不同浓度及种类的抗冻保护剂对太平洋牡蛎担轮幼虫的毒性作用
不同浓度及种类的抗冻保护剂对太平洋牡蛎担轮幼虫毒性作用见图1。当抗冻保护剂浓度为5%(v/v)时, GLY、DMSO、PG和EG四组抗冻保护剂中担轮幼虫的运动率均在93%以上(94.50%±1.32%、93.17%±0.76%、93.00%±1.00%), 且差异不显著(P>0.05), 但均显著高于DMA组89.50%±2.50%(P>0.05), 说明这四种抗冻保护剂对太平洋牡蛎担轮幼虫的毒性较小; MeOH组运动率最低, 仅为83.50%±1.50%, 显著低于其他抗冻保护剂种类(P<0.05), 毒性作用最强。当抗冻保护剂浓度10%(v/v)时, GLY、DMSO、EG和MeOH运动率分别达到89.67%±2.52%、80.33%±5.51%、86.5%±0.50%、80.00%±2.00%, 各组之间差异不显著(P>0.05), 说明10%浓度下GLY、DMSO、EG和MeOH对太平洋牡蛎担轮幼虫的毒性较小; 其次为PG组, 运动率达到68.33%±16.04%, 显著高于DMA组33.17%±5.62%,(P<0.05), 但与DMSO、MeOH组差异不显著。当抗冻保护剂浓度15%(v/v)时, GLY对太平洋牡蛎担轮幼虫的毒性较小, 运动率达到77.00%±2.00%, 与DMSO组73.67%±1.53%差异不显著(P>0.05), EG组次之, 运动率达到76.67%±3.51%, 与PG组32.13%±2.60%、MeOH组27.93%±2.32%差异不显著(P>0.05),而DMA组在该浓度下, 没有担轮幼虫存活。

图1 抗冻保护剂浓度及种类对太平洋牡蛎担轮幼虫的毒性作用Fig.1 The effect of different antifreeze protectants and concentration on trochophore larvae of Crassostrea gigas
由图1可以看出, 同一种抗冻保护剂随着其浓度上升, 对太平洋牡蛎担轮幼虫的毒性逐渐增大。六种不同的抗冻保护剂在5%(v/v)浓度时, 对担轮幼虫的毒性作用最小, 与10%、15%(v/v)浓度差异显著(P<0.05)。GLY、EG、DMA、MeOH在10%浓度下的担轮幼虫运动率与其在15%浓度下差异显著(P<0.05), 而DMSO、PG在这两种浓度条件下差异不显著(P>0.05)。
2.2 抗冻保护剂浓度及种类对太平洋牡蛎担轮幼虫超低温保存的影响
不同的抗冻保护剂浓度及种类对太平洋牡蛎担轮幼虫超低温保存的影响见图2。当抗冻保护剂浓度为5%时, GLY、DMSO、PG、EG、DMA、MeOH组解冻后担轮幼虫的运动率分别达到59.67%±4.51%、32.33%±4.16%、13.33%±4.51%、24.33%±2.52%、3.67%±2.08%、0%, 且各组间差异显著(P<0.05)。当抗冻保护剂浓度为10%时, DMSO组担轮幼虫解冻后的运动率达到最高值73.00%±2.00%, 显著高于与其他抗冻保护剂中的担轮幼虫的运动率(P<0.05); GLY组次之, 解冻后担轮幼虫运动率达到56.00%±5.29%,显著高于PG、EG组解冻后担轮幼虫运动率(P<0.05);PG组解冻后担轮幼虫运动率21.33%±4.51%与EG组解冻后担轮幼虫运动率25.33%±3.51%差异不显著(P>0.05)。当抗冻保护剂浓度为15%时, GLY、DMSO、PG、EG组解冻后担轮幼虫的运动率分别达到62.33%±2.52%、12.23%±1.17%、9.3%±1.67%、25.17%±1.76%, 且各组间差异显著(P<0.05); DMA、MeOH组解冻后没有担轮幼虫存活。

图2 抗冻保护剂浓度及种类对太平洋牡蛎担轮幼虫冷冻保存的影响Fig.2 The effect of different antifreeze protectants and concentration on trochophore larvae cryopreservation of Crassostrea gigas
由图2可以看出, 当抗冻保护剂为GLY时, 5%、10%、15%浓度下担轮幼虫解冻后运动率较高, 分别为59.67%±4.51%、56.00%±5.29%、62.33%±2.52%, 各浓度间差异不显著(P>0.05), 当抗冻保护剂为DMSO、PG、EG时, 随着抗冻保护剂浓度的上升, 对太平洋牡蛎担轮幼虫冷冻解冻后的运动率呈现先上升后下降趋势。其中DMSO组三种不同浓度条件下担轮幼虫解冻后的运动率差异显著(P<0.05), 10%浓度下解冻后运动率达到最大值73.00%±2.00%, 显著高于其5%浓度下32.33%±4.16%、10%浓度下12.23%±1.17%的解冻后运动率(P<0.05)。PG组在10%浓度下解冻后担轮幼虫运动率达到最大值21.33%±4.51%, 显著高于其5%浓度下和10%浓度下担轮幼虫解冻后运动率(P<0.05), 其5%浓度下运动率32.33%±4.16%和15%浓度下运动率12.23%±1.17%差异不显著(P>0.05)。EG组在5%、10%、15%浓度下担轮幼虫解冻后运动率差异不显著(P>0.05), 分别为24.33%±2.52%、25.33%±3.51%、25.17%±1.76%。总之, 在不同抗冻保护剂及不同浓度下, 10%DMSO作为抗冻保护剂对太平洋牡蛎担轮幼虫的保护作用最好, GLY次之。
2.3 太平洋牡蛎担轮幼虫超低温保存方法的筛选
不同抗冻保护剂在其最优浓度下对太平洋牡蛎担轮幼虫解冻后运动率的影响见图3。DMSO在10%浓度下解冻后担轮幼虫的运动率达到最大值73.00%±2.00%, 显著高于其他各抗冻保护剂最优浓度下担轮幼虫解冻后的运动率(P<0.05); 15%GLY组次之, 解冻后运动率达到62.33%±2.52%, 显著高于10%PG、10%EG、5%DMA组解冻后担轮幼虫运动率(P<0.05); 10%PG、10%EG组解冻后担轮幼虫运动率分别达到21.33%±4.51%、25.33%±3.51%, 差异不显著(P>0.05); 5%DMA组解冻后担轮幼虫运动率为3.67%±2.08%, 显著低于其他实验组(P<0.05)。
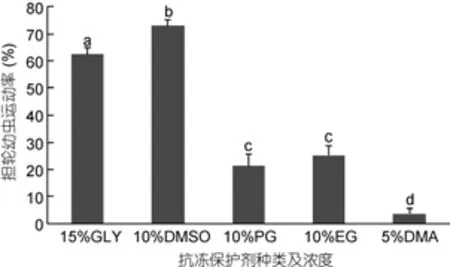
图3 抗冻保护剂种类浓度对太平洋牡蛎精液保存效果的影响Fig.3 The effect of different antifreeze protectants and concentration on trochophore larvae cryopreservation of Crassostrea gigas
3 讨论
3.1 抗冻保护剂种类和浓度对太平洋牡蛎担轮幼虫的毒性作用
抗冻保护剂多为渗透性的小分子物质, 主要通过渗入细胞内部, 发生水合作用, 使细胞内溶液的黏性增加, 从而保护细胞不受冷冻损伤。不同的抗冻保护剂由于其种类、浓度、分子大小、渗透能力、水活性及胞内作用机理等各不相同, 对细胞冷冻保存效果亦有差异。随着抗冻液浓度的增加, 渗入细胞内的抗冻保护剂随之增多, 由于抗冻液本身具有毒性, 浓度太高会在降温前杀死细胞, 而浓度过低又起不到对细胞的保护作用, 所以冷冻保护剂应该选择无毒性或者毒性低、易渗透进细胞膜、并能很好地与细胞液或与水分子结合的物质(Smithet al, 2001)。贝类配子和胚胎保存中常用的抗冻保护剂有GLY、DMSO、PG、EG、MeOH、MDA等, 虽然抗冻保护剂是牡蛎幼虫冷冻过程中必不可少的, 但其毒性可能会导致幼虫在预处理和解冻后死亡。例如, Chao等(1994)在验证DMSO、EG、PG对牡蛎胚胎的毒性时发现, 早期胚胎更容易受高浓度(4—5mol/L)抗冻保护剂的影响, 添加海藻糖或葡萄糖能够显著降低抗冻保护剂对牡蛎幼虫的毒性; Nascimento等(2005)发现,DMSO、MeOH对牡蛎幼虫在平衡10—30min时的毒性无显著差异, 而PG对牡蛎幼虫平衡时间越长, 毒性作用越大。本实验采用不同浓度的不同抗冻保护剂,对太平洋牡蛎担轮幼虫进行抗冻保护剂毒性实验证明, 不同抗冻保护剂对太平洋牡蛎担轮幼虫的毒性作用不同。在相同平衡时间(20min)条件下, 太平洋牡蛎担轮幼虫毒性实验说明: 随着抗冻保护剂浓度的升高, 其对太平洋牡蛎担轮幼虫的毒性呈现逐渐增大趋势; 在较低的5%浓度下, GLY、DMSO、PG、EG对太平洋牡蛎的毒性作用最小; 在10%浓度下,GLY、DMSO、EG、MeOH对太平洋牡蛎担轮幼虫的毒性作用较小; 而在15%较高浓度下, GLY、DMSO对太平洋牡蛎担轮幼虫的毒性作用最小。综合分析可知, GLY、DMSO在太平洋牡蛎担轮幼虫冷冻保存中的效果最好, 这是由于GLY具有良好吸水性并能自由通过细胞膜, 有利于保持细胞水分、稳定渗透压,在海水中添加一定量的GLY会使海水的黏性增强、热传导加快、可调节细胞脱水并保护蛋白结构, 而且在高浓度下可以诱发膜融合。DMSO作为抗冻保护剂,具有渗透速度快、分布均匀、毒性低、且可以通过抑制过氧化氢酶的活性达到降低冷冻损伤的效果。而PG的抗冻保护作用是通过降低水相的极性从而改变细胞膜和水相之间的疏水性分子的分区, 可能会导致脱磷脂双分子层破坏从而降低抗冻效果。MeOH、DMA对细胞膜具有高度渗透性, 因此其毒性较大,高浓度下其冷冻效果较差。综上所述, GLY、DMSO在不同浓度下的抗冻效果整体高于其他抗冻保护剂,但在较高浓度下使用时其对配子、细胞的毒性作用也可能会超过其抗冻保护作用。因此, 在慢速降温冷冻保存太平洋牡蛎担轮幼虫时, 抗冻保护剂的浓度一般不应大于15%。
3.2 太平洋牡蛎担轮幼虫的超低温保存
渗透性抗冻保护剂通过渗透进入细胞内部, 增加细胞质的粘滞度从而降低冰点达到对细胞的保护作用。抗冻保护剂由于其种类和浓度不同, 对细胞的保护亦有所差异: 例如Renard等(1991)发现无抗冻保护剂冷冻保存牡蛎胚胎, 冷冻保存效果差; 当用0.5mol/L MeOH+0.5mol/L蔗糖作为抗冻保护剂, 有近一半的牡蛎胚胎存活。胚胎发育的不同时期, 对冷冻效果有显著影响(王鹏飞等, 2008)。Gwo等(1995)发现, 太平洋牡蛎担轮幼虫期较2-8细胞期及原肠胚期冷冻保存效果好, 当抗冻保护剂为10%PG时, 太平洋牡蛎胚胎的冷冻保存效果最好。Chao等(1997)发现, 采用慢速降温法冷冻保存牡蛎、文蛤的胚胎和初孵幼虫, 当抗冻保护剂为2mol/L DMSO+0.06mol/L海藻糖时, 可以获得较高的成活率。Paniagua等(2001)发现, 在-2.5°C/min的慢速降温速率下冷冻保存美国东部牡蛎(Crassostrea virginica)担轮幼虫, 10%、15%浓度的PG有较好的保存效果。Choi等(2003)发现, 采用0.2mol/L的葡萄糖或蔗糖, 以-1°C/min的慢速降温速率冷冻保存D形幼虫, 保存效果最好。在了解冻存过程中细胞渗透压的特性、细胞内冰晶形成的特点、以及胚胎对抗冻保护剂毒性耐受等理论的基础上,本研究设计了太平洋牡蛎担轮幼虫超低温冷冻保存实验并在上述实验基础上优化了传统的牡蛎胚胎两步冷冻保存冷冻方法。结果表明: 冻存的太平洋牡蛎担轮幼虫的运动率随着抗冻保护剂浓度的上升呈现先上升后下降的趋势, 低浓度的抗冻保护剂由于其渗透保护作用差, 解冻后担轮幼虫的运动率低; 随着抗冻保护剂浓度的升高, 担轮幼虫的运动率有增大趋势; 但在较高浓度下, 抗冻保护剂毒性随之增大,担轮幼虫的运动率降低。由于抗冻保护剂对太平洋牡蛎担轮幼虫冷冻保存的作用具有两面性, 需要筛选出一个适宜浓度, 既能起到良好的抗冻保护作用, 又不会导致幼虫细胞的损伤(Brocket al, 2001)。结果显示, 浓度为10%的DMSO对太平洋牡蛎担轮幼虫的冷冻保护作用最好。太平洋牡蛎在胚胎后期担轮幼虫阶段(18°C水温条件下, 受精后12h)以10%(v/v)DMSO作为抗冻保护剂, 采用分步降温程序降温(-1°C/min的降温速率从0°C降至-15°C, 平衡5min后再以-3°C/min的降温速率降至-40°C, 平衡2min,以-15°C/min降至-80°C后以-20°C/min降至-180°C)后直接投入液氮中保存, 然后将胚胎置于28°C水浴解冻后放入海水中, 计算机精子辅助分析(CASA)测得平均运动率达73.00%±2.00%, 运动率较高, 证明10%DMSO作为冷冻保护剂其毒性低、易渗透进细胞膜、并能很好地与细胞液结合保护胚胎不受损伤。改进后的慢速分步降温法, 既能使牡蛎幼虫细胞较快地度过结晶危险区(0—-40°C), 又不会使幼虫细胞造成较大损害。本实验中抗冻保护剂及慢速分步降温方法的筛选, 为进一步提高牡蛎胚胎冻存的质量提供了理论依据。目前贝类精子冷冻保存技术研究开展的较多, 并达到了可应用的效果, 但是有关贝类担轮幼虫的冷冻保存技术研究在国内还较为少见。该研究在贝类遗传育种和生物技术等方面有一定的应用前景, 具有较高的参考价值。
丁兆坤, 朱豪磊, 杨春玲等, 2013. 不同稀释液对香港牡蛎精子冷冻的保存效果. 水生态学杂志, 34(3): 67—74
于海涛, 2004. 海洋动物精子和胚胎的超低温保存研究. 青岛:中国海洋大学硕士学位论文, 78—92
王鹏飞, 王梅芳, 余祥勇等, 2008. 马氏珠母贝胚胎和早期幼虫冷冻的研究. 广东海洋大学学报, 28(1): 25—28
孙振兴, 常林瑞. 2005. 贝类种质资源保护研究进展. 海洋湖沼通报, (3): 103—108
李 纯, 李 军, 薛钦昭, 2000. 栉孔扇贝精子的超低温保存研究. 海洋水产研究, 21(1): 57—62
张 岩, 陈四清, 于东祥等, 2004. 海洋贝类配子及胚胎的低温冷冻保存. 海洋水产研究, (6): 73—78
蔡明夷, 柯才焕, 王桂忠等, 2008. 九孔鲍精子短期保存技术研究. 海洋科学, 32(1): 1—5
Adams S L, Smith J F, Roberts R Det al, 2004. Cryopreservation of sperm of the Pacific oyster (Crassostrea gigas):development of a practical method for commercial spat production. Aquaculture, 242: 271—282
Brock J A, Bullis R, 2001. Disease prevention and control for gametes and embryos of fish and marine shrimp.Aquaculture, 197: 137—159
Chao N H, Chiang C P, Hsu H Wet al, 1994. Toxicity tolerance of oyster embryos to selected cryoprotectants. Aquatic living resources, 7: 99—104
Chao N H, Lin T T, Chen Y Jet al, 1997. Cryopreservation of late embryos and early larvae in the oyster and hard clam.Aquaculture, 155: 31—44
Choi Y H, Chang Y J, 2003. The influence of cooling rate,developmental stage, and the addition of sugar on the cryopreservation of larvae of the pearl oysterPinctada fucata martensii. Cryobiology, 46: 190—193
Gwo J C, 1995. Cryopreservation of oyster (Crassostrea gigas)embryos. Theriogenology, 43: 1163—1174
Nascimento I A, Leite M B N L, de Araujo M M Set al, 2005.Selection of cryoprotectants based on their toxic effects on oyster gametes and embryos. Cryobiology, 51(1): 113—117
Paniagua-Chavez C G, Tiersch T R, 2001. Laboratory studies of cryopreservation of sperm and trochophore larvae of the eastern oyster. Cryobiology, 43(3): 211—223
Polge C, Smith A U, Parkes A S, 1949. Revival of spermatozoa after vitrification and dehydration at low temperatures.Nature, 164(4172): 666
Renard P, 1991. Cooling and freezing tolarances in embryos of the Pacific oyster,Crassostrea gigas: methanol and sucrose effects. Aquaculture, 92: 43—57
Smith J, Pugh P, Tervit Het al, 1999. Cryopreservation of shellfish sperm, eggs and embryos. New Zealand Society of Animal Production, 61: 31—34
Yang H P, Hu E , Rafael C U , 2012. High-throughput sperm cryopreservation of eastern oysterCrassostrea virginica.Aquaculture, 344: 223—230
