24-表油菜素内酯对浒苔(Ulva prolifera)内源植物激素及相关生理影响*
2014-03-19范美华高秀秀徐年军
胡 伟 孙 雪 范美华 高秀秀 徐年军①
(1. 宁波大学 教育部应用海洋生物技术重点实验室 宁波 315211; 2. 浙江省海洋生物工程重点实验室 宁波 315211)
浒苔(Ulva)属绿藻门、石莼目、石莼科, 是一类广温、广盐、环境适应和繁殖能力较强的绿藻, 广泛分布于世界各地。青岛的绿潮浒苔不能食用, 但在浙江沿海, 浒苔是一种有重要营养价值的食品, 深受消费者欢迎。浒苔蛋白含量为13.21%, 脂肪含量为1.04%, 谷氨酸占总氨基酸的13.80%, 亚麻酸占总脂肪酸的15.98%。浒苔多糖还具有降血脂作用, 能增加小鼠SOD活力和LPO含量, 有助于促进细胞介导免疫反应(Tenget al, 2013; Weiet al, 2014)。浒苔多糖对小鼠肿瘤表现出较强的抑制作用, 能刺激淋巴细胞增殖, 促进NO和TNF-分泌, 增加细胞的吞噬作用,从而提高小鼠免疫力(Jiaoet al, 2009)。因此, 浒苔是一种很有开发前途的海洋食品和海洋药物原料。
植物激素(Phytohormone)是植物体内合成的对植物生长发育有显著作用的微量有机物质。油菜素内酯(BRs)是一类新型植物激素, 其中24-表油菜素内酯(EBR)是用得最多、用途最广泛的一种(Ozdemiret al,2004)。研究发现其能促进DNA、RNA和蛋白的合成,提高抗氧化酶活性和光合作用, 保护植物免受生物或非生物的伤害(Sasse, 2003), 如低温胁迫、盐胁迫和虫害等(Seetaet al, 2002; Yuet al, 2002; Xiaet al, 2006)。而24-表油菜素内酯对藻类相关的研究仅有侯和胜等(1997)对单细胞藻作用的报道, 对其它海藻的研究未见报道。
本实验研究了不同浓度24-表油菜素内酯对浒苔内源植物激素、叶绿素荧光参数(Fv/Fm和ETR)、可溶性蛋白和糖含量、抗氧化酶活性和自由基清除率的影响, 旨在讨论外源24-表油菜素内酯对浒苔的生理影响, 为浒苔的生长发育调控提供支持。
1 材料与方法
1.1 材料
浒苔(Ulva prolifera)于2013年10月采于浙江省象山县黄避岙乡附近海域(121.7°E, 29.5°N)。实验前选择健康藻体, 除去杂藻, 用消毒海水冲洗干净后,在三角瓶中培养, 实验前在光照培养箱中适应1个月左右, 每3天更换一次培养基。
植物激素标准品吲哚乙酸(IAA)、赤霉素(GA)、玉米素(ZR)、反式玉米素核苷(TRZ)、异戊烯腺嘌呤核苷(iPA)、茉莉酸(JA)、异戊烯腺嘌呤(iP)以及24-表油菜素内酯(EBR)、色谱纯甲醇购自Sigma-Aldrich公司(美国), 其它药品为国产分析纯。
1.2 方法
1.2.1 24-表油菜素内酯处理和培养条件 在500 mL Provasoli培养基的三角瓶中各加入新鲜浒苔藻株3.0g, 然后分别加入适量的24-表油菜素内酯母液,使最终浓度分别为0、0.1、0.2、0.5、1.0 mg/L。光照培养箱培养, 温度20°C, 光强45μmol/(m2s), 盐度25, 光照周期(L:D)为12h:12h。每天定时摇藻2次。每天固定时间取样0.5g藻体。实验持续5天, 每组3个平行样。
1.2.2 叶绿素荧光参数的测定 用Water-PAM水样叶绿素荧光仪(Walz, Germany)进行测定。测量前先将浒苔样品暗适应15 min, 再利用叶绿素荧光仪发出的强饱和光激发, 测量不同24-表油菜素内酯处理浒苔的荧光参数: PSII最大光能转化效率(Fv/Fm)和PSII相对电子传递速率(ETR)。
1.2.3 可溶性蛋白的检测 考马斯亮蓝法测定。取0.1g新鲜浒苔, 吸干水分, 在具塞试管中加入样品及5mL考马斯亮蓝G250溶液, 混合后放置2min, 记录OD595值, 并通过标准曲线计算出蛋白质含量。可溶性蛋白的标准曲线:Y= 0.0137X-0.0145,R2=0.9990(含量范围0—100μg)。
1.2.4 可溶性糖的检测 蒽酮硫酸比色法测定。取0.1g新鲜浒苔, 用纯水定容至10 mL, 沸水浴1h, 过滤, 残渣再沸水浴2次, 每次30min, 合并滤液定容。取1mL待测液缓慢加入3mL蒽酮试剂(2.0g/L), 立即沸水浴10min, 然后冷却至室温, 测OD620值, 通过标准曲线计算可溶性糖含量。葡萄糖标准曲线:Y=0.0359X–0.0058,R2=0.9976 (含量范围0—80μg)。
1.2.5 抗氧化酶活性测定 超氧化物歧化酶(SOD)测试盒(A001); 植物过氧化物酶(POD)测定试剂盒(A084)均购自南京建成生物工程研究所(南京, 中国)。实验过程按照试剂盒说明书操作。
1.2.6 体外抗氧化活性 采用DPPH法测量。取0.1 g新鲜浒苔, 用10 mL无水乙醇浸提30 min, 过滤,滤液旋转蒸发至干燥, 配制成浓度为10 g/L的提取液。取100μL加入等量的0.1 mol/L的DPPH溶液, 用乙醇定容至4 mL, 在515nm处进行比色测定。通过公式: 清除率% = [1-(A1-A0)/Aj]×100。A1为样品与DPPH试剂的混合液的吸光度值,A0为乙醇与DPPH试剂的混合液吸光度值,Aj为空白样与DPPH试剂的混合液吸光度值。
1.2.7 内源植物激素的提取 准确称取0.1 g新鲜浒苔。分别用1mL甲醇︰水︰甲酸 (体积比15︰4︰1)提取液提取, 涡旋振荡均匀并超声波处理20 min, 然后在–20°C冰箱内提取16h。以10000 r/min、4°C离心10 min, 将上清液移至4 mL样品瓶中。分别再用0.5 mL提取液提取残渣2次, 合并, 低温减压蒸干并用500μL甲醇︰水︰乙酸(90︰10︰0.05,V/V/V)溶解,转移至1.5 mL棕色样品瓶。每组样品3个平行。
1.2.8 内源植物激素的检测条件 检测条件采用Thermo Fisher HPLC-QqQ-MS进行, 检测参数参照刘雪梅等(2012)。色谱条件: 采用Hypersil Gold C18 HPLC色谱柱(100mm×2.1mm, 1.7μm), 流速0.3 mL/min, 流动相: 10 mmol/L甲酸铵(A)-甲醇(B), 洗脱梯度(0—20min流动相B从15%上升到100%, 保持5min, 然后在1min内降到10%, 保持14 min; 柱温30°C, 进样量10μL。质谱条件: 分别采用电喷雾电离源正、负离子模式, 喷雾电压分别为3kV和2.5kV, 鞘气压力30 L/min, 辅助气流量2 L/min, 离子传输毛细管温度300°C, Q2碰撞室碰撞诱导解离电压1.5V, 采用选择反应监测(SRM)扫描模式, 碰撞气采用氩气, 碰撞气压力0.1995Pa, Q1和Q3分辨率均设定为半峰宽0.7Da。
1.2.9 植物激素的标准曲线 称取10.0 mg的吲哚乙酸、赤霉素和茉莉酸标准品, 用1/1甲醇水溶解配制成10 mg/mL储备液; 先用少量1.0 mol/L的稀盐酸溶解, 再用纯甲醇配制10 mg/mL异戊烯腺嘌呤核苷、异戊烯腺嘌呤、玉米素和反式玉米素核苷标准品储备液。4°C冰箱中保存。最终吲哚乙酸标准曲线:Y= 2×106X+ 8700.6,R2=0.9991; 赤霉素标准曲线:Y=934227X+ 2119.7,R2=0.9980; 玉米素标准曲线Y=2×107X+ 157225,R2=0.9898; 反式玉米素核苷标准曲线:Y= 3×107X+ 151561,R2=0.9931; 异戊烯腺嘌呤核苷标准曲线:Y= 6×106X+ 42823,R2=0.9990。茉莉酸标准曲线:Y= 637984X–5149.8,R2=0.9956; 异戊烯腺嘌呤标准曲线:Y= 7×107X+ 560070,R2= 0.9999。其中,X代表相对峰面积,Y表示检测样品浓度, 单位μg/L。各种植物激素检测的浓度范围均为0.5—200μg/L。
1.2.10 统计方法 所有实验均采用3个平行样。数据处理采用Excel 2007和SPSS16.0统计软件进行数据处理及统计分析。设显著水平为P<0.05。
2 结果
2.1 24-表油菜素内酯对浒苔内源植物激素的影响
图1是浒苔中不同时间样品的植物激素检测结果, 在建立标准检测方法的植物激素中, 共检测到吲哚乙酸、赤霉素、玉米素、反式玉米素、异戊烯腺嘌呤核苷和茉莉酸6种植物激素, 始终未检测到异戊烯腺嘌呤(iP)的存在。由图1a可知, 浒苔中吲哚乙酸(IAA)含量呈现先升高后降低的变化趋势。低浓度24-表油菜素内酯处理时, 随着浓度的增大, 浒苔内源IAA含量增大, 0.2 mg/L处理组IAA含量最大; 继续增大24-表油菜素内酯的处理浓度, IAA含量反而下降。实验第3天浒苔的IAA含量达到最大值21.01 μg/g(0.2 mg/L), 是对照组的1.46倍。从第2天到第3天,浒苔体内的IAA含量增大较快。
图1b表示不同浓度24-表油菜素内酯对浒苔中赤霉素(GA)含量的影响。在整个实验周期内, 浒苔中的GA含量先升高后降低。在第1天, 各组浒苔的GA相差不大, 但第2天开始, GA含量发生变化。随着24-表油菜素内酯浓度的增大, 浒苔的GA含量开始增大, 当浓度为0.2 mg/L时, 浒苔的GA达到最大值24.37 μg/g(第3天), 约为对照组的3.19倍; 随着浓度的继续增大, 浒苔的GA反而减小, 到第5天时减少到12.53 μg/g。
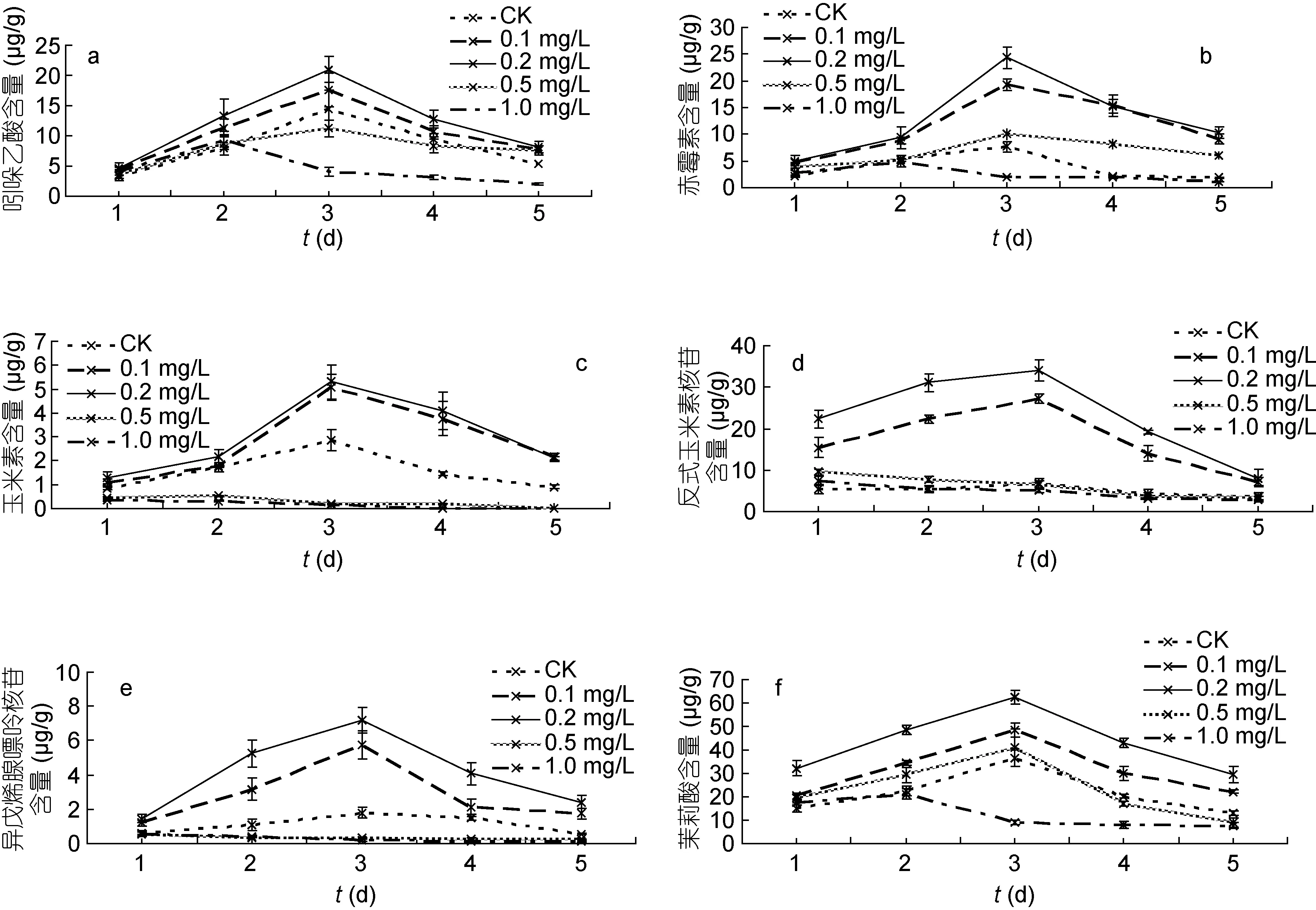
图1 不同浓度24-表油菜素内酯对浒苔植物激素的影响Fig.1 Effects of different concentrations of EBR on endogenous phytohormone content of U. prolifera
图1c显示浒苔的玉米素(ZR)含量与油菜素内酯处理浓度有密切的关系。随着24-表油菜素内酯浓度的增大, ZR含量相应的增大, 其最适宜浓度为0.2 mg/L;高浓度24-表油菜素内酯(0.5 mg/L和1.0 mg/L)对浒苔的ZR有抑制作用, 与对照组差异显著(P<0.05)。整个实验周期中, 浒苔ZR的最大值为5.31 μg/g (0.2 mg/L, 第3天); 在第2天到第3天, ZR的增加幅度最大, 最大增幅达到了3.31 μg/g (0.1 mg/L)。在实验的最后一天,0.5 mg/L和1.0 mg/L处理组未检测出ZR。
从图1d可以看出, 实验过程中浒苔中反式玉米素核苷(TRZ)先升高后降低。随着24-表油菜素内酯浓度的升高, TRZ含量增大, 当24-表油菜素内酯浓度为0.2 mg/L时, 浒苔的TRZ到达同期的最大值; 继续增加24-表油菜素内酯的浓度, 浒苔的TRZ减小, 并且表现出抑制作用。在实验周期内, 浒苔的TRZ最大值为34.08 μg/g (0.2 mg/L, 第3天), 约为对照组的5.06倍。同比于对照组, 当24-表油菜素内酯浓度为0.1—0.2 mg/L时, 浒苔的TRZ变化显著(P<0.05)。
图1e表示不同浓度24-表油菜素内酯对浒苔异戊烯腺苷(iPA)的影响。从浓度0.1 mg/L到0.2 mg/L, 浒苔的iPA含量增大, 在实验第3天, 浒苔的iPA达到最大值7.18 μg/g (0.2 mg/L), 约是对照组的3.97倍。当24-表油菜素内酯浓度从0.5 mg/L到1.0 mg/L时, 浒苔的iPA含量呈下降趋势, 且低于同期对照组。在整个实验周期中, 0.2 mg/L 24-表油菜素内酯组的iPA与对照组、0.5 mg/L组和1.0 mg/L组相比差异显著(P<0.05)。
由图1f可知, 24-表油菜素内酯对浒苔茉莉酸(JA)含量的影响具有浓度效应, 随着24-表油菜素内酯浓度的增大, 浒苔的JA含量增加, 当浓度为0.2 mg/L时, 浒苔的JA达到最大值62.54 μg/g(第3天), 约是对照组的1.72倍。继续增加24-表油菜素内酯的浓度,浒苔的JA含量降低。整个实验周期中, 浒苔的JA含量呈现先增大后减小的动态变化趋势。
2.2 24-表油菜素内酯对浒苔光合作用及其产物的影响
2.2.1 24-表油菜素内酯对浒苔叶绿素荧光参数的影响 由图2可以看出, 不同浓度的24-表油菜素内酯对浒苔PSII最大光能转化效率(Fv/Fm)和PSII相对电子传递速率(ETR)有一定的影响。在低浓度时, 随着浓度的升高, 浒苔的Fv/Fm和ETR增大, 在24-表油菜素内酯浓度为0.2 mg/L时, 分别达到最大值。继续增大24-表油菜素内酯浓度,Fv/Fm和ETR反而减小。在实验第3天, 处理组和对照组浒苔的Fv/Fm和ETR达到最大值。
在整个实验过程中, 低浓度24-表油菜素内酯对浒苔的Fv/Fm促进作用不显著(P>0.05), 而高浓度的24-表油菜素内酯对浒苔的Fv/Fm有抑制作用。在第3天, 1.0 mg/L 24-表油菜素内酯对浒苔的Fv/Fm的最大抑制率约为19.40%。低浓度24-表油菜素内酯对浒苔的ETR有一定的促进作用, 最大促进效率为24.51%(0.2 mg/L EBR, 第2天); 高浓度对浒苔的ETR的最大抑制率为34.17% (1.0 mg/L EBR, 第3天)。
2.2.2 24-表油菜素内酯对可溶性蛋白和可溶性糖含量的影响 从图3a可知, 在低浓度时, 随着24-表油菜素内酯浓度的增大, 可溶性蛋白含量增大, 当浓度为0.2 mg/L时, 浒苔的可溶性蛋白含量达到最大值;继续增大24-表油菜素内酯的浓度, 浒苔的可溶蛋白含量下降, 高浓度24-表油菜素内酯抑制了浒苔的蛋白积累。24-表油菜素内酯在浓度为0.2 mg/L时, 具有最大促进效果25.74%(第4天); 在最大浓度1.0 mg/L时具有最大抑制率为14.08%(第3天)。
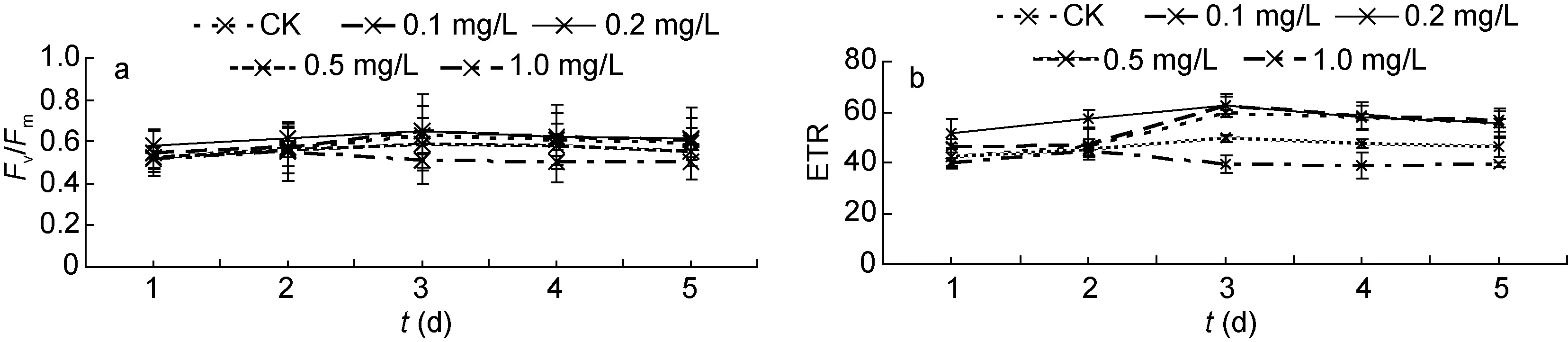
图2 不同浓度24-表油菜素内酯对浒苔的Fv/Fm (a)和ETR (b)的影响Fig.2 Effects of different concentrations of EBR on the Fv/Fm (a) and ETR (b) of U. prolifera
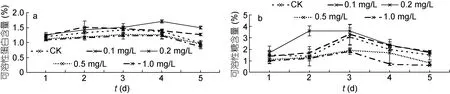
图3 不同浓度24-表油菜素内酯对浒苔可溶性蛋白(a)和可溶性糖(b)的影响Fig.3 Effects of different concentrations of EBR on soluble protein (a) and carbohydrate (b) content of U. prolifera
由图3b可知, 浒苔可溶性糖含量呈现先升高后降低的趋势。在低浓度处理时, 24-表油菜素内酯表现出促进作用, 且0.2 mg/L 24-表油菜素内酯的促进作用最明显, 最大促进作用约是对照组的1.57倍(第2天)。高浓度24-表油菜素内酯对浒苔的可溶性糖有抑制作用, 随浓度的增大, 抑制作用越明显。
2.3 24-表油菜素内酯对浒苔抗逆性的影响
2.3.1 24-表油菜素内酯对浒苔SOD和POD活性的影响 图4a表示不同浓度24-表油菜素内酯对浒苔SOD活性的影响。在整个实验周期内, 浒苔SOD呈现较小范围的先升高后降低趋势。在同一时间点浒苔SOD活性大小依次是0.2 mg/L处理组>0.1 mg/L处理组>对照组>0.5 mg/L处理组>1.0 mg/L处理组。处理组浒苔在第2天具有最大的SOD活性318.8U/g (0.2 mg/L)。
图4b表示不同浓度24-表油菜素内酯对浒苔POD活性的影响。浒苔的POD活性变化比较大, 且在不同的时间段动态趋势发生着变化。在实验第1天,0.5 mg/L处理组和1.0 mg/L处理组POD活性分别达到最大值1013.2U/g和1494.0U/g, 然后开始显著下降。在实验第4天, 0.1 mg/L和0.2 mg/L处理组POD活性达到最大值, 然后开始下降, 最大的下降速率分别为47.97%和56.35%。
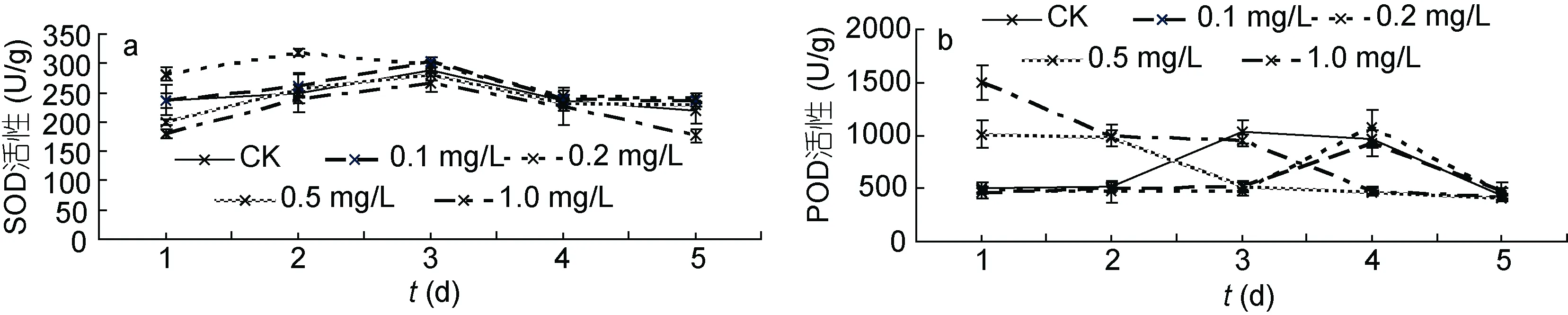
图4 不同浓度24-表油菜素内酯对浒苔SOD(a)和POD(b)的影响Fig.4 Effects of different concentrations of EBR on the SOD (a) and POD (b) activity of U. prolifera
2.3.2 24-表油菜素内酯对浒苔体外抗氧化能力的影响 图5是利用浒苔提取物对DPPH的自由基清除率来表示浒苔的体外抗氧化能力。从图5可见, 在整个实验过程中, 浒苔清除自由基能力有所下降。在实验第1天, 各组浒苔的抗氧化能力随着24-表油菜素内酯浓度的增高而减弱。在低浓度时, 24-表油菜素内酯对浒苔的抗氧化能力有一定的促进作用(0.1 mg/L和0.2 mg/L)。在高浓度时即显示出抑制作用(0.5 mg/L和1.0 mg/L)。在整个实验周期, 低浓度组(0.1 mg/L)的抗氧化能力与对照组差异显著(P<0.05)。
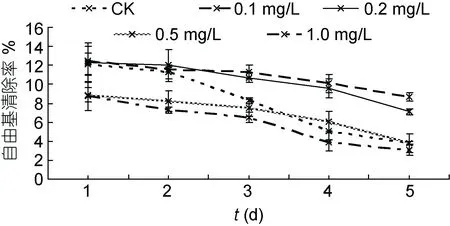
图5 不同浓度24-表油菜素内酯对浒苔体外抗氧化能力的影响Fig.5 Effects of different concentrations of EBR on in vitro antioxidant capacity of U. prolifera
3 讨论
24-表油菜素内酯能够影响植物体内生长性相关植物激素的水平, 进而调节其生长和抗逆等生理作用。如外源ABA和EBR促进了葡萄果实乙烯的释放和果实着色, 提高玉米幼苗根系的IAA和GA含量,而降低ZRs含量。外源24-表油菜素内酯能使弱光胁迫下番茄叶片内源激素吲哚-3-乙酸、玉米核苷和赤霉素含量提高22.8%、3.2%和16.6% (李宁等, 2014)。BR明显影响青花菜茎尖内源植物激素的平衡, 显著抑制IAA的合成, 降低花芽分化期和现蕾期茎尖IAA含量, 提高花芽分化期茎尖内源GA3和iPAs的含量,但是现蕾期茎尖内源GA和iPAs含量却降低(王廷芹等, 2008)。24-表油菜素内酯可提高萝卜的IAA含量,降低ABA含量(Choudharyet al, 2011)。生长素和油菜素内酯都能促进植物生长, 其协同调控很多生理过程, 目前对二者的作用机制和信号转导的相互作用研究成为植物激素研究的热点, 其相互作用过程涉及下游基因转录调控、信号组分互作, 以及合成代谢等多个层面的调控(周晓艺等, 2013)。本研究发现,低浓度的24-表油菜素内酯可以提高浒苔的内源IAA、GA、ZR、TRZ、iPA和JA含量, 最适浓度为0.2 mg/L; 而高浓度24-表油菜素内酯抑制浒苔的内源植物激素的积累, 0.5—1.0 mg/L的24-表油菜素内酯对浒苔的内源TRZ、iPA的影响不明显或者有抑制作用; 在整个实验过程中, 浒苔的内源植物激素的变化呈现先升高后降低的变化趋势。
叶绿素荧光分析技术作为快速、无损伤探针应用于光合作用、植物抗逆生理机理等方面。植物体内的叶绿素荧光与光合作用中各种生理反应密切相关,可以通过对体内叶绿素荧光参数的测定反映逆境对光合作用过程的影响。24-表油菜素内酯能显著增加甜瓜幼苗叶片的Fv/Fm和电子传递速率, 以1.0 mg/L的24-表油菜素内酯处理效果最优(张永平等, 2012)。本研究发现低浓度的24-表油菜素内酯促进了浒苔Fv/Fm和ETR, 且0.2 mg/L效果最明显, 高浓度的24-表油菜素内酯对Fv/Fm和ETR有一定的抑制作用。24-表油菜素内酯在0.2 mg/L浓度下对ETR最大促进效率为24.51%。
研究发现适宜浓度油菜素内酯处理可使不同抗低氧能力的黄瓜品种的抗氧化活性增加, 同时, 根系可溶性蛋白和热稳定蛋白含量现抓提高, 抗低氧活性强品系效果更显著。油菜素内酯可以促进小球藻(Chlorella vulgaris)的蛋白质积累(Andrzej, 2000)。本研究表明低浓度的24-表油菜素内酯能够提高浒苔可溶性蛋白和可溶性糖的含量, 且0.2 mg/L效果最好,高浓度的24-表油菜素内酯有一定的抑制作用。整个实验周期内浒苔可溶性蛋白和可溶性糖含量先升高后降低。
SOD和POD是植物抗氧化系统中的重要的功能酶, 对植物逆境胁迫过程中产生的活性自由基和过氧化物起消除作用。SOD主要功能是清除生物体内的O2-, POD可清除过多的H2O2和其他过氧化物。外源油菜素内酯能提高抗氧化防护酶SOD和CAT活性,而这种诱导机制被H2O2产生抑制剂二苯基碘(DPI)和MEK1/2抑制剂PD98059阻断(丁海东等, 2011)。24-表油菜素内酯显著促进高温胁迫下茄子幼苗生长,提高了SOD、POD、CAT和APX活性, 降低了MDA、O2-和H2O2含量(吴雪霞等, 2013)。Choudhary等(2011)研究显示24-表油菜素内酯能够提高萝卜幼苗的SOD活性。Wang等(2012)发现油菜素内酯对存储中的青椒的POD活性有一定的影响, 先升高后降低。本研究发现0.2mg/L 24-表油菜素内酯处理的浒苔SOD活性最大, 但整个实验过程中SOD活性变化不明显;而不同浓度24-表油菜素内酯处理的浒苔POD变化明显, 高浓度的24-表油菜素内酯(0.5mg/L和1.0mg/L)处理, 浒苔POD活性在第1天达到最大值。
高等植物中含有种类各异的抗氧化物(Shonet al,2003)。许多海藻中也含有丰富的抗氧化物质(Duanet al, 2006; Ganesanet al, 2008; Matanjunet al, 2008)。本实验发现不同浓度24-表油菜素内酯处理的浒苔DPPH抗氧化活性不同, 低浓度(0.1—0.2 mg/L)24-表油菜素内酯对浒苔的抗氧化活性有一定的促进作用,而高浓度(0.5—1.0 mg/L)的24-表油菜素内酯则有抑制作用。
本文在前期研究基础上, 初步确定了浒苔中24-表油菜素内酯作用的有效范围为0.1—1.0 mg/L。结果0.2 mg/L 24-表油菜素内酯效果最佳, 能显著提高浒苔中IAA、GA、ZR、TRZ、iPA和JA等植物激素的含量, 促进浒苔叶绿素荧光参数Fv/Fm和ETR和光合作用效率, 促进可溶性蛋白和可溶性糖的积累, 提高SOD和POD酶和抗氧化活性。
丁海东, 刘 慧, 陈 一等, 2011. H2O2和MAPK介导油菜素内酯诱导番茄抗氧化防护酶SOD和CAT的信号途径。植物生理学报, 47(10): 1010—1016
王廷芹, 杨 暹, 2008. 油菜素内酯对青花菜茎尖核酸和激素含量的影响. 园艺学报, 35(5): 661—666
刘雪梅, 赵 鹏, 徐继林等, 2012. LC-MS同时测定大型海藻中9个植物激素. 药物分析杂志, 32(10): 1747—1752
李 宁, 苏晓琼, 孙 锦等, 2014. 外源24-表油菜素内酯对弱光胁迫下番茄叶片内源激素、碳水化合物代谢及果实的影响. 南京农业大学学报, 37(3): 51—56
吴雪霞, 查丁石, 朱宗文等, 2013. 外源24-表油菜素内酯对高温胁迫下茄子幼苗生长和抗氧化系统的影响。植物生理学报, 49(9): 929—934
张永平, 范红伟, 杨少军等, 2012. 表油菜素内酯表油菜素内酯对高温胁迫下甜瓜幼苗叶绿素荧光特性的影响. 上海农业学报, 28(3): 17—21
周晓艺, 薛红卫, 2013. 生长素与油菜素甾醇相互作用机制的研究进展. 中国科学: 生命科学, 43(12): 1047—1053
侯和胜, 陈敏资, 1997. 油菜素内酯对单细胞藻生长和某些生理活性的影响. 海洋与湖沼, 28(4): 371—375
Andrzej B, 2000. Effect of brassinosteroids on nucleic acids and protein content in cultured cells ofChlorella vulgaris. Plant Physiol Biochem, 38(3): 209—215
Choudhary S P, Kanwar M, Bhardwaj Ret al, 2011.Epibrassinolide ameliorates Cr (VI) stress via influencing the levels of indole-3-acetic acid, abscisic acid, polyamines and antioxidant system of radish seedlings. Chemosphere,84(5): 592—600
Duan X J, Zhang W W, Li X Met al, 2006. Evaluation of antioxidant property of extract and fractions obtained from a red alga,Polysiphonia urceolata. Food Chem, 95: 37—43
Ganesan P, Chandini S K, Kumar C Set al, 2008. Antioxidant properties of methanol extract and its solvent fractions obtained from selected Indian red seaweeds. Bioresour Technol, 99: 2717—2723
Jiao L L, Li X, Li T Bet al, 2009. Characterization and anti-tumor activity of alkali-extracted polysaccharide fromEnteromorpha intestinalis. International Immunopharmacology,9: 324—329
Matanjun P, Mohamed S, Mustapha N Met al, 2008. Antioxidant activities and phenolics content of eight species of seaweeds from north Borneo. J Appl Phycol, 20: 367—373
Ozdemir F, Bor M, Demiral Tet al, 2004. Effects of 24-epibrassinolide on seed germination, seedling growth,lipid peroxidation, proline content and antioxidative system of rice (Oryza sativaL.) under salinity stress. Plant Growth Regulation, 42(3): 203—211
Sasse J M, 2003. Physiological actions of brassinosteroids: an update. Journal of Plant Growth Regulation, 22(4): 276—288
Seeta R R S, Vidya V B, Sujatha Eet al, 2002. Brassinosteroids——A new class of phytohormones. Current Science, 82:1239—1245
Shon M Y, Kim, T H, Sung N J, 2003. Antioxidants and free radical scavenging activity ofPhellinus baumii(Phellinus of Hymenochaetaceae) extracts. Food Chem, 82: 593—597
Teng Z L, Qian L, Zhou Y, 2013. Hypolipidemic activity of the polysaccharides fromEnteromorpha prolifera. International Journal of Biological Macromolecules, 62: 254—256
Wang Q, Ding T, Gao L Pet al, 2012. Effect of brassinolide on chilling injury of green bell pepper in storage. Scientia Horticulture, 144: 195—200
Wei J T, Wang S X, Liu Get al, 2014. Polysaccharides fromEnteromorpha proliferaenhance the immunity of normal mice. International Journal of Biological Macromolecules, 3:1—5
Xia X J, Huang Y Y, Wang Let al, 2006. Pesticides-induced depression of photosynthesis was alleviated by 24-epibrassinolide pretreatment inCucumis sativusL.Pesticide Biochemistry and Physiology, 86: 42—48
Yu J Q, Zhou Y H, Ye S Fet al, 2002. 24-epibrassinolide and abscisic acid protect cucumber seedlings from chilling injury. Journal of Horticultural Science and Biotechnology,77: 470—473
