宁波沿海陆源排污口拟杆菌(Bacteroidetes)分布的特点*
2014-03-19王中华徐茂琴张迪骏何伟娜陈丽萍童茜茜张春丹苏秀榕
王中华 徐茂琴 谢 利 张迪骏 周 君 何伟娜 陈丽萍 童茜茜 张春丹 苏秀榕
(1. 宁波大学海洋学院 宁波 315211; 2. 宁波城市职业技术学院 宁波 315100;3. 国家海洋局北海环境监测中心 青岛 266061)
高通量454焦磷酸测序, 是以DNA扩增的乳胶系统和皮升级(picolilter, 10–12liter)焦磷酸为基础的测序方法(Margulieset al, 2005), 该技术被广泛应用于土壤(Roeschet al, 2007)、海洋(Paleniket al, 2009)等环境微生物生态学研究中。拟杆菌门(Bacteroidete)是肠道中数量最大的革兰氏阴性细菌, 在人和鼠的盲肠内容物中拟杆菌属占总细菌的20%—40% (Woodet al, 1998)。虽然拟杆菌可以从肠道中分离得到, 但是部分拟杆菌是可以致病的, 而人们对与拟杆菌的认识也是从致病性开始(Wexler, 2012), 作为条件致病菌的拟杆菌, 当其正常的微生态平衡被打破时可引发内源性感染。随着时间的发展和研究的深入, 人们逐渐发现拟杆菌和其它菌群与宿主之间微妙而又复杂的关系, 对宿主健康起着重要的作用(吴彦彬等, 2007),而在另一方面, 这类长期被环境检测和公共卫生机构所忽略的微生物逐渐为指示水体所受的粪源污染提供了一条新的途径(Wadeet al, 2006)。而拟杆菌门还包括另外两纲, 分别为黄杆菌纲(Flavobacteria)和鞘脂杆菌纲(Sphingobacteria)。黄杆菌纲主要存在于水生环境中, 也会在食物中存在, 多数黄杆菌纲细菌对人无害, 但脑膜脓毒性金黄杆菌(Chryseobacterium meningosepticum)可引起新生儿脑膜炎(Linet al,2010)。而鞘脂杆菌纲在海洋细菌中占有较大比例, 可以降解纤维素(Liet al, 2011)。
本文选取宁波沿海10个主要的陆源排污口, 分别对排污口处和距排污口50m以外的20个站位的水样进行分析。在454焦磷酸测序基础上, 首先对各个站点总体情况进行统计分析, 再根据不同采样月份各站位拟杆菌门, 包括拟杆菌纲、黄杆菌纲和鞘脂杆菌纲检出频次的统计, 分析拟杆菌门的分布概况。
1 材料与方法
1.1 样品采集
选择宁波市10个陆源排污口, 分别为象山爵溪东塘排污口(S1)、象山水桶岱垃圾场渗透水排污口(S2)、象山石浦水产加工园区排污口(S3)、象山西周工业园区综合排污口(S4)、象山墙头综合排污口(S5)、北仑三山排污口(S6)、宁海西店崔家综合排污口(S7)、奉化市下陈排污口(S8)、宁海颜公河入海排污口(S9)和余姚黄家埠排污口(S10)(陈丽萍等, 2013)。将5 L的桶消毒后采集各占站点的水样。样品收集时间分别为2011年3月、5月、8月、10月。10个站点分别标记为S1—S10, 采样月份分别标记为M3、M5、M8、M10, 排污口和排污口50m以外水样分别标记为–0和–50。样品采集完毕后, 立即运回实验室, 用0.2 μm微滤膜对污水进行过滤之后进行DNA提取。
1.2 总DNA提取及扩增
利用水体细菌基因组DNA提取试剂盒(Omega Bio-Tek), 按照试剂盒说明书提取基因组DNA, 测定OD260/OD280在1.8—2.0, OD260/OD230高于1.7。利用Primer Premier 5.0设计扩增引物, 其序列如下: P1:5’-CCA TCT CAT CCC TGC GTG TCT CCG ACT CAG-3’; P2: 5’-CCT ATC CCC TGT GTG CCT TGG CAG TCT CAG-3’。反应体系如下: 10×buffer 2.5μL、25 mmol/L MgCl22.5μL、2.5 mmol/L dNTPs 2.0μL、10μmol/L 引物各 1.0μL, 1.0 U rTaq酶、模板DNA 1.0μL, 无菌超纯水补足至25μL。PCR扩增条件为:95°C预变性4 min; 94°C变性45 s, 56°C退火45 s,72°C延伸1 min, 30个循环; 72°C延伸 10 min。取23μL PCR产物, 加入5μL 10×loading buffer混匀,1%琼脂糖凝胶电泳, –20°C冰箱保存备用(周君等,2012)。
1.3 测序与分析
将PCR扩增产物经电泳检测合格后, 利用新一代高通量测序平台454 GS FLX Titanium对扩增产物进行测序。利用SPSS 19.0对数据进行统计分析。
2 结果与讨论
2.1 454测序数据总体分析
通过454高通量测序平台对20个站点4个检测月份80个样品进行鉴定分析, 共成功鉴定24个门,主要包括变形菌门(Proteobacteria)、拟杆菌门、蓝藻门(Cyanobacteria)和后壁菌门(Firmicutes)等(表1), 其中变形菌门在各个月份中一直为优势菌门, 甚至在5月份达到了4个检测月份中最高的65.29%。其次为拟杆菌门, 其出现频次百分比随着月份的增加而递增,与之变化趋势相同的还有梭杆菌门(Fusobacteria)。郭世奎等(2010)在利用实时荧光定量PCR法比较直肠癌患者与正常人的肠道中的拟杆菌属(Bacteroides)、梭杆菌属(Fusobacterium)和梭菌属(Clostridium)时, 发现直肠癌患者的肠道中的三种菌属均高于正常人, 有共同上升的趋势, 呈现出致病性的高相关性。另外, 放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)、热袍菌门(Thermotogae)和广古菌门(Euryarchaeota)等也呈现出相同的变化趋势, 均为前三个月份递增, 10月份下降的趋势。
2.2 拟杆菌门及其纲的分布特点
经过对454测序结果统计分析发现, 拟杆菌门下共鉴定出3个纲(目), 分为为拟杆菌纲(目)、黄杆菌纲(目)和鞘脂杆菌纲(目), 拟杆菌目下共有3个科5个属,黄杆菌目下共有2个科17个属, 鞘脂杆菌目下共有4个科5个属。
四个检测月份各个排污口拟杆菌纲、黄杆菌纲与鞘脂杆菌纲的分布情况如图1, 其中8月份细菌检出频次较其它三个检测月份明显减少, 推测可能和采样时的水温有关, 四个检测月份大部分站点的优势属为黄杆菌纲, Liu等(2013)对春天浮游植物暴发后的黄海海域进行了细菌群落结构的分析, 结果显示黄杆菌纲也是其优势菌种之一。其次为拟杆菌纲, 鞘脂杆菌纲出现较少, 但在某特定站点特定月份会出现反常现象, 比如5号站点排污口50m处8月份时,鞘脂杆菌纲出现的次数和黄杆菌纲基本相同, 而拟杆菌纲出现极少。
利用R For Windows 3.0 对各个排污口的拟杆菌门出现情况进行聚类分析, 见图2。结果发现细菌群落结构存在较明显时空变化, 10个站点拟杆菌门出现的情况大致可以分为两类, 一类是S1、S3、S9、S5和S2站点, 另一类是S4、S8、S7、S10和S6站点。其中S1与S3站点、S2与S5站和S4与S8站点相似
度最高, 从排污口类型来看, S1与S3站点均为工业性排污口, S4与S8排污口均为排污河, 故推测可能与排污口类型存在较大的联系。而从采样月份来看, 相关度最高的为8月份和10月份, 而3月份和5月份也存在一定的相关性, 这表明拟杆菌门的出现情况与季节也有一定的联系, 但对于所有排污口而言, 菌群结构在不同季节的变化比空间的不同所形成的差异更为显著。Díez-Vives等(2014)通过对不同时间分布、不同空间分布的拟杆菌进行群落结构分析, 也认为不同的地点和不同的季节会导致拟杆菌群落结构的变化。

表1 454测序结果总体情况分析Tab.1 Results of the pyrosequencing (454 Life Sciences)
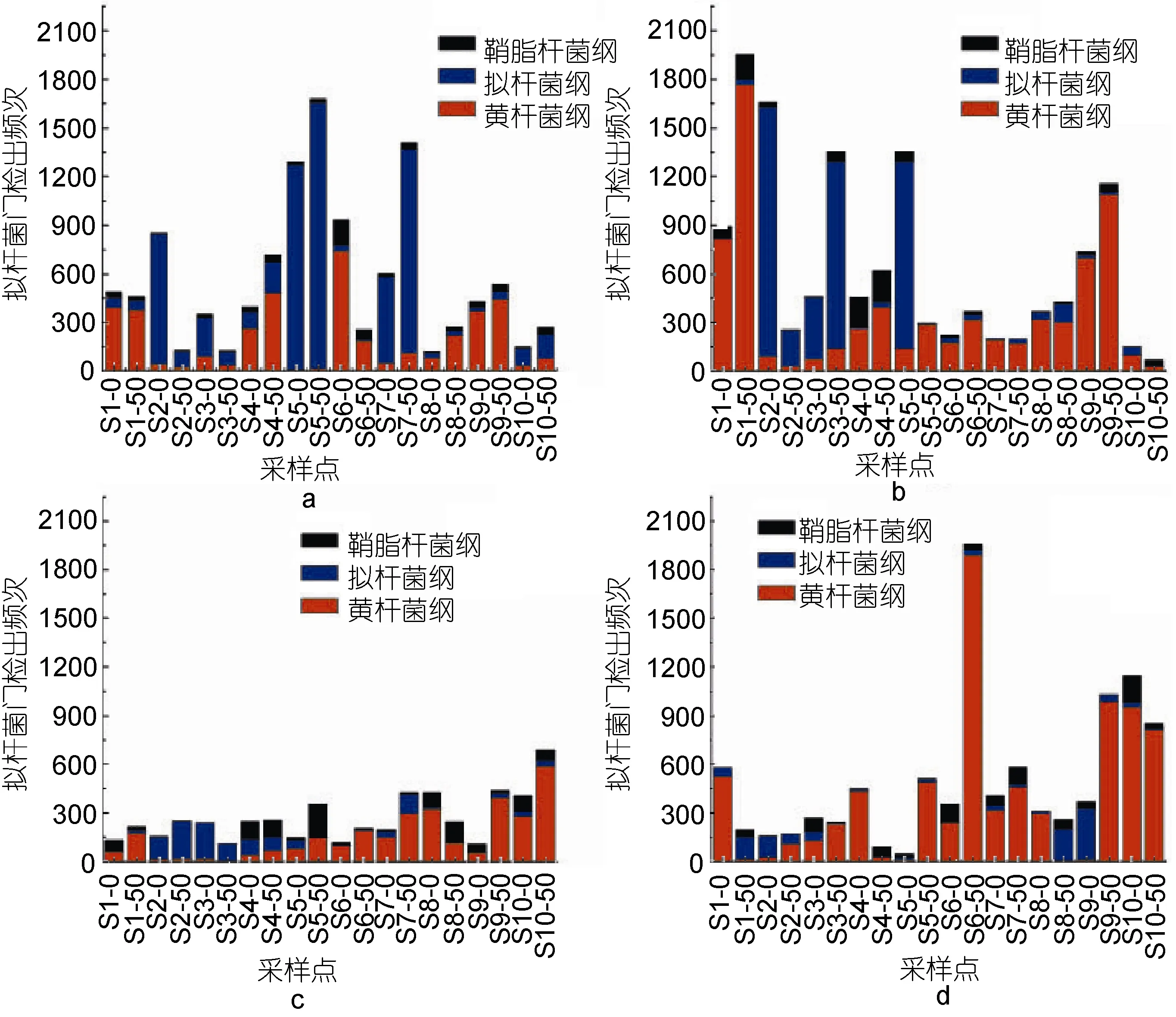
图1 不同检测月份不同排污口拟杆菌纲、黄杆菌纲和鞘脂杆菌纲分布情况Fig.1 The distribution statistics of Bacteroidetes, Flavobacteria and Sphingobacteria in different sewage outlets and months a. 3月; b. 5月; c. 8月; d. 10月
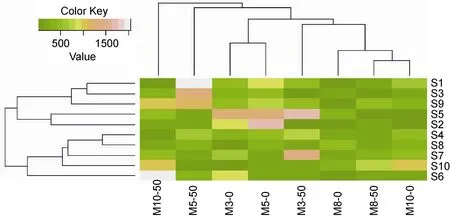
图2 不同检测月份不同排污口站位拟杆菌门数量聚类分析Fig.2 The cluster analysis on number of Bacteroidetes in different sewage outlets and months
将排污口和排污口50m处拟杆菌纲、鞘脂杆菌纲与黄杆菌纲出现的次数进行整合, 针对不同类型排污口进行统计分析, 如图3所示。拟杆菌纲在2个排污口(S5和S7)呈现出随着月份的推进而大幅下降的趋势, 而在另外两个排污口(S2和S3)呈现出先增后降的趋势, 其余站点较上述四个站点变化幅度较为平缓, 各个月份变化波动很小。传统的指示菌逐渐暴露出与沙门氏菌等致病菌的相关性差、无法辨识粪源污染(Nobleet al, 2001), 拟杆菌以其在肠道内数量的绝对优势, 在受污染的水体中不能存活很长时间(约1—2d)、并不能繁殖(Converseet al, 2009), 且通过16S rRNA基因序列的差异能够分辨粪源的污染来源是人类还是畜类等特点(张薇薇等, 2010), 为指示水体所受的粪源感染提供了一种新的途径(Wadeet al,2006)。从各个排污口看, S5象山墙头综合排污口在3月份粪源污染最严重, 随着时间的推进, 粪源污染逐步减轻, 而S2象山水桶岙垃圾场渗透液排污口在5月份粪源污染较为严重。
而黄杆菌纲在不同类型的排污口中的变化幅度虽不同, 但是呈现出较为一致的变化趋势, 即大部分站点5月份的检出频次普遍高于3月份, 10月份的检出频次普遍高于8月份, 而8月份较5月份呈现出下降的趋势, 推测可能和取样时的水温有一定关系。从排污口类型看, S2象山水桶岙垃圾场渗透液排污口作为市政排污口, 与其它9个排污口呈现出明显的不同,黄杆菌纲出现次数很少, 推测可能与排污口污水中的成分有关。
与黄杆菌纲和拟杆菌纲不同, 鞘脂杆菌纲出现频次较低, 且不同月份之间变化的幅度并没有之前两种菌的大, 次数最多的只有S4象山西周工业园区综合排污口在5月份的381次。由于鞘脂杆菌纲属于寡营养细菌, 分离和纯化十分困难, 和振花等(2011)将北极海水样品放置于连续透析培养装置中, 4°C培养3个月之后, 以0.22μm硝酸纤维膜过滤至富集,再将滤膜置于寡营养琼脂上2°C培养4月, 获得可培养寡营养细菌。454高通量测序技术的出现, 克服了环境中大多数微生物“存活但不能培养”(viable but nonculturable, VBNC)的特点(段曌等, 2012), 使得大规模的环境基因组研究相继展开, 大量的新的微生物种群和新的基因得以发现, 体现了454高通量测序较传统微生物生态学研究方法的优势。
2.3 普雷沃菌属及黄杆菌属分布特点

图3 不同类型排污口拟杆菌纲、鞘脂杆菌纲和黄杆菌纲在不同检测检测月份出现情况Fig.3 Appearance of Bacteroidetes, Sphingobacteria and Flavobacteria in different types of sewage outlets during the four months
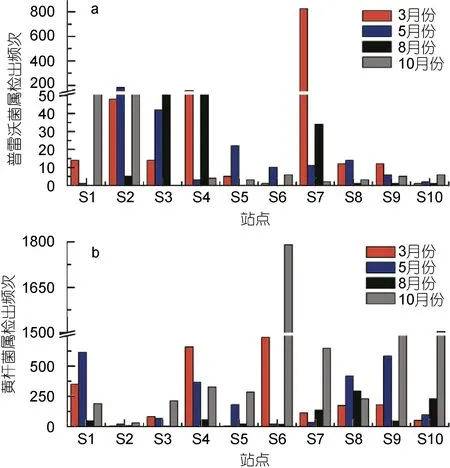
图4 10个站点4个检测月份普雷沃菌属和黄杆菌属检出情况Fig.4 The appearance of Prevotella and Flavobacterium in the 10 sites during the four months
对454测序结果的进一步分析发现, 普雷沃菌属(Prevotellasp.)则为拟杆菌科内除拟杆菌属外的优势属, 而黄杆菌属(Flavobacteriumsp.)为黄杆菌科内的优势属。对10个站点进行分析发现(图4), S2、S3、S4与S7站点普雷沃菌属出现频次相对其余站点较高,其中S7站点在3月份更是高达824次, 这可能与排污口的类型有极大的联系。普雷沃菌属是近年来从类杆菌属中分出的一个新菌属, 主要集聚于正常人体的口腔、女性生殖道等部位, 组成这些部位的正常菌群仅次于脆弱类杆菌。它是临床上较常见的一种条件致病菌, 可引起这些部位的内源性感染, 女性生殖道及口腔感染多见, 与结缔组织的分解有关(Purusheet al, 2010)。
与普雷沃菌属相比, 黄杆菌属出现的频次明显较高, S6站点在10月的出现频次将近1800次。黄杆菌属在大部分站点的5月与8月的样品中检出频次会远远小于3月与10月。柱状黄杆菌(Flabobacterium columnare)主要危害鱼类的鳃组织, 也可引起体表溃乱, 是细菌性烂鳃病的主要病原(黄冠军等, 2012),同时广泛存在于自然界及医院环境中, 主要引起早产儿及新生儿的脑膜炎, 成人则可发生败血症及心内膜炎、伤口感染、肺部感染等, 是医院感染病原菌之一(张德忠等, 2009)。
3 结论
本研究利用454高通量测序技术对宁波沿海2个重点排污口、8个一般排污口的20个站位4个检测月份的水样进行分析, 共成功鉴定24个菌门, 在整个454高通量测序结果的背景下, 着重对拟杆菌门及其纲、具有代表性的普雷沃菌属及黄杆菌属的分布特点进行了统计分析, 体现了454测序高通量的特点,另外通过454测序检测到了极难培养的寡营养细菌鞘脂杆菌, 也说明了454测序较传统微生物生态学研究方法的优势。
吴彦彬, 李亚丹, 李小俊等, 2007. 拟杆菌的研究及应用. 生物技术通报, 1: 66—69
张德忠, 温建艳, 周文聪等, 2009. 黄杆菌属医院感染特性与多药耐药分析. 中华医院感染学杂志, 19(15): 2040—2043
张薇薇, 杨晶艳, 王 嵬等, 2010. 拟杆菌属实时荧光定量PCR的建立. 现代预防医学, 37(17): 3310—3312
陈丽萍, 侯付景, 张迪骏等, 2013. 宁波沿海陆源排污口假单胞菌属. 海洋与湖沼, 44(4): 926—930
和振花, 杨季芳, 陈吉刚等, 2011. 北极海水中可培养寡营养细菌多样性. 海洋湖沼通报, 4: 58—67
周 君, 刘 兵, 李春丽等, 2012. 宁波港压载水浮游植物多样性的研究. 生物技术通报, 9: 197—201
段 曌, 肖 炜, 王永霞等, 2012. 454测序技术在微生物生态学研究中的应用. 微生物学杂志, 31(5): 76—81
郭世奎, 包维民, 龚昆梅等, 2010. 实时荧光定量PCR法研究结直肠癌患者肠道拟杆菌属、梭杆菌属和梭菌属量的变化.中国微生态学杂志, 22(1): 24—28
黄冠军, 饶朝龙, 刘衍鹏等, 2012. 柱状黄杆菌常规PCR检测体系的建立. 水产科学, 30(11): 689—692
Converse R R, Blackwood A D, Kirs Met al, 2009. Rapid QPCR-based assay for fecalBacteroidesspp. as a tool for assessing fecal contamination in recreational waters. Water research, 43(19): 4828—4837
Díez-Vives C, Gasol J M, Acinas S G, 2014. Spatial and temporal variability among marine Bacteroidetes popula-tions in the NW Mediterranean Sea. Systematic and Applied Microbiology, 37(1): 68—78
Li Y, Lee C G, Watanabe Tet al, 2011. Identification of microbial communities that assimilate substrate from root cap cells in an aerobic soil using a DNA-SIP approach. Soil Biology and Biochemistry, 43(9): 1928—1935
Lin P Y, Chen H L, Huang C Tet al, 2010. Biofilm production,use of intravascular indwelling catheters and inappropriate antimicrobial therapy as predictors of fatality inChryseobacterium meningosepticumbacteraemia. International Journal of Antimicrobial Agents, 36(5): 436—440
Liu M, Xiao T, Sun Jet al, 2013. Bacterial community structures associated with a natural spring phytoplankton bloom in the Yellow Sea, China. Deep Sea Research Part II: Topical Studies in Oceanography, 97: 85—92
Margulies M, Egholm M, Altman W Eet al, 2005. Genome sequencing in microfabricated high-density picolitre reactors.Nature, 437: 376—380
Noble R T, Fuhrman J A, 2001. Enteroviruses detected by reverse transcriptase polymerase chain reaction from the coastal waters of Santa Monica Bay, California: low correlation to bacterial indicator levels. Hydrobiologia, 460(1—3): 175—184
Palenik B, Ren Q, Tai Vet al, 2009. CoastalSynechococcus metagenomereveals major roles for horizontal gene transfer and plasmids in population diversity. Environmental Microbiology, 11: 349—359
Purushe J, Fouts D E, Morrison Met al, 2010. Comparative genome analysis ofPrevotella ruminicolaandPrevotella bryantii: insights into their environmental niche. Microbial Ecology, 60(4): 721—729
Roesch L F, Fulthorpe R R, Riva Aet al, 2007. Pyrosequencing enumerates and contrasts soil microbial diversity. The ISME Journal, 1: 283—290
Wade T J, Calderon R L, Sams Eet al, 2006. Rapidly measured indicators of recreational water quality are predictive of swimming-associated gastrointestinal illness. Environmental Health Perspectives, 114(1): 24—28
Wexler H M, 2012. Pump it up: Occurrence and regulation of multi-drug efflux pumps inBacteroides fragilis. Anaerobe,18(2): 200—208
Wood J, Scott K P, Avguštin Get al, 1998. Estimation of the relative abundance of differentBacteroidesandPrevotellaribotypes in gut samples by restriction enzyme profiling of PCR-amplified 16S rRNA gene sequences. Applied and Environmental Microbiology, 64(10): 3683—3689
