浸洗对淡干海带中主要金属元素含量及海藻酸盐组成的影响*
2014-03-19潘若才王兵兵龙晓静朱嘉琳朱顺生姚久勇夏延致
潘若才 王兵兵 赵 卫 龙晓静 朱嘉琳 朱顺生 姚久勇 李 凯 夏延致
(青岛大学纤维新材料与现代纺织国家重点实验室培育基地 青岛 266071)
海藻酸盐是一种天然阴离子聚合物, 它是海藻酸与金属阳离子结合形成的水溶性的海藻酸钠、海藻酸钾和水不溶性的海藻酸钙及其它二价或二价以上的金属离子的线性高分子聚合物(Gomezet al, 2009)。因其具有良好的生物相容性, 易于凝胶化, 在医用敷料、药物传输和生物组织工程中有诸多应用(Leeet al,2012)。近年来, 由水溶性海藻酸钠通过湿法纺丝制得的海藻纤维因具有良好的本质自阻燃性和舒适性,作为环境友好型天然生物质材料, 在服装面料方面应用前景广阔(王兵兵等, 2011)。
海藻酸盐主要存在于褐藻纲(Phaeophyceae)植物的细胞间质和细胞壁中, 是褐藻纲藻类植物海藻多糖最主要的存在形式, 其生物学功能主要是为褐藻细胞提供结构支撑和参与离子交换(Percival, 1979)。海藻酸盐的含量因褐藻品种、收获时间、生长地域的不同而有所差异, 一般占褐藻干重的10%—30% (湿重, wt%), 海带中海藻酸盐含量一般为25%左右(纪明侯, 1997; Murakamiet al, 2011; Wijesingheet al,2012)。由于海带产量丰富, 价格低廉, 海藻酸盐含量高, 使其成为海藻酸盐主要的原料来源。
我国海带产量丰富, 2010年海带年产量达到88.4万吨(以干重计), 占我国海藻总产量的57.3%, 海带养殖区域主要集中在山东、福建、辽宁等地。2010年我国藻类加工品产量达到94.6万吨, 其中过半产品均被加工成淡干海带(李晓川, 2012)。淡干海带便于运输储存, 加工时经过淡水浸洗处理, 但是浸洗对海藻酸钠的提取产量有无影响, 相关方面的研究较少。本文以山东长岛海带作为实验样品, 研究了海带中的主要金属元素组成, 对海带浸洗前后金属元素含量及海藻酸根离子(Alg-COO–)含量作了比较, 并计算出浸洗之后海带中海藻酸盐的组成, 通过XRD(X-Ray Diffraction, X射线衍射)测试首次确认了通过浸洗可除去海带中的无机盐类物质。
1 材料与方法
1.1 实验材料与样品
海带为6月份收获的山东长岛淡干海带, 所用实验材料为: 无水碳酸钠(国药集团, 分析纯), 盐酸(国药集团, 分析纯), 次氯酸钠(光华化学厂, 分析纯),甲醛(光华化学厂, 分析纯), 氢氧化钠(国药集团, 分析纯), 无水乙醇(国药集团, 分析纯), 滤袋(200目,自制), 去离子水(自制)。
1.2 实验方法
用去离子水快速清洗整株海带, 除去泥沙等附着在藻体表面的杂质, 自然晾干, 剪成小片状, 得海带样品A。取样品A, 置于10倍体积的(v, wt)去离子水中浸泡12h, 用去离子水清洗, 充分洗去海带表面浸出的粘性胶状液体, 直至浸洗液中检测不到Cl–,自然晾干, 得海带样品B。样品A、B于105°C下干燥4h备用。
1.2.1 元素含量及金属阳离子含量 海带样品A、B中主要金属元素(钾K、钠Na、钙Ca、镁Mg、锶Sr、锂Li)含量(mol/100g)由电感耦合等离子体发射光谱(ICP, Thermo iCAP6300)测定, 金属阳离子含量计算公式如公式(1)所示(M为海带中所含的金属元素,n为M在海带中的化合价), 元素含量变化率按公式(2)计算

1.2.2 海藻酸根离子(Alg-COO–)含量 海带样品中Alg-COO–含量(mol/100g)用重量法(纪明侯, 1997;尚德荣等, 2011)测定(重复3次, 取平均值)。具体步骤为: 分别取10g海带样品A、B置于100mL去离子水中浸泡12h, 清洗后加入500mL 1% (wt%, 下同)Na2CO3溶液, 60°C下持续搅拌1h, 过滤提取液, 滤渣中加入400mL 0.5% Na2CO3溶液60°C继续提取1h,合并两次滤液, 加入1mol/L HCl调节至pH=2, 过滤海藻酸凝胶, 用去离子水充分清洗残余HCl, 然后加入2% NaOH溶液至海藻酸全部溶解, 加入5mL NaClO溶液漂白15min, 加入2倍溶液体积的无水乙醇, 得白色絮状海藻酸钠(SA)凝胶, 过滤后依次用85%、95%乙醇脱水, 60°C真空干燥至恒重。通过公式(3)计算Alg-COO–的含量(SA摩尔质量取198g/mol)。
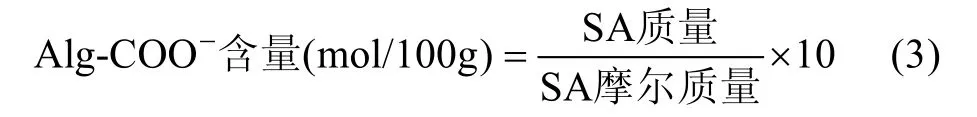
1.2.3 失重率 称取一定量海带样品A, 经过浸洗处理得海带样品B, 海带样品失重率按公式(4)计算。

1.2.4 浸出物含量分析 称取一定量海带样品A,冷冻干燥(LGJ-12冷冻干燥机, 北京松源华星科技)由样品A经浸洗得样品B过程中的浸洗液, 干燥至恒重,称重, 用XRD (DX-2700, 浩元仪器)测试浸出物, 并与样品A、B的XRD谱图作比较, 浸出物含量按公式(5)计算。

2 结果与讨论
2.1 海带样品A、B中K、Na、Ca、Mg、Sr、Li元素及阳离子含量
由表1可知, 金属元素总量由10.5g/100g下降到7.6g/100g。海带样品A、B中各元素含量大小次序存在不同: A中K>Na>Ca>Mg>Sr>Li, B中K>Ca>Na>Mg>Sr>Li。计算得出海带的失重率为44.5%, 由此,可计算出海带中各金属元素含量在浸洗过程中实际含量的变化(图1)。
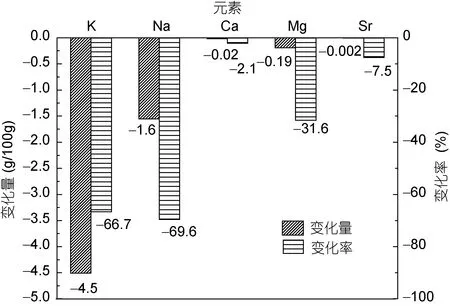
图1 海带浸洗前后各元素相对含量变化Fig.1 Relative content changes of metal elements in dehydrated Laminaria japonica after leaching
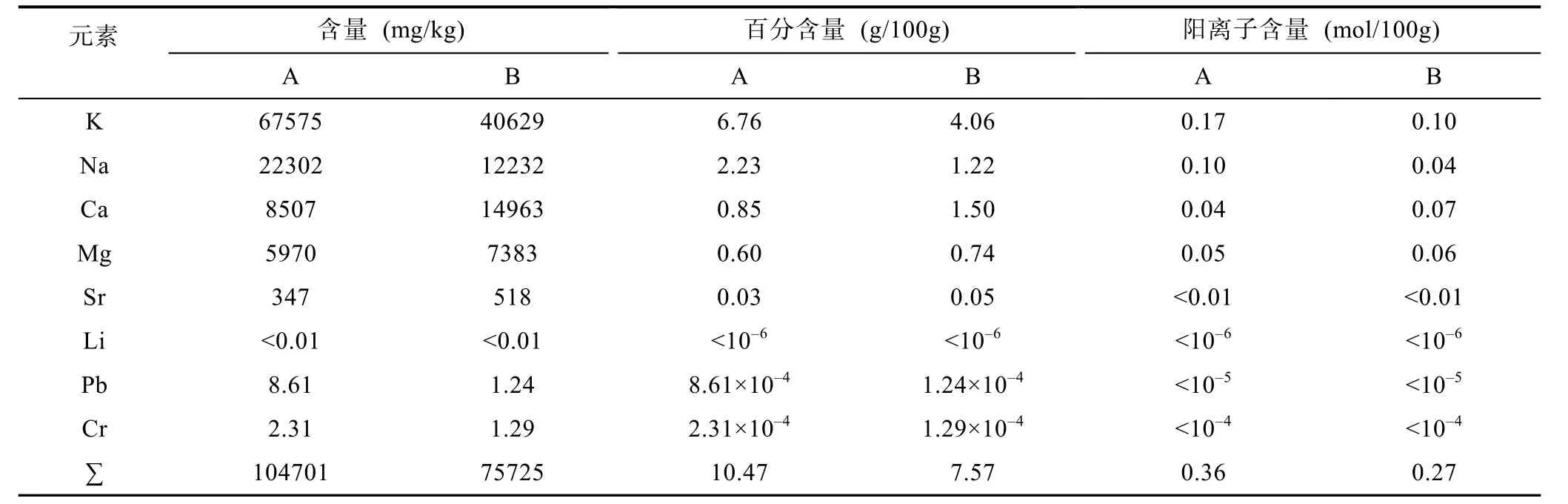
表1 海带中主要金属元素及阳离子含量Tab.1 Content of major metal elements and cation in dehydrated Laminaria japonica
由图1可知, B样品浸洗之后, 海带中一价元素K、Na含量下降均超过60%, 二价元素Ca、Sr下降小于10%, Mg下降了31.6%。这可能是因为: 部分一价金属元素在海带中以无机盐形式存在, 在经过浸洗之后这部分水溶性无机盐几乎完全溶出; 另外, 浸洗并不能破坏海带的细胞壁结构, 浸出物主要为细胞质和细胞间质成分, 从而一部分溶解在细胞质中的海藻酸钾(KAlg)、海藻酸钠(NaAlg)也被洗出;同时, 主要存在于海带细胞壁中的海藻酸钙(Ca(Alg)2)、海藻酸锶(Sr(Alg)2)、海藻酸镁(Mg(Alg)2)在细胞壁完整的情况下难以从海带中分离出来, 故在浸洗之后Ca、Mg、Sr元素含量下降较小, 由于Mg2+与Alg-COO–结合能力较差, 导致其比Ca、Sr损失重大。此外, 由于海带可以富集海水中的重金属元素, 导致Pb、Cr含量较高, 浸洗之后二者含量虽有所下降, 但均超出食品安全国家标准GB 2762-2012(中华人民共和国卫生部, 2012)中所规定的含量, 直接食用存在一定的健康风险。
2.2 海藻酸阴离子基团含量及海藻酸盐组成
有研究认为, 海藻经过淡水浸洗后, 海带中的游离态金属离子全部被洗去, 而蛋白质、色素等海藻中其它有机物所结合的金属离子数量是微量的, 因而可以认为金属元素全部以海藻酸盐的形式存于藻体中(Whyteet al, 1981; 范晓等, 1988)。本文通过重量法测得海带中海藻酸阴离子基团(Alg-COO–)含量, 通过ICP测得常量金属元素含量,然后计算出金属阳离子总含量, 如果浸洗之后的海带样品中金属阳离子含量与Alg-COO–含量大致相同,根据电荷守恒规律, 即可验证上述理论, 通过测定金属元素含量即可计算出海带中海藻酸盐的含量及组成。
重量法制得样品A海藻酸钠的产量为2.10g, 样品B海藻酸钠的产量为4.38g, 结合海带失重率计算得出, 每10g样品A浸洗之后所能提取出的海藻酸钠的质量为2.43g, 海藻酸钠产量没有降低, 反而高于未浸洗之前样品A的提取产量, 这可能因为海带在浸洗过程中, 存在于细胞壁中海藻酸盐损失较小,同时由于长时间浸泡海带组织已充分胀大, 此时进行碱提取时Na+容易与海藻酸盐中的其它金属离子发生离子交换, 有利于海藻酸钠的提取, 从而使提取产量变高。按公式(2)计算海带样品A中Alg-COO–含量为0.11mol/100g, 海带样品B中Alg-COO–含量为0.22mol/100g。由表1可知, A中金属阳离子含量为0.36mol/100g, 与Alg-COO–含量相差较大, XRD测试结果表明海带A中含有KCl, 说明在海带样品A中金属离子只有一部分与Alg-COO–结合, 在浸洗之前, 海带中的金属阳离子部分与无机阴离子结合,以无机盐的形式存在于海带中。
样品B中金属阳离子含量为0.27mol/100g, 与Alg-COO–含量0.22mol/100g相当, 我们可推断: 海带经去离子水浸泡及清洗之后, 在不存在其它无机盐的情况下, 海带中的金属阳离子大部分与Alg-COO–结合。根据通过ICP法测得的金属元素含量, 按公式(6)即可计算出海带样品B中海藻酸盐含量(Alg-COO–的摩尔质量为175g/mol)。

图2列出了海带样品B中各海藻酸盐的含量, 海藻酸盐总含量(∑M(Alg)n%)为59.0%, KAlg为海带中含量最多的海藻酸盐, 占总组成的37.7%, 其它依次为Ca(Alg)2、Mg(Alg)2、NaAlg、Sr(Alg)2, LiAlg的含量<0.0001%。
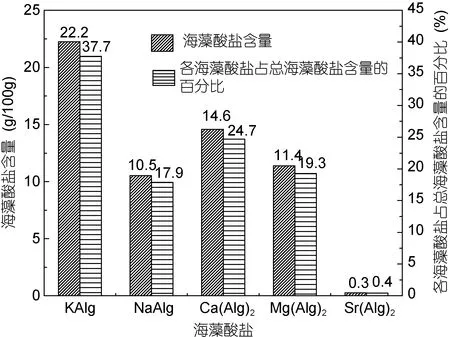
图2 海带样品B中海藻酸盐的含量及各海藻酸盐在总的海藻酸盐中的百分含量Fig.2 The mass fraction of alginates in the seaweed and percentage of each of the alginates in Laminaria japonica(Sample B)
2.3 失重率及浸出物分析
由公式(4)计算得出浸洗后海带失重率为44.5%,由公式(5)计算得浸出物含量为42.3%, 这可能是因为冷冻干燥过程中存在一定质量损失。对浸出物作XRD分析(图3), 通过比对标准XRD卡片(PDF#41-1476)可知, 浸洗前海带样品A(图3b)与浸出物(图3a)均有明显的KCl衍射峰, 说明海带中部分K元素以无机盐的形式存在, 图3a、b中的衍射峰与NaCl标准谱图不能对应, 其它钠盐的XRD标准卡片也不能与之对应, 可能存在两方面原因: 一是海带中Na的无机盐含量较少, 二是Na元素在海带中不以NaCl等无机盐形式存在, 而是与Alg-COO–结合成海藻酸钠存在于细胞间质中, 浸洗过程中Na元素以海藻酸钠的形式浸出。同样, 在XRD谱图3b中也没有发现Ca、Mg、Sr等元素的衍射峰。XRD谱图3c只是在2θ=20°左右有一个凸起的包状峰, 其它衍射峰消失, 这证明在经过充分浸洗之后, 海带样品B中无机盐被除去。

图3 X射线衍射图Fig.3 The X-ray diffraction
3 结论
淡干海带经浸洗实验及测试后证明, 浸洗可除去淡干海带中的无机盐成分, 淡干海带中金属元素总量由10.5g/100g下降到7.6g/100g, 其中一价元素K、Na含量下降较大, 均超过60%, Mg元素含量下降了31.6%, 其它二价元素Ca、Sr含量下降小于10%。经过去离子水浸洗之后的干海带, 失重率达44.5%。海藻酸盐总含量为59.0% (wt%), 各类海藻酸盐含量依次为: KAlg占22.2%, Ca(Alg)2占14.6%, Mg(Alg)2占11.4%, NaAlg占10.5%, Sr(Alg)2占0.3%; 浸洗之后Alg-COO–的相对含量并没有下降反而升高了1倍,海藻酸钠的提取产量有所升高。
王兵兵, 薛志欣, 付永强等, 2011. 海洋生物质纤维材料的开发与研究. 高分子通报, 12: 1—10
中华人民共和国卫生部, 2012. 食品国家安全标准 食品中污染物限量(GB2762-2012). 北京: 中国标准出版社, 2—7
纪明侯, 1997. 海藻化学. 北京: 科学出版社, 229—231
李晓川, 2012. 我国鲜海带加工的综合利用. 中国水产, 10:22—23
范 晓, 郑乃余, 张燕霞, 1988. 海带中褐藻酸盐组成的研究.海洋与湖沼, 19(1): 64—70
尚德荣, 宁劲松, 赵艳芳等, 2011. 海带中褐藻胶含量测定方法的建立. 食品科技, 36(8): 252—254
Gomez C G, Perez Lambrecht M V, Lozano J Eet al, 2009.Influence of the extraction-purification conditions on final properties of alginates obtained from brown algae (Macrocystis pyrifera). Int J Biol Macromol, 44(4): 365—371
Lee K Y, Mooney D J, 2012. Alginate: properties and biomedical applications. Prog Polym Sci, 37(1): 106—126
Murakami K, Yamaguchi Y, Noda Ket al, 2011. Seasonal variation in the chemical composition of a marine brown alga,Sargassum horneri(Turner) C. Agardh. J Food Comp Anal, 24(2): 231—236
Percival E, 1979. The polysaccharides of green, red and brown seaweeds: Their basic structure, biosynthesis and function.Br Phycol J, 14(2): 103—117
Whyte J N C, Englar J R, Borgmann P E, 1981. Compositional changes on freshwater leaching of the marine algaeNereocystis luetkeanaandMacrocystis integrifolia. Can J Fish Aquat Sci, 38(2): 193—198
Wijesinghe W A, Jeon Y J, 2012. Enzyme-assistant extraction(EAE) of bioactive components: a useful approach for recovery of industrially important metabolites from seaweeds: a review. Fitoterapia, 83(1): 6—12
