DNA指纹技术鉴定尼罗罗非鱼各家系父本
2014-03-19党广成季相山刘羽清付佩胜宋憬愚
党广成,季相山,王 慧,刘羽清,付佩胜,刘 洋,赵 燕,宋憬愚
1.山东农业大学,动物科技学院,山东 泰安 271018 2.大连海洋大学 生命科学与技术学院,辽宁 大连 116023 3.山东省淡水水产研究所,山东 济南 250117
亲子鉴定(Parentage testing)是现在法医学上判断亲子关系以及遗传特征的重要理论和技术,其理论依据是孟德尔的分离定律。按照这一原理,在没有基因突变和分型错误的前提下,子代的同对等位基因必定是一个来自父本,一个来自母本。因此,根据子代和母本的等位基因型可以有效的确认父本的等位基因类型,以多个DNA位点的等位基因累计检测,达到检测亲子关系的目的。亲子鉴定的方法有多种,其中以DNA指纹技术应用较为普遍。自Jefferys[1]博士首先将DNA指纹技术应用于法医鉴定以来,此方法很快在动物、植物父母本鉴定中得到广泛发展和应用。尤其是基于微卫星多态性的检测方法,使得亲子鉴定过程更加快速简单。
微卫星DNA是真核生物基因组重复序列中的主要组成部分,主要由串联重复单元组成,每单元长度在1~10bp之间,1个SSR的总长度可达几十到几百个bp。每个微卫星DNA都由核心序列和侧翼序列组成,其核心序列呈串联重复排列。侧翼DNA序列位于核心序列的两端,为保守的特异单拷贝序列,能使微卫星特异地定位于染色体常染色质区的特定部位[2]。微卫星产生是DNA复制和修复过程中与滑动错配或染色体减数分裂时姊妹染色单体不均等变换的结果。由于其数量多、在基因组内分布均匀、多态性信息丰富[3,4]、在单个位点基因呈共显性遗传、检测方法快速稳定、所需的DNA量少、易于自动化分析等优点,在DNA指纹技术中有其它遗传标记无法媲美的优势。Bowling等[5]利用微卫星位点鉴定出了马的亲本,William等[6]对两种比目鱼进行了亲本鉴定。在国内,张志和等[7]应用微卫星分型方法有效的确认了圈养大熊猫的亲缘关系,孙业良等[8]用9个微卫星位点从陶赛特羊的嫌疑父本中找出了其父本。
罗非鱼起源于非洲,属热带性鱼类,栖息于水体的中下层,是以水生植物为主的杂食性鱼类。其食性广,对环境适应性强,抗病性能好,群体产量高,肉味鲜美,国际市场需求量大,是联合国粮农组织(FAO)推荐的水产养殖中最重要的种类之一,并已成为可替代逐年短缺的鳕鱼等海洋优质鱼的“白色三文鱼”。目前,罗非鱼及其杂交种已成为全球重要的鱼类养殖品种。全球养殖罗非鱼的国家达100多个,我国是世界上主要的罗非鱼养殖国之一,年产量在100×104t以上。罗非鱼也是我国出口量最大的鱼类品种。然而,罗非鱼性成熟早、繁殖力强,当年养殖的罗非鱼未达到商品规格就能自然繁殖,从而造成养殖池塘中出现二代同“塘”的现象,使得养殖密度过大、养殖个体生长速度减慢、上市规格减小,养殖效益降低;且罗非鱼雄性生长速度显著快于雌性。因此,培育全雄罗非鱼苗种,发展罗非鱼全雄养殖,将显著提高罗非鱼养殖的经济效益,促进我国罗非鱼养殖业的健康快速发展。党广成等[9]研究发现,在罗非鱼性腺分化敏感期高温处理,可诱导其性逆转,有些家系雄性率甚至达90%以上。高温诱导正逐渐发展成为一种高雄,甚至全雄罗非鱼苗种的培育方法。为了筛选获得性逆转高温敏感家系,人们就需要建立大量的家系,在各家系系谱不是很清楚的情况下,非常有必要利用微卫星标记鉴定各家系的父母本。
罗非鱼良种培育始于30年前,由当时设于菲律宾的国际水生生物资源管理中心(ICLARM)选择以四个非洲品系(埃及、加纳、肯尼亚、塞内加尔)和四个亚洲养殖品系(以色列、新加坡、泰国、中国台湾)的尼罗罗非鱼为基础群,采用家系选育方法进行选育,该国际研究项目为Genetic Improvement of Farmed Tilapia,简称GIFT,中文译称为养殖罗非鱼的基因改良)。此后从该中心引入到其它国家的亲本种源均为尼罗罗非鱼的改良品系,引入中国时取其项目的缩写名称“GIFT”的中译名“吉富”作为该品系的名称,由此一直沿用至今。最初吉富品系罗非鱼引入中国源于1994年。引进吉富罗非鱼后,李思发等又在此基础上进行选育,成功培育了1个新的罗非鱼品种:“新吉富”罗非鱼。罗非鱼良种培育多数采用家系选育法,需要建立大量的家系,准确掌握其系谱资料,有时也需要借助亲子鉴定技术对其亲子关系进行鉴定。因此,筛选一些多态性的微卫星标记,建立罗非鱼微卫星指纹技术意义重大。
罗非鱼具有一种奇特的繁殖习性,雄鱼具有非常强的领地性,占领1个领地后,等待雌鱼的到来,雌雄鱼追尾后,雌鱼产卵,雄鱼立即排精,雌鱼立马将受精卵吸入口中,受精卵在口腔中孵化,雌鱼下颌突起,嘴呈半张开的样子,通过鳃腔不断张合、用水流使卵粒在口中不停翻动进行孵育。卵子在口腔中3-7天后即孵出仔鱼,此时的仔鱼仍不能独立生活,要待其卵黄囊全部吸收后才被雌鱼吐出来。这种特异的繁殖习性为建立家系提供了极大方便,每个雌鱼口腔相当于一个小的家系培养容器。
本文目的就是,首先评价6个微卫星标记的多态性,评价微卫星标记数量对累积非父排除率等的影响,评价已知一个双亲或双亲都未知的情况下的累积非父排除率,建立尼罗罗非鱼亲子鉴定技术,以期为培育罗非鱼良种和高雄性率苗种提供一些技术支撑。
1材料和方法
1.1实验材料
本实验材料取自山东省淡水水产研究所国家级尼罗罗非鱼原良种场,是该场于1998年从无锡淡水渔业研究中心购进的尼罗罗非鱼吉富品系繁殖、选育6代后的良种。利用20尾雌鱼对8尾雄鱼的配对方式构建罗非鱼家系,放养于18 m3的水泥池中,每隔5~7 d检查1次雌鱼口腔,若有卵即取出,标记家系号,同时剪取雌鱼(即家系母本)的鳍条,保存于酒精中用于提取DNA,繁殖结束后,剪取所有雄鱼的鳍条,保存于酒精中用于提取DNA。孵化的仔鱼养殖2~4个月后,取鳍条保存于酒精中用于提取DNA。
1.2 DNA的提取
分别选取F33、F34、F35、F36、F37、F52、F53、F55,8个家系的子代个体、各家系母本以及8个候选父本(编号S1―S8),采用标准的酚-氯仿提取法提取DNA。
1.3 DNA样品的检测和稀释
用722分光光度计测定各DNA样品的纯度和浓度,稀释至50 ng/μL。用1.0%琼脂糖凝胶电泳检测DNA片段的大小。
1.4 PCR扩增以及产物检测
通过查阅文献,得到6个片段大小在100~300bp之间的微卫星位点:UNH719、UNH846、GM435、GM459、GM558、GM024。设计相关引物(表1),梯度PCR检测出最适退火温度。
PCR采用15 μL反应体系:10×Taq buffer 1.5 μL,MgCl20.9 μL(2 mmol/μL),dNTP 1.2 μL(1.5 mmol/μL),上游引物0.5 μL(10 μmol/L),下游引物0.5 μL(10 μmol/L),Taq DNA 聚合酶0.2 μL(5 U/μL),DNA模板1 μL,剩余以水填补。PCR扩增程序:94℃预变性5 min;94℃变性40 s,退火40 s(见表1退火温度),72℃延伸40 s,30 个循环;72℃延伸5 min,4℃保存。12%的聚丙烯酰胺凝胶电泳检测PCR产物,银染法染色、显色后拍照。

表1 引物序列信息
1.5数据统计以及处理分析
对电泳结果进行分析,然后利用Cervus3.0分析计算各位点的等位基因数目、等位基因频率、多态性信息含量、排除率等相关数据。根据各位点的排除率计算累计排除率。计算采用Jamieson等[10]的方法:CPE=1-(1-PE1)(1-PE2)...(1-PEn)。并对各家系进行父权分析,得出置信度。
2结果
2.1各微卫星位点特征分析
利用cervus3.0统计分析各个微卫星位点的特征如表2。各微卫星位点的等位基因数在4~12之间,平均等位基因数为7.17。微卫星位点的观测杂合度在0.313~0.988之间,平均观测杂合度为0.696。微卫星位点的期望杂合度在0.318~0.794之间,平均期望杂合度为 0.638。平均多态信息含量为0.608,平均等位基因数为7.17。结果显示这六个位点具有较高的多态性。其中GM024、GM435、GM459、UNH846四个位点的杂合度和多态信息含量都大于0.5,呈现高度多态性。
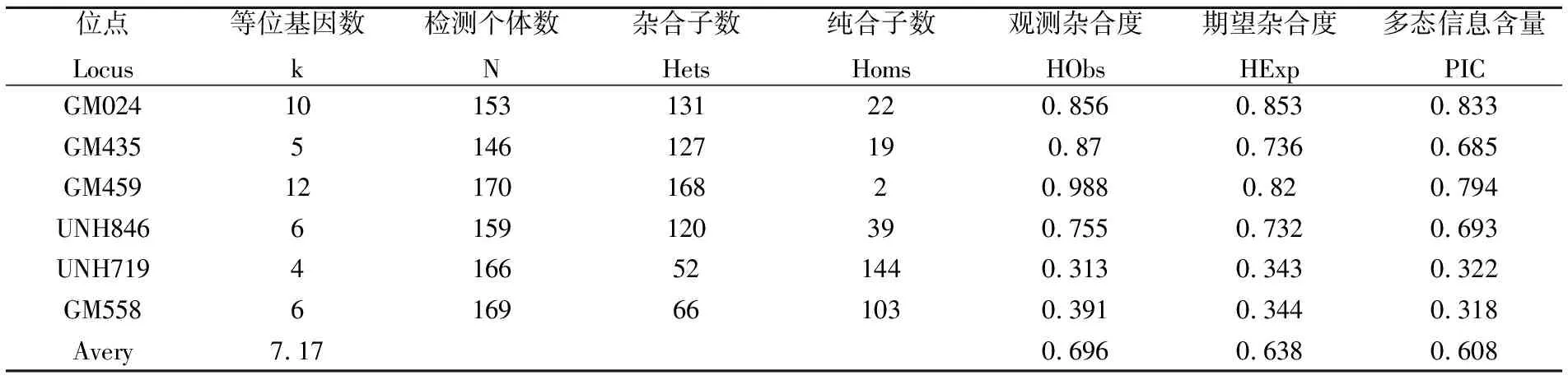
表2各微卫星位点特征
2.2排除率分析
各微卫星位点的排除率分析结果见表3,已知一亲本时,各个位点的非父排除率由0.301~0.818不等,排除率最高的两个微卫星标记是UNH719和GM558,排除率最低的微卫星标记是GM024,排除率仅为0.301。双亲未知时,各位点的累计排除率在0.113~0.69之间,排除率最高的微卫星标记是GM558。当已知一亲本时,5个位点的累积排除率就达到0.9793,6个位点时,达到0.9962。当双亲都未知时,6个位点的累积排除率也达到了0.9674。因此,利用这6个标记可很好地对各家系的父本进行鉴定。
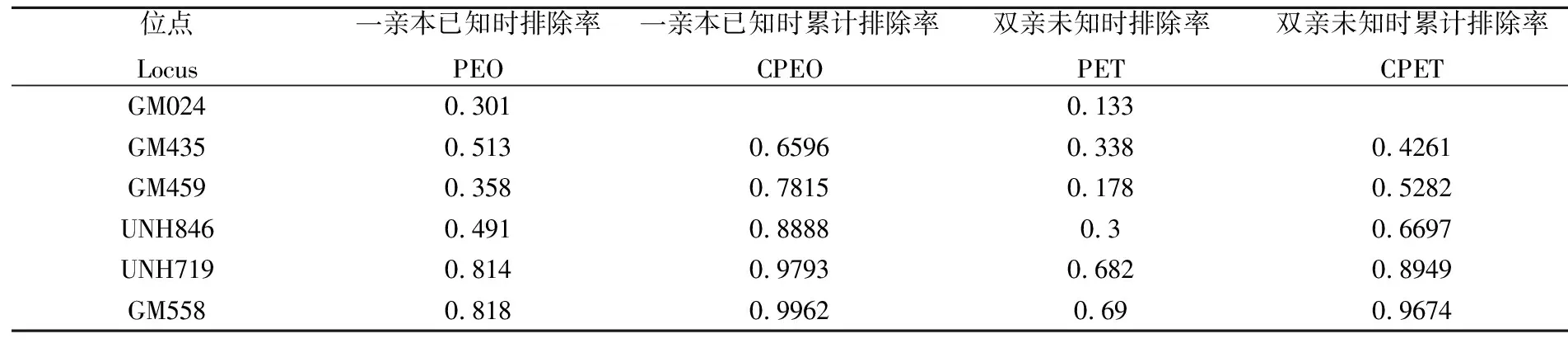
表3各微卫星位点排除率
2.3父权分析
利用cervus3.0对各家系进行父权模拟分析(Simulation of Paternity Analysis),根据LOD值确定各家系真正的父本,各家系父本鉴定结果见表4,其中F28,F30和F31的真正父本都是S1;F27和F29的真正父本都是S4;F52,F53和F55的真正父本都是S5,而其他后续父本没有真正的参与繁殖,这显示了有些雄鱼较为凶猛,获得了更多的繁殖机会。UNH719在F31家系中的电泳结果见图1,由图1可非常容易地看出F31家系的真正父本是S1。
Cervus3.0分析显示,母本已知时置信度为95%;母本未知时,置信度降至80%。由于尼罗罗非鱼各家系母本已知,因此利用这6个标记可较为准确地鉴定各家系父本。

表4尼罗罗非鱼亲子鉴定结果
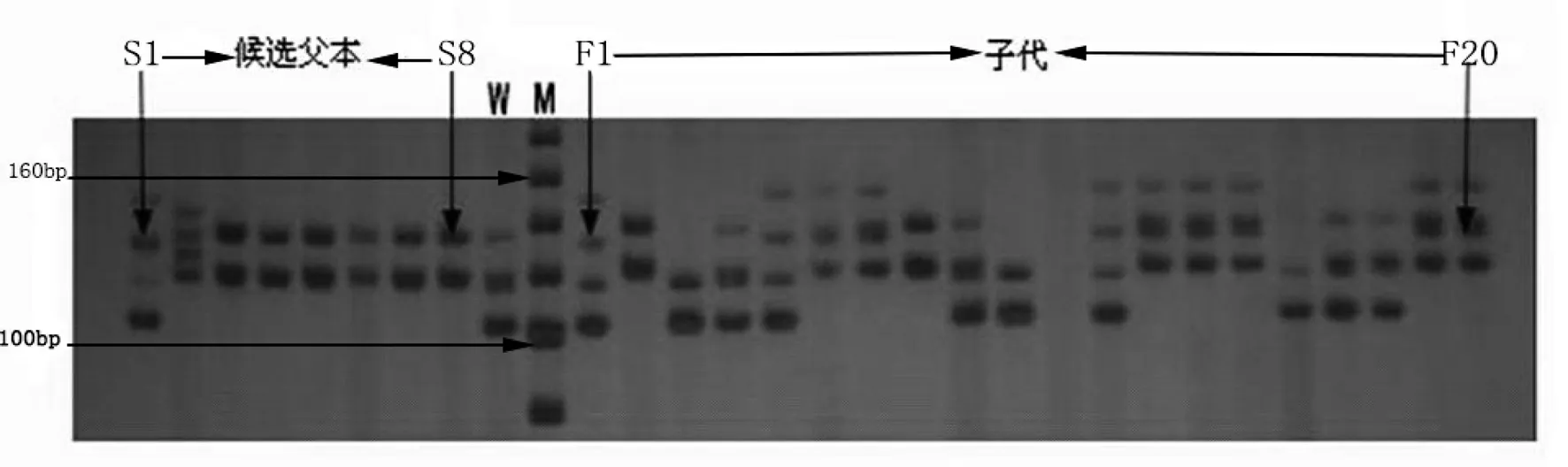
图1 UNH719在F31家系的聚丙烯酰胺凝胶电泳图
Fig.1PolyacrylamidegelelectrophoresisofUNH719locusinF31family
W:母本; M:marker; S1~S8: 候选父本; F1~F20: 子代
3 讨论
罗非鱼为一种中小型鱼,是世界水产业的重点科研培养的淡水养殖鱼类,且被誉为未来动物性蛋白质的主要来源之一。我国于1978年由长江水产研究所首次引进尼罗罗非鱼,1994年由上海水产大学引进了尼罗罗非鱼吉富品系,1999年无锡淡水渔业研究中心又从埃及引进尼罗罗非鱼5000尾,是引进规模最大的一次。除正式的报道外,我国可能实际引种的次数还要多。由于尼罗罗非鱼引种次数较多,引种的规模较大,未产生严重的遗传瓶颈。Wang等[11]利用RAPD技术分析显示,尼罗罗非鱼种内相似系数为0.827。本文利用6个微卫星标记分析7个家系个体的遗传多样性,结果显示,各位点的平均观测杂合度为0.696。但必须认识到罗非鱼种质问题的严重性,由于罗非鱼种类众多,且很容易种间杂交,并且杂种可育。如果在一个有两种或两种以上罗非鱼存在的水域引种,就很难保证繁殖的种群仍是纯种[12]。
罗非鱼具有一种奇特的繁殖习性,雄鱼具有非常强的领地性,雌鱼口腔含卵孵化,这种特异的繁殖习性为建立家系提供了极大方便,每个雌鱼口腔相当于一个小的家系培养容器。利用罗非鱼这一奇特的繁殖习性,我们将20尾雌鱼和8尾雄鱼混养于1个水泥池,成功地建立了8个尼罗罗非鱼家系。这8个家系的母本都是已知的,但需要鉴定其父本。
经典的亲子鉴定方法首先参照母子的基因型,按孟德尔遗传定律逐个检查各个可疑父亲的基因型。只要有一个基因座的基因型不合,该可疑父亲就被排除。最后所剩的惟一可疑父亲就被判定为真父。随着DNA微卫星标记研究的深入,逐渐将其引入系谱鉴定中来,利用微卫星位点的多态性,以多个微卫星位点在一定群体中各等位基因的频率为基础,计算排除概率来进行血缘鉴定和血缘控制。用微卫星 DNA进行亲子鉴定具有灵敏、稳定、准确、可靠等优点,因此用微卫星 DNA进行亲子鉴定在目前动物遗传育种研究中具有十分重要的理论和实践价值。利用微卫星鉴定亲子关系日趋广泛,10个以上的位点鉴定较多[13],但也不乏10个位点以下的[14]。本文应用DNA指纹技术,在母本已知时,通过六个微卫星位点验证了用微卫星进行父本鉴定的可行性,有效确认了8个尼罗罗非鱼家系的父本。其中母本已知时非父排除率为0.9962,双亲未知时非父排除率为0.9674,分别低于Selvamani等[15]利用鲍鱼幼体五个微卫星位点得出的非父排除率0.999和0.995。而Luís等[16]利用六个微卫星位点做马的亲本鉴定时,非父排除率最高达到99.6%。Fridolfsson等[17]利用三个多态性丰富的位点测得非父排除率达96%,与本文研究非父排除率结果相近。由于本实验母本已知。说明了在多态性丰富的情况下,十个以下的的微卫星位点也可以有效鉴定父本。
本实验研究得知,微卫星个数、母本是否已知以及置信度水平都会对鉴定产生影响。随着微卫星个数的增多,鉴定概率会更准确。母本已知也显然能够提高排除率。置信度水平虽然受软件限制,但较排除法等方法更加客观准确。当然基因分型、无效等位基因以及软件自身缺陷都可能对亲子鉴定造成影响。Inoue等[18]就曾分析指出无效等位基因频率高于5%的位点不可用于家系分析。至于其他影响因素,有待进一步验证和探究。
本文利用6个微卫星标记对8个家系的未知父本进行了鉴定,置信度和排除率都达到了较高的水平,表明利用本法可以有效地鉴定尼罗罗非鱼各家系的父本。对尼罗罗非鱼各家系的父本进行有效的鉴定,有利于尼罗罗非鱼(尤其高雄家系)优良遗传资源的保护,在尼罗罗非鱼的养殖推广和经济市场化方面有其独特的意义。
[1]Jefferys AJ, Wilson V, Thein SL. Hypervariable 'minisatellite' regions in human DNA [J]. Nature, 1985, 314: 67-73
[2] Botstein D, White RL, skolnick M,etal. Construction of a genetic linkage map in man using restriction fragment length polymorphisms [J]. Am J Hum Genet, 1980, 32: 3l4-331
[3]赵 燕,季相山,曾勇庆,等.花鲈微卫星标记分离及其多态性分析[J].动物学研究,2011,32:515-520
[4]梁宏伟,李 忠,罗相忠,等.基于微卫星标记的5个尼罗罗非鱼品系的遗传多样性分析[J].生物多样性,2009,17(1):82-87
[5] Bowling AT, Eggleston-Stott ML, Byrns G,etal. Validation of microsatellite markers for routine horse parentage testing [J]. Animal Genetics, 1997, 28: 247-252
[6] William HE, Marc DB, Ira RA,etal. Determination of relative survival of two stocked walleye populations and resident natural-origin fish by microsatellite DNA parentage assignment [J]. Can. J. Fish. Aquat. Sci, 2002, 59: 282-290
[7]张志和,沈富军,孙 姗,等.应用微卫星分型方法进行大熊猫父亲鉴定[J].遗传,2003,25(5):504-510
[8]孙业良,国 庆,任航行,等.用微卫星DNA技术进行绵羊亲子鉴定[J].安徽农业大学学报,2005,32(3):301-305
[9]党广成,刘羽清,付佩胜,等.高温诱导对尼罗罗非鱼性别分化及生长的影响[J].渔业科学进展,2011,32(5):32-37
[10] Jamieson A, Taylor SC. Comparisons of three probability formulae for parentage exclusion [J]. Animal Genetics, 1997, 28: 397-400
[11] Wang TQ, Li ZZ, Xia DQ. Analysis of the GenePolymorPhismofO.aureusandO.niloticusby Using RAPD[J]. Developmental and reproductive biology, 1999, 8: 19-24
[12]李学军,李爱景,彭新亮,等.我国罗非鱼的引种及种质资源保护[J].河南水产,2007,1:3-6
[13] Luikart G, Biju-Duval MP, Ertugrul O,etal. Power of 22 microsatellite markers in fluorescent multiplexes for parentage testing in goats (Capra hircus) [J]. Animal Genetics, 1999, 30:431-438
[14] Takenaka O, Kawamoto S, Takawaki H,etal. Polymorphic Microsatellite DNA Amplification Customized or Chimpanzee Paternity Testing [J]. Primates, 1993, 34(1): 27-35
[15] Selvamani MJ, Degnan SM, Degnan BM. Microsatellite genotyping of individual abalone larvae: parentage assignment in aquaculture [J]. Mar. Biotechnol, 2001, 3: 478-485
[16] Lu s C, Cothran EG, Oom MM. Microsatellites in Portuguese autochthonous horse breeds: usefulness for parentage testing [J]. Genetics and Molecular Biology, 2002, 25(2): 131-134
[17] Fridolfsson AK, Gyllensten UB, Jakobsson S. Microsatellite markers for paternity testing in the Willow warbler Phylloscopus tuochihs: high frequency of extra-pair young in an island population [J]. Hereditas, 1997, 126: 127-132
[18] Inoue M, Takenaka O. Japanese macaque microsatellite PCR primers for paternity testing [J]. Primates, 1993, 34(1): 37-45
