巧用“化合价升降法”配平氧化还原反应方程式
2014-03-18彭映丽衷明华
彭映丽 衷明华
(韩山师范学院化学系,广东 潮州 521041)
氧化还原反应方程式的配平方法较多,常见的方法有:化合价升降配平法、电子得失守恒配平法、待定系数配平法等。笔者在做题中体会到:只要掌握一般的标价原则,确定好配平方向,灵活运用好“化合价升降法“这一基本方法,便能解决中学化学中绝大多数的氧化还原反应方程式的配平问题。
一、化合价升降法配平氧化还原反应方程式的基本步骤
以C+HNO3(浓)—CO2↑+NO2↑+H2O为例:
1、标变价:正确标出反应前后变价元素的化合价。(注意:有机物中的H为+1价,O为-2价,C的化合价由物质的的元素化合价代数和为零来确定。)
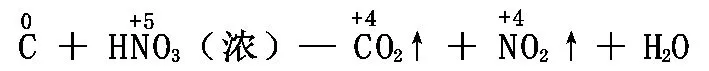
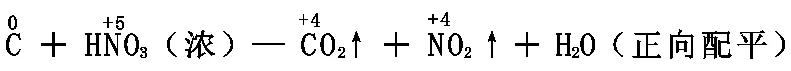
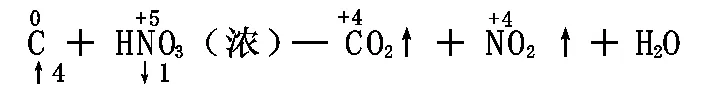
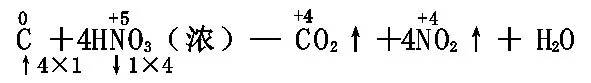
C+4HNO3(浓)— CO2↑+4NO2↑+2H2O
6、查守恒:检查反应前后是否满足质量守恒,对于离子氧化还原反应方程式,还要检查是否满足电荷守恒,最后将短线改为等号。
C+4HNO3(浓)= CO2↑+4NO2↑+2H2O
二、常见形式的氧化还原反应方程式的配平
1、一般化学方程式的配平
可先根据化合价升降相等配平含变价元素物质的化学计量数,再根据质量守恒配平其它物质的化学计量数。
例1,配平化学方程式:
□Cu2S+□HNO3(稀)=□Cu(NO3)2+□NO↑+□H2SO4+□H2O
[解析]化合价变化的元素有Cu、S、N,Cu2S为还原剂,HNO3为氧化剂,氧化剂、还原剂不属于同一种物质,可正向配平,即以正向变价元素的原子个数为准来表示价态变化。
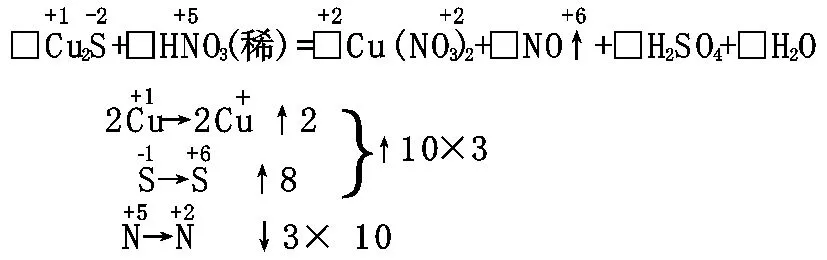
在方程式中,Cu、S元素的化合价都升高,N元素化合价降低。由上可得,在Cu2S的化学计量数为3,HNO3的化学计量数为10,进而确定氧化产物Cu(NO3)2、H2SO4的化学计量数分别为6和10;再根据质量守恒定律,配平其它物质得(注意:要把未变价的HNO3加上):
3Cu2S+22HNO3(稀)=6Cu(NO3)2+10NO↑+3H2SO4+8H2O
例2,配平化学方程式:
□K2Cr2O7+□HCl(浓)=□KCl+□CrCl3+□Cl2↑+□H2O
[解析]化合价发生变化的元素有Cr和Cl,但盐酸中的Cl元素有三个去向,不易从反应物配平,应从生成物配平,即逆向配平。
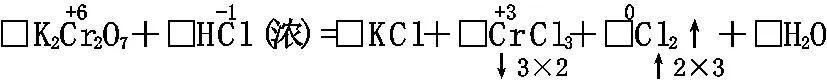
K2Cr2O7+14HCl(浓)=2KCl+2CrCl3+3Cl2↑+7H2O
2、缺项方程式的配平
所谓缺项方程式,即某些反应物或生成物在方程式中未写出,它们一般为水、酸、碱,这类方程式的配平,不仅要配平化学计量数,还要写出未知物的化学式。
配平的方法是:先根据化合价升降法配平含变价元素物质的化学计量数,再通过比较反应物和生成物,观察增减的原子或原子团来确定未知物,并配平。
例3,配平化学方程式:
□H2O2+□Cr2(SO4)3+□____=□K2SO4+□K2CrO4+□H2O

化合价发生变化的元素有O、Cr,由上可得,在H2O2前配3,根据质量守恒,分别在K2SO4和K2CrO4前配3和2,初步配平得:
3H2O2+Cr2(SO4)3+□____=3K2SO4+2K2CrO4+□H2O
因为方程式右边有K+,所以左边反应物中必有K+;而K+在水、酸、碱三类物质中只可能是KOH,故所缺物质为KOH;再根据质量守恒配平其它物质的化学计量数,即:
3H2O2+Cr2(SO4)3+10KOH=3K2SO4+2K2CrO4+8H2O。
3、离子方程式的配平
可先根据化合价升降相等配平含变价元素物质的化学计量数,再根据电荷守恒、质量守恒配平其它物质的化学计量数。
例4,配平所给的离子方程式:
□C2O42-+□MnO4-+□H+=□CO2↑+□Mn2++□H2O
[解析]从化合价变化可知:氧化剂、还原剂不属于同一种物质,应正向配平。
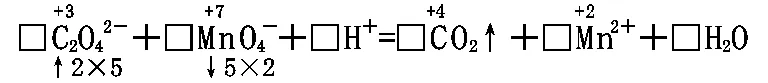
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O。
