南充市钩体患者血清IFN-γ、TNF-α、IL-10动态观察
2014-03-18张廷君周仲辉刘凤君王贵霞林家福
张廷君,周仲辉,曾 跃,刘凤君,王贵霞,林家福
(川北医学院附属医院感染科,四川 南充 637000)
钩端螺旋体病是由致病性钩端螺旋体(简称钩体)所致的急性动物源性传染病,该病在全世界范围内流行,我国大部分省、市、自治区均有本病的报道[1]。然而,钩体病的发病机制至今仍未被阐明,随着对该病的深入研究,细胞因子在钩体致病过程中的作用越来越受到各地研究者们的重视,体外研究[2-3]发现钩端螺旋体可以促进人体外周血细胞分泌一些细胞因子,其中IFN-γ、TNF-α、IL-10三种因子均有大量表达。而另有学者从钩体病患者血清中也检测到这几种细胞因子的升高[4],但目前为止,动态连续观察研究钩体病患者血清中IFN-γ、TNF-α、IL-10细胞因子的报道甚少。本研究的目的在于了解钩体病人血清中细胞因子IFN-γ、TNF-α、IL-10在该病的败血症期、器官损伤期及恢复期的变化规律,证实细胞因子IFN-γ、TNF-α、IL-10在钩体清除及致病过程中的作用,为临床及科研提供科学依据。
1 材料与方法
1.1 材料
1.1.1 血清标本 31例临床诊断钩体病患者标本均于2011年取自南充市仪陇县各医院及川北医学院附属医院,根据采取患者血清标本时患者所处的临床分期即钩体败血症期、器官损伤器、恢复期,将相应标本分为早期、中期、晚期三组:起病后3 d内为早期,起病后3~10 d或生化检查表明处于器官损伤期的为中期,好转出院(并且病程大于10 d)时采集的最后一次血为晚期标本[1]。对照标本共10例,男性5例,女性5例,平均年龄(48.20±10.39)岁,均为钩体病流行地区健康体检者静脉血血清。
1.1.2 主要试剂 无菌兔血清及钩体标准株购自四川省疾控中心,EMJH培养基购自BD公司,钩体基因组DNA提取试剂盒购自上海捷瑞生物工程有限公司,2*Taq PCR MasterMix购自TIANGEN BIOTECH公司,人IFN-γ、TNF-α、IL-10酶联免疫试剂盒购自成都微克生物技术有限公司。
1.2 方法
1.2.1确立诊断 对31例临床诊断的患者的血清分别用血清显微凝集试验(MAT)(委托四川省疾控中心检测)、聚合酶链反应(PCR)、钩体分离培养三种方法进行检测,据钩端螺旋体病诊疗指南,三种检测方法任一阳性均可以确定为实验室诊断患者。
1.2.2检测细胞因子 采用双抗夹心酶联免疫吸附法(ABC-ELISA)检测血清IFN-γ、TNF-α、IL-10浓度(分别采用人IFN-γ、TNF-α、IL-10酶联免疫试剂盒)。
1.3 统计学分析
对所有实验数据首先进行正态性检验,然后用SPSS v16.0统计软件处理,各期病例组与正常人的比较用一维方差分析Dunnett检验,各病例组之间两两比较用双因素重复测量设计的方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 实验室诊断病例结果
钩体分离培养、MAT、PCR检测确定为实验室诊断病例24例,其中MAT法确诊2例,PCR法确诊24例,分离培养确诊0例,其中MAT法和PCR法均阳性2例;男性12例,女性12例。
2.2 患者各期血清及正常对照血清中IFN-γ、TNF-α、IL-10的均值(表1)
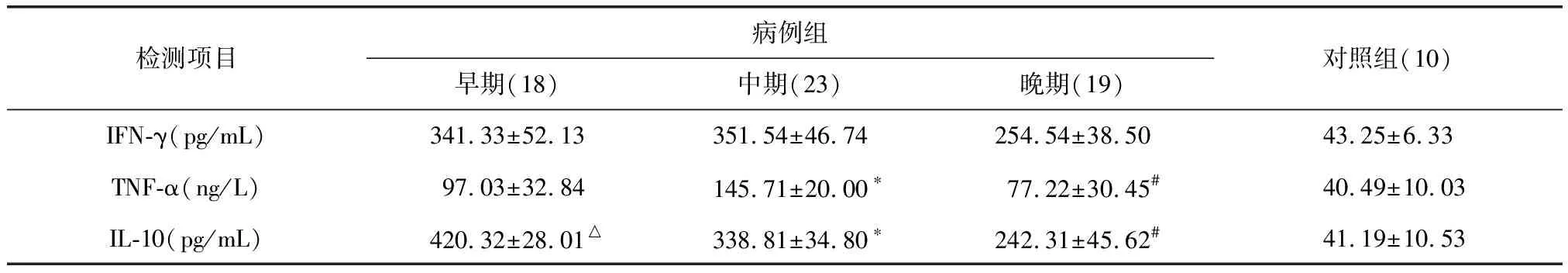
表1 早、中、晚期血清中IFN-γ、TNF-α、IL-10水平均数
*P<0.05,与早期组比较;#P<0.05,与中期组比较;△P<0.05,与晚期组比较。
因部分患者入院时已经处于病程中期,故早期标本数较中期少;部分患者未好转则自动离院,故晚期标本数较中期少。
2.3 各期血清IFN-γ水平比较
早期、中期患者血清中IFN-γ一直处于较高的水平,到晚期略有下降,但三组血清IFN-γ均明显高于对照组(P<0.05);两两比较早、中、晚期三组血清IFN-γ水平无差别(P>0.05)。
2.4 各期血清TNF-α水平比较
各期患者血清与对照组比较:早、中期TNF-α水平明显高于正常人(P<0.05),晚期血清TNF-α水平与正常人无差别(P>0.05)。病人早期血清中可检测到较高水平的TNF-α,到中期达最高,晚期明显降低。三期两两比较结果显示:中期TNF-α水平明显高于早期和晚期(P<0.05),早期与晚期无明显差异(P>0.05)。
2.5 各期血清中IL-10水平比较
各期患者血清与对照组比较显示:病例组血清中的IL-10均较正常人高,(P<0.01)。患者三期血清中IL-10水平由早期到晚期逐渐下降,两两比较结果显示差异均有统计学意义(P<0.05)。
3 讨论
本研究中所取临床诊断的31例标本中,实验室确诊24例,其中MAT法确诊2例,PCR法确诊24例,分离培养确诊0例,其中MAT法和PCR法均阳性2例。PCR法检测阳性率最高,血液分离培养阳性率最低,其可能的原因为:其一,接种时只取两滴血液,血液中的活菌太少;其二,血液中的血浆,胶质,蛋白质等成分影响了观察效果。从检测阳性率的角度看,本实验中PCR法阳性率最高,其快速、易操作、经济等优点均有利于该方法的推广。尽管分离培养法阳性率低,但是该方法能培养出病原菌,丰富病原库的作用是其他任何一种检测方法都无法取代的。本研究采用了三种方法检测临床诊断的病例进行病原学诊断,一定程度上提高了诊断的阳性率。
细胞因子IFN-γ、TNF-α、IL-10所介导的免疫反应及其在免疫反应中引起的瀑布效应在机体清除病原体和造成机体损伤过程中起着至关重要的作用,本实验通过检测24例实验室确诊患者早、中、晚三期血清中IFN-γ、TNF-α、IL-10的水平,结果发现三种因子呈现出各自的变化规律。
IFN-γ也叫免疫干扰素,具有较强的调节免疫和抗细胞增殖作用[5],在细胞免疫清除病原体的过程中起着重要的作用。Vernel-Pauillac等关于钩体的体外研究表明[2,4]致病性钩体可以激活外周血中T淋巴细胞,并产生相关Th1型细胞因子IFN-γ。时曼华等通过动物实验研究推测钩体的清除可能和其他细胞内感染细菌的清除一样与细胞免疫有关[6]。本研究发现在钩体病患者早期、中期晚期血清中的IFN-γ水平均明显高于对照组。表明在整个病程中细胞免疫处于持续活跃状态。四川省研究者对大量钩体病患者进行长时间观察发现恢复期的病人仍然可以长时间的排出钩体[7],提示虽然患者的症状缓解,病情恢复,但体内的钩体并没有完全清除,这可能也是到了疾病的晚期,血清中的IFN-γ水平依然处于高水平的原因。IFN-γ在钩体病患者血清中明显升高且随着病程的进展所表现的规律,提示IFN-γ在钩体的清除及病情的进展中有重要的意义,其具体的作用机制还需要进一步探索。
TNF-α是免疫反应中重要的促炎性细胞因子,具有多种生物学活性,它在全身炎症反应及早期器官损伤中发挥着关键至关重要的作用[8]。既往研究[3]发现钩体的脂多糖(lipopolysaccharide,LPS)和糖脂蛋白(glycolipoprotein,GLP)能刺激淋巴细胞产生过量的肿瘤坏死因子α(tumor necrosis factor α,TNF-α)。Chierakul通过动物实验[9]发现仓鼠被钩体感染后最早升高的促炎细胞因子是TNF-α,Tajiki等[10]报道16例钩体病患者中4例出现器官损害者血清TNF-α水平明显升高。本组实验监测的钩体病患者早期血清中的TNF-α水平较对照组明显升高,中期的TNF-α水平较早期的高,到恢复期则与正常人的水平无明显差异,与上述研究结果一致。可能是因为当钩体进入人体并刺激人体产生高水平的TNF-α,人体通过TNF-α调节免疫反应清除病原体;同时,TNF-α引起的炎症反应也导致了人体组织、器官的损伤,从而引发各种临床表现。在恢复期,TNF-α恢复到正常水平,炎症反应停止,各器官功能也恢复正常。提示TNF-α在钩体致病的过程中起着重要的作用,而且,在钩端螺旋体病发生发展过程中,TNF-α水平的高低可能与疾病的严重程度相关。
IL-10是一种有效的抗炎性物质[11],具有较强的抗炎症能力,抑制细胞免疫,介导体液免疫并消灭病原体[12]。Diament等[13]通过体外实验发现钩体的糖脂蛋白能引起IL-10水平升高。Marinho等[14]研究发现感染钩体的仓鼠体内的IL-10水平较对照组明显升高。本实验通过检测不同时期临床标本发现钩体病患者早期血清中IL-10处于较较高的水平,随着病情的进展,中晚期血清中的IL-10水平有逐渐下降的趋势,但晚期IL-10水平仍然明显高于正常人。可能是因为在钩体病的病程早期,机体内的钩体数量最多,由于机体的免疫反应及使用抗生素消灭钩体,到晚期大部分患者体内钩体被清除,但体内仍可能残留有钩体。四川省研究者对97例钩体病人进行临床观察发现在病程的晚期,仍然有14.43%钩体病患者能够长时间的排出钩体[8],这提示IL-10及其介导的体液免疫在钩体的清除中起着重要作用,可能在恢复期体液免疫占主要地位。
总之,本研究通过三种不同的检测方法检测临床诊断的钩体病患者,以取得实验室确诊依据,证实了PCR法阳性率最高,值得临床推广;通过动态研究钩体病患者血清中代表细胞免疫的Th1型细胞因子IFN-γ、促炎性细胞因子TNF-α及代表体液免疫的Th2细胞因子IL-10在病程中的变化规律,从临床的角度证实了IFN-γ、IL-10和TNF-α可能在机体清除钩体及疾病的发展过程中均起着重要的作用,其具体的作用机制尚需进一步研究。
【参考文献】
[1]杨绍基,任 红.传染病学[M].北京:人民卫生出版社,2008:246-252.
[2]Klimpel GR,Matthias MA,Vinetz JM.Leptospira interrogans activation of human peripheral blood mononuclear cells:preferential expansion of TCR γδ+T cells vs TCR αβ+T Cells[J].J Immunol,2003,171(3):1447-1455.
[3]Srikram A,Wongratanacheewin S,Puapairoj A,et al.Analyses ofvaccination protocols for Leptospira interrogans serovar autumnalis in hamsters[J].Am J Trop Med Hyg,2008,79(5):779-786.
[4]Vernel-Pauillac F,Merien F.Proinflammatory and immunomodulatory cytokine mRNA time course profiles in hamsters infected with a virulent variant of Leptospira interrogans[J].Infection and Immunity,2006,74(7):4172-4179.
[5]吕梅冰.IFN-γ的临床研究应用进展[J].广东药学院学报,2000,16(3):221-223.
[6]时曼华,蒋秀高.五十年来中国钩端螺旋体病流行病学研究进展[J].中华流行病学杂志,2000,21(3):228-230.
[7]虎晓眠,尹 文.危重病患者多器官功能障碍综合征细胞因子变化的意义[J].中国急救医学,2001,21(12):683-685.
[8]周光炎.免疫学原理[M].上海:上海科学技术出版社,2007:40-48.
[9]Chierakul W,de Fost M,Suputtamongkol Y,et al.Differential expression of interferon-gamma and interferon-gamma-inducing cytokines in Thai patients with scrub typhus or leptospirosis[J].Clin Immunol,2004,113(2):140-144.
[10]Tajiki H,Salomao R.Association of plasma levels of tumor necrosis factor alpha with severity of disease and mortality among patients with leptospirosis[J].Clin Infect Dis,1996,23(5):1177-1178.
[11]言 慧,黄树其.白介素10的临床应用研究[J].生命的化学,1999,19(4):192-195.
[12]周光炎.免疫学原理[M].上海:上海科学技术出版社,2007:82-89.
[13]Diament D,Brunialti MK,Romero EC,et al.Peripheral Blood Mononuclear Cell Activation Induced by Leptospira interrogans Glycolipoprotein[J].Infection and immunity,2002,70(4):1677-1683.
[14]Marinho M,Oliveira-Júnior IS,Monteiro CM,et al.Pulmonary disease in hamsters infected with Leptospira interrogans:histopathologic findings and cytokine mRNA expressions[J].Am J Trop Med Hyg,2009,80(5):832-836.
