以STAT3为靶标的抗肿瘤药物高通量筛选模型的建立和应用
2014-03-17潘丽张宁牛国君孟晶刘祥杨诚
潘丽 张宁 牛国君 孟晶 刘祥 杨诚
(1.天津科技大学生物工程学院,天津 300457;2.南开大学药学院,天津 300071;3.天津国际生物医药联合研究院,天津 300457;4.南开大学生命科学学院,天津 300071)
以STAT3为靶标的抗肿瘤药物高通量筛选模型的建立和应用
潘丽 张宁 牛国君 孟晶 刘祥 杨诚
(1.天津科技大学生物工程学院,天津 300457;2.南开大学药学院,天津 300071;3.天津国际生物医药联合研究院,天津 300457;4.南开大学生命科学学院,天津 300071)
旨在建立稳定可靠的以转导与转录激活子(STAT3)为靶标的抗肿瘤高通量筛选模型,应用该模型筛选潜在的抗癌药物。利用基因重组、蛋白表达纯化技术,获得STAT3目的蛋白,使用酶联免疫吸附法(ELISA)进行高通量药物筛选,将筛选出的抑制剂在细胞水平上利用MTT比色法测定化合物对癌细胞增殖的影响。结果显示,成功构建表达载体pET-28a-STAT3;所建立的模型稳定可行,可用于以STAT3为靶标的抗肿瘤药物的高通量筛选;用该模型对8 248个样品进行筛选,在500 μmol/L药物浓度下,化合物MDC6抑制率为92%,另外,进行IC50值的测定时,分子水平上最低达到3.37 μmol/L,在细胞水平上可达到15.92 μmol/L。建立的高通量药物筛选模型,具有操作方便、成本低、结果稳定等特点,可用于STAT3抑制剂的大规模筛选。
STAT3 靶点 高通量模型 ELISA
STAT3(Signal Transducer and Activator of Transcription 3)为STAT家族中的一员,是细胞因子及生长因子受体的信号转导器和转录激活器,其发挥的主要功能是将细胞质内的信号转导到细胞核内,并与可调节重要生化过程的特异性DNA启动子序列结合,调控这些基因的表达[1]。
STAT3在机体内多种细胞和组织中都有表达,对正常细胞的生存、增殖、分化、凋亡均具有重要
的调节作用。正常生理状态下,STAT3的活化快速、短暂且被精确调控,而在多种肿瘤细胞,如肺癌、乳腺癌[2]、恶性黑色素瘤、多发性骨髓瘤、淋巴瘤[3]、前列腺癌、卵巢癌、脑瘤、结肠癌[4]和各种白血病中,均发现由于失去对STAT3的精确调控,导致STAT3在这些肿瘤细胞中得到高表达[5],并被持续性激活,因而不断促进与细胞增殖、分化、凋亡、血管生成等有关基因的转录[6,7],最终促进肿瘤的发生和发展。
当细胞因子或生长因子与细胞膜上的受体结合后,JAKs与受体胞浆区域的JAKs结合位点结合后发生酪氨酸磷酸化而活化,JAKs磷酸化受体上的酪氨酸位点,使受体能够聚集胞浆内的STAT3,STAT3通过SH2区域将STAT补位到受体上的酪氨酸位点,JAKs能使STAT3 705位酪氨酸发生磷酸化,两个磷酸化的STAT3形成二聚体移至细胞核,可与特定的DNA序列结合,进而调节靶基因的转录[8,9]。Haan等[10]依据STAT3 SH2结构域的一段氨基酸序列合成肽段Biotion-bA-PGSAAPpYLKTKFI,采用ELISA方法验证肽段和STAT3 SH2区域形成二聚体,进而说明两个磷酸化的STAT3可以通过SH2区域形成二聚体。
随着分子生物学技术的发展,自动化技术和计算机技术的进步,检测技术的日趋灵敏,产生了多种分子细胞水平的药物筛选模型,降低试验试剂和化合物的用量,减少试验成本,推进药物筛选的进程。STAT3近年来成为研究的热点,本研究根据STAT3形成二聚体的性质,建立以STAT3为靶标的抗肿瘤高通量筛选模型,并应用该模型寻求能够阻断STAT3形成二聚体的特异性强、高效、毒副作用小、成本低的抑制剂,用来作为抗癌药物的先导化合物,并在细胞水平上利用MTT法测定所筛选出化合物对肝癌细胞增殖的影响,最后对化合物进行进一步的优化和验证,旨在研发新的抗癌类药物,为癌症的治疗带来新的希望。
1 材料与方法
1.1 材料
大肠杆菌菌株DH5α,BL21(DE3),原核表达载体pET-28a均为本实验室保存。PfuDNA聚合酶、限制性核酸内切酶、T4 DNA连接酶购自Fermentas公司;Biospin质粒DNA小量提取试剂盒及琼脂糖凝胶DNA回收试剂盒购自Bio Flux;F96 MAXISORP—Nunc Immuno Plate(型号442404)、抗His标签鼠单克隆抗体及HRP标记山羊抗小鼠Ig G抗体购自Thermo Fisher;牛血清蛋白(BSA)和链霉亲和素购自上海生工生物工程有限公司;二甲基亚砜(DMSO)等化学试剂为市售分析纯。肽段底物(Biotion-bAPGSAAPpYLKTKFI)由吉尔生化有限公司合成。ÄKTA FPLC蛋白纯化系统购自GE Healthcare;Multiskan FC 酶标仪购自Thermo fisher scientific。
1.2 方法
1.2.1 质粒构建 由GenBank获取小鼠STAT3(127AA-722AA)[11,12]序列(BC003806.1),设计上游引物:5'-AAGGATCCGGCCAGGCCAACCAC-3'(酶切位点BamHⅠ),下游引物:5'-CCCTCGAGCTAGTCAATGGTATTGC-3'(酶切位点XhoⅠ)。将STAT3的PCR产物及载体pET-28a都分别用BamHⅠ和XhoⅠ双酶切,将PCR产物和载体的酶切产物进行回收,再用T4 DNA连接酶进行酶连,转化到大肠杆菌DH5α中,重组质粒的提取、酶切、PCR以及琼脂糖凝胶电泳检测鉴定插入片段的正确性。
1.2.2 蛋白表达、纯化和鉴定 将含有目的基因的重组单克隆接种于含100 μg/mL卡那霉素的5 mL LB培养液中,37℃培养过夜。次日将培养好的菌液转接于800 mL含100 μg/mL卡那霉素的LB培养基中,37℃培养至OD600≈0.6,将培养液温度降到16℃后加入终浓度为0.4 mmol/L的诱导剂IPTG诱导蛋白表达,培养18 h。4℃ 5 000 r/min离心30 min,弃上清,加25 mL悬菌缓冲液(25 mmol/L Tris,pH8.0,300 mmol/L NaCl,10%甘油)将菌体悬浮,高压细胞破碎仪破菌后,4℃ 15 000 r/min离心,取上清过Ni2+-NTA琼脂糖柱,梯度咪唑冲洗蛋白,浓缩蛋白至1 mL后换溶液(20 mmol/L Tris,pH8.0,200 mmol/L NaCl,5%甘油,2 mmol/L DTT,1 mmol/L EDTA)过Superdex 200。将纯化得到的蛋白进行蛋白免疫印记杂交试验。
1.2.3 抑制剂筛选方法 酶联免疫吸附法:(1)用100 μL的链霉亲和素包被NUNC 96孔板,16℃过夜。(2)次日弃去板上剩余的链霉亲和素溶液,用
PBST溶液(1×PBS,pH7.4,0.05% Tween 20)洗3次后,加入200 μL PBST溶解的BSA封闭37℃ 2 h。(3)弃去孔中剩余的封闭液,加入100 μL肽段底物溶液37℃孵育1 h。(4)弃去孔中未结合的底物溶液,用PBST溶液清洗96孔板3次后加入100 μL蛋白溶液,37℃孵育1 h。(5)弃去未结合的蛋白溶液,PBST溶液清洗96孔板3次后加入100 μL用PBST+1%BSA溶液稀释的一定浓度的抗His标签鼠单克隆抗体,37℃孵育1 h。(6)弃去未结合的抗His标签鼠单克隆抗体溶液,用PBST溶液清洗96孔板4-5次,然后加入100 μL用PBST+1%BSA溶液稀释的一定浓度的HRP标记山羊抗小鼠Ig G抗体,37℃孵育1 h。(7)弃去未结合的HRP标记山羊抗小鼠Ig G抗体溶液,加入100 μL底物缓冲液(0.2 mol/L 醋酸钠,pH5.0)、500 μL TMB溶液和32 μL 0.75% H2O2的混合溶液37℃孵育15-30 min,然后加入100 μL浓度为2 mol/L的H2SO4终止反应,最后用Multiskan FC 酶标仪检测450 nm处的吸光值。1.2.4 高通量药物筛选模型的优化、评价和应用 使用酶联免疫吸附法摸索优化筛选条件,确定使用BSA、肽段底物、蛋白浓度以及抗His标签鼠单克隆抗体、HRP标记山羊抗小鼠Ig G抗体的用量,建立稳定的筛选体系。对8 248种药物进行筛选。针对抑制率80%以上的药物进行复筛,并测定药物对蛋白底物相互作用抑制的IC50值。
计算下列模型评价指标:
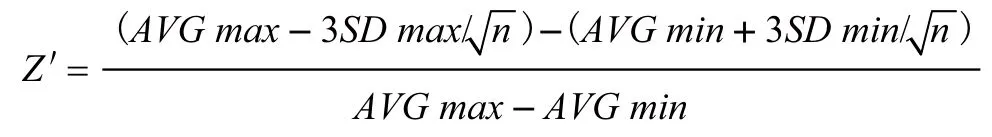
Z':统计学指标,Z'≥0.5信噪比大数据重复性较好,比较优秀的药物筛选体系。AVGmax:最大平均值;AVGmin:最小平均值;SDmax:最大标准差;SDmin:最小标准差;n:孔数。
1.2.5 药物筛选 初筛样品8 248个,采用1 μL纯度为95%的DMSO作为阴性对照组,不加目的蛋白换为加入相同体积的缓冲液为阳性对照组,使用96孔板进行药物筛选计算药物对多肽底物和目的蛋白相互作用的抑制率公式:
抑制率=(阴性对照组-试验组)/(阴性对照组-阳性对照组)×100%
对抑制率大于80%的样品进行复筛。复筛时将样品从2 mmol/L进行梯度稀释,稀释10-20个梯度,分别检测和计算每个浓度的抑制率,以浓度的对数值为横坐标,抑制率为纵坐标作图,拟合求得IC50。1.2.6 MTT比色法[13]测定所筛选化合物对肝癌细胞作用 (1)将处于对数生长期的肝癌细胞进行稀释并分装到96孔板中,每孔100 μL,96孔板最后一列只加灭过菌的PBS溶液作为对照测量孔。(2)将96孔板放在细胞培养箱(温度37℃,5% CO2),加入待测药物,放置在细胞培养箱(37℃,5% CO2)中培养16-48 h,在倒置显微镜下进行观察。(3)呈色:向各孔中加入20 μL的MTT溶液(浓度为0.5%),放回细胞培养箱(37℃,5% CO2)继续培养,使MTT进入细胞并发生反应,约4 h后终止培养,小心将孔内的培养液吸出弃掉。(4)向每孔中加入150 μL纯度为95%的DMSO,振动板5-10 min。(5)使用酶标仪测量490 nm处每个孔溶液的吸光值。
2 结果
2.1 目的基因的克隆以及目的蛋白的表达纯化
构建的表达载体经BamHⅠ和XhoⅠ双酶切电泳结果与预期相符,插入DNA片段与目的基因实际大小(1 788 bp)一致,测序结果表明,STAT3(127-722AA)基因序列和插入载体的方向均正确。重组质粒转入BL21(DE3)菌株,IPTG诱导目的蛋白大量表达。SDS-PAGE分析和免疫印记分析如图1所示。
2.2 药物筛选模型的建立和优化
2.2.1 BSA浓度梯度对筛药体系的影响 设置不同的链霉亲和素的浓度梯度及BSA溶液浓度梯度,初步设定底物肽段浓度为5 μg/mL,蛋白浓度为5 μg/mL,抗His标签鼠单克隆抗体浓度为0.5 μg/mL,HRP标记山羊抗小鼠Ig G抗体浓度为0.5 μg/mL,测量450 nm处吸光值,结果(图2)显示,包被上5 μg/mL的链霉亲和素后,随着封闭液浓度的增大,数值不断地减小,BSA浓度为1%时效果最好,所
以选取1% BSA作为封闭液。
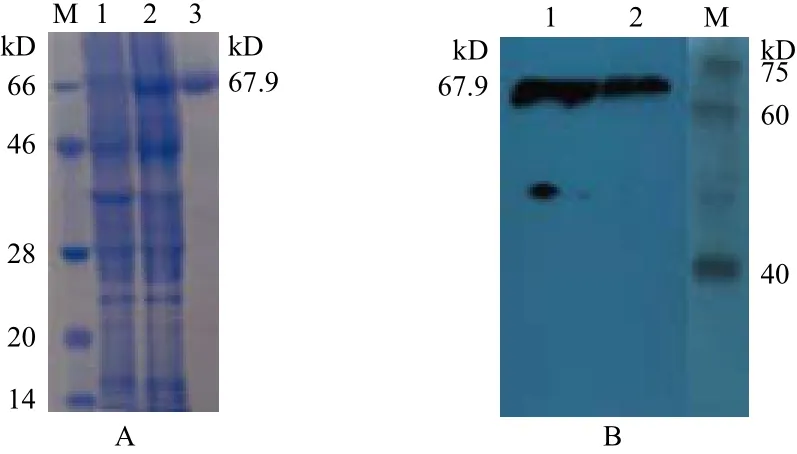
图1 SDS-PAGE分析(A)和免疫印记分析(B)
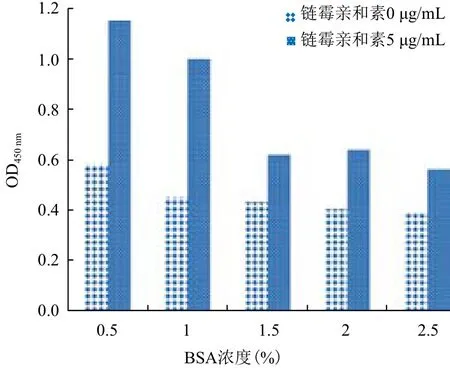
图2 链霉亲和素和BSA浓度梯度的影响
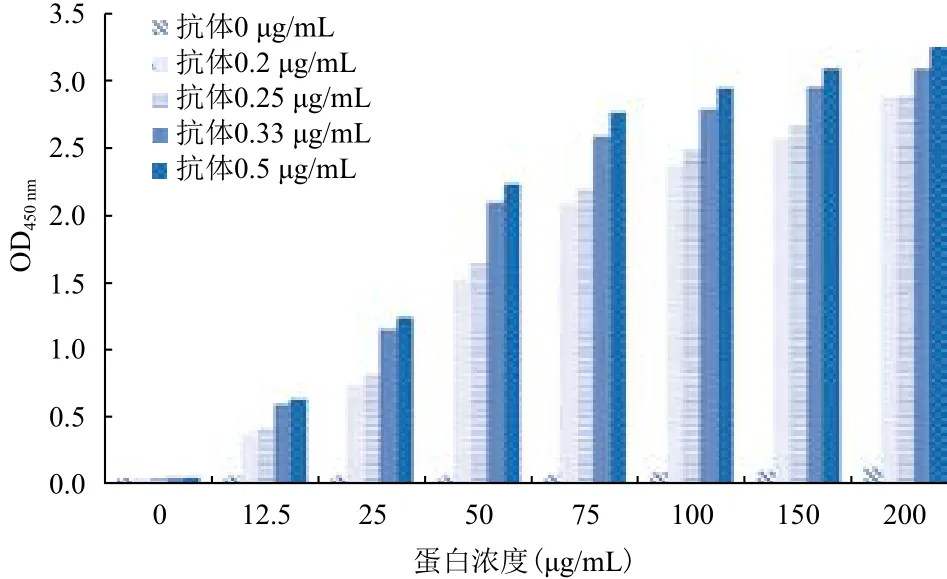
图3 蛋白浓度和抗His标签鼠单克隆抗体浓度梯度的影响
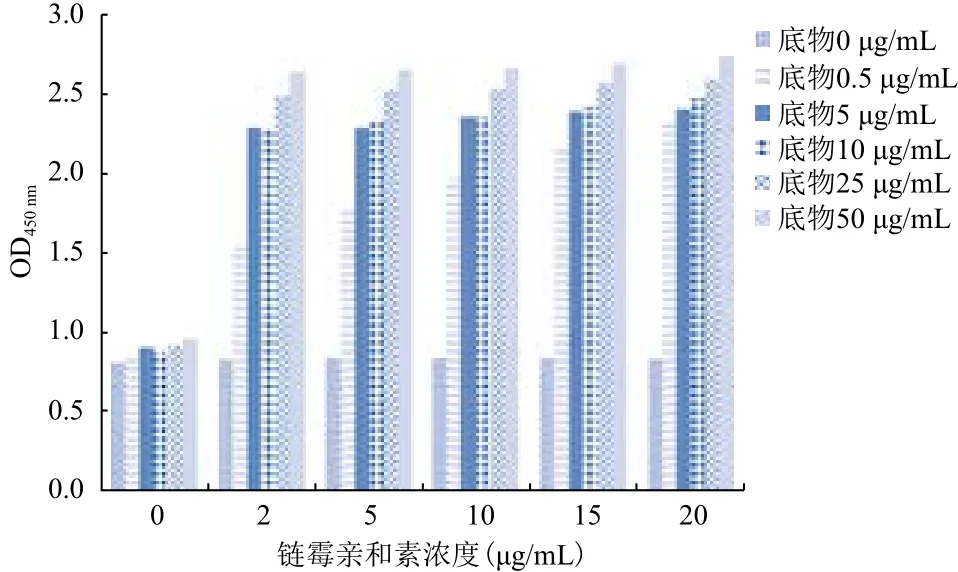
图4 不同的链霉亲和素浓度和肽段底物浓度的影响
2.2.2 蛋白和抗His标签鼠单克隆抗体浓度梯度对筛药体系的影响 选取蛋白浓度梯度、不同抗His标签鼠单克隆抗体浓度,确定链霉亲和素浓度为5 μg/mL,肽段底物浓度为5 μg/mL,HRP标记山羊抗小鼠Ig G抗体浓度为0.5 μg/mL,测量450 nm处的吸光值,结果如图3所示。结合筛选的可行性,确定抗His标签鼠单克隆抗体浓度为0.25 μg/mL,蛋白浓度为75 μg/mL。
2.2.3 链霉亲和素和肽段底物的浓度梯度对筛药体系的影响 确定体系中BSA浓度为1%,蛋白浓度为75 μg/mL,抗His标签鼠单克隆抗体浓度为0.25 μg/mL,再设置不同链霉亲和素的浓度梯度,不同肽段底物的浓度梯度,测量450 nm处的吸光值(图4)。确定最佳的链霉亲和素浓度为5 μg/mL,肽段底物浓度为5 μg/mL。
综上可知,最终确定的高通量药物筛选体系中:链霉亲和素包被浓度为5 μg/mL,底物肽段浓度为5 μg/mL,封闭液BSA浓度为1%,蛋白浓度为75 μg/mL,抗His标签鼠单克隆抗体浓度为0.25 μg/mL,HRP标记山羊抗小鼠Ig G抗体浓度为0.5 μg/mL。
2.3 药物筛选模型的稳定性评价
2.3.1 筛选体系中各组分的影响 在体系中依次不加入链霉亲和素、抗His标签鼠单克隆抗体、底物肽段、蛋白,检测其对吸光值的影响,结果如图5所示。计算信噪比S/N=8.23>3,是比较理想的信噪比。
2.3.2 筛选模型评价指标计算 根据筛药体系中阴性对照组和阳性对照组的数据计算变异系数(CV)和Z',进而对该模型进行可行性分析,将优化后的体系于96孔板中进行反应,设置阴性对照96孔板(正常反应体系)和阳性对照96孔板,连续3 d,每天进行一次体系验证。CV阴性对照=2.04%<20%;CV阳性对照=4.94%<20%;Z'=0.91>0.5。各项指标均符合模型筛选的要求。
2.4 药物筛选结果
对8 248个药物进行筛选,抑制率在80%以
上的有5种,在500 μmol/L药物浓度下,化合物MDC6的抑制率最高,为92%,进行IC50值的测定,IC50值最低达到3.37 μmol/L。化合物MDC6 名称为(1E,6E)-1,7-bis(3,4,5-trimethoxyphenyl)hepta-1,6-diene-3,5-dione,分子式为C25H28O8,结构式如图6所示,IC50值如图7所示。
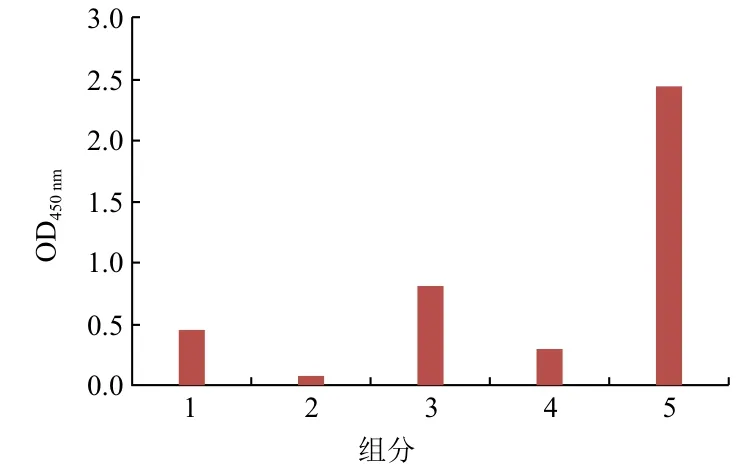
图5 筛选体系中各组分的影响
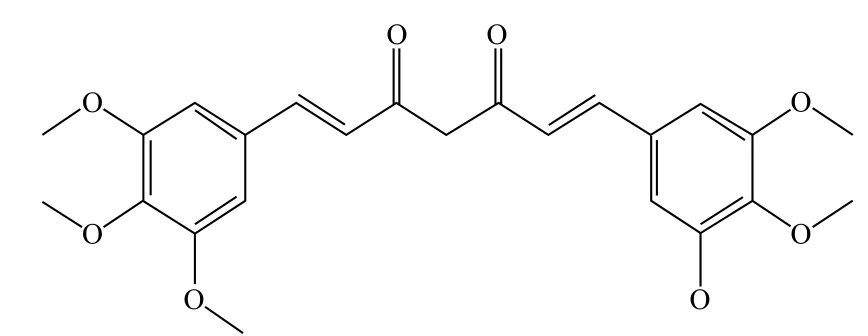
图6 化合物MDC6的结构(C25H28O8)
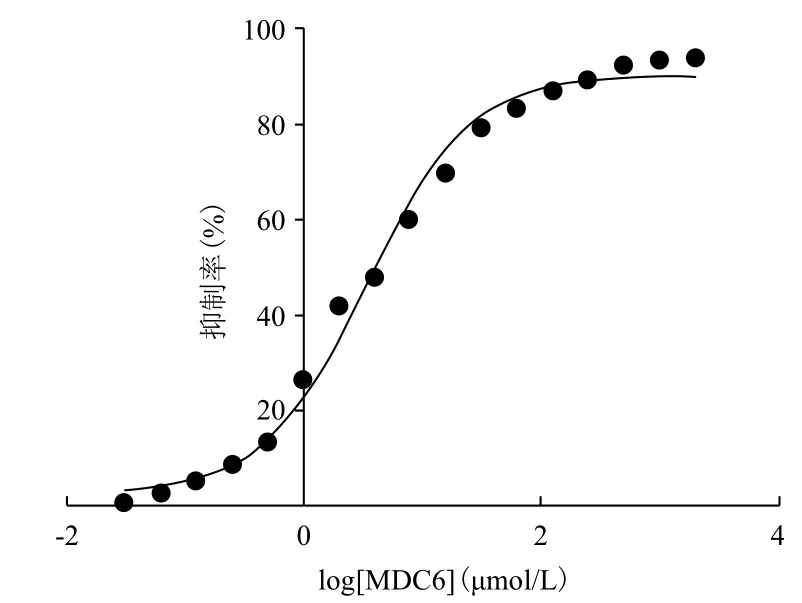
图7 化合物MDC6 IC50值的测定
2.5 细胞水平上对化合物 MDC6的测定
利用MTT法在肝癌细胞上进行检测,结果发现化合物MDC6对肝癌细胞的生长和增殖有较好的抑制作用,IC50值15.92 μmol/L。用Graph Pad Prism 5.0软件计算MDC6在对肝癌细胞的IC50值如图8所示。在MDCK细胞(狗肾细胞)中进行CC50测定,终浓度为200 μmol/L 时,其对细胞的致死率仍然小于30%,即CC50>200 μmol/L,也就是15.92 μmol/L的MDC6对普通细胞无影响。

图8 细胞水平MDC6的IC50值
3 讨论
STAT3参与调节机体的许多生理功能,能够抑制细胞凋亡,促进细胞增殖,在人类恶性肿瘤的发生、发展和演进中起到重要作用,其过量表达与肿瘤的发生关系密切。STAT3是近几年新兴的非常有潜力的抗癌靶点,位于JAK-STATs信号通路的最末端,具有较大的优势,筛选出抑制其活性的化合物就可以抑制整个信号通路,所以建立以STAT3为靶标的高通量筛选模型,并应用该模型筛选STAT3抑制剂对于肿瘤的治疗具有重要意义。
药物筛选是发现新药的初始阶段,目前存在很多种药物筛选方法,包括电泳迁移位移试验(electrophoretic mobility shift assays,EMSA)[14]、酶联免疫吸附试验(enzyme-linked immunosorbent assays,ELISA)[15]和荧光偏振试验(Fluorescence polarization,FP)[16]。我们使用高通量药物筛选技术,是基于分子水平和细胞水平的试验方法进行检测,能够大规模地微量快速筛选药物的新方法。在高通量药物筛选过程中,方法的选择和构建是最重要的一个环节。高通量药物筛选具有速度快、成本低的优点,本研究建立的ELISA高通量STAT3抑制剂药物筛选模型,具有以下特点:反应体积小,特异性强;操作系统自动化;检测灵敏快速;结果稳定,在每块试验板上均同时设立空白和对照,从而使得结果具有可比性;测定结果可信度高,具有较高的筛选效率,大大提高研发新药的效率。在试验中发现部分样品具有STAT3的激动作用,这在设计试验时没有考虑,若将该方法略微改进也可作为STAT3激动剂的筛选模型进行使用。
近年来有关STAT3研究较多,但在大规模药物筛选中的使用还较少,所以建立稳定可靠的高通量药物筛选模型具有重要意义。本研究建立的方法虽也存在一定的局限性,如操作步骤较多、需要多次洗板等,但由于本试验使用的试剂和化合物用量少,尤其是在大规模药物筛选过程中,能够有效的降低筛选成本,从而使得该方法具有较高的实用价值。
运用该模型进行药物筛选,得到化合物MDC6,在分子水平和细胞水平进行IC50值的测定。可在此基础上对化合物进行进一步的优化和验证,以研发新的抗癌类药物,为癌症的治疗带来新希望。
4 结论
基于酶联免疫吸附法(ELISA),摸索STAT3蛋白和抗体用量、肽段底物和链霉亲和素的条件等,确定了体系中各组分的相应浓度,同时对模型稳定性、可靠性进行综合评价分析,在分子水平上成功建立了STAT3抑制剂的高通量筛选模型。应用该模型对8 248个样品进行筛选,发现一种化合物MDC6在500 μmol/L药物浓度下,抑制率为92%,对其进行IC50值的测定时,在分子水平上达到3.37 μmol/L,在细胞水平上达到15.92 μmol/L,对STAT3蛋白有明显抑制作用。
[1] Yu H, Pardoll D, Jove R. STATs in cancer inflammation and immunity:a leading role for STAT3. Nature Reviews[J]. Cancer, 2009, 9(11):798-809.
[2] Zhang X, Yue P, Page BD, et al. Orally bioavailable small-molecule inhibitor of transcription factor Stat3 regresses human breast and lung cancer xenografts[J]. Proceedings of the National Academy of Sciences, 2012, 109(24):9623-9628.
[3] Spaccarotella E, Pellegrino E, Ferracin M, et al. STAT3-mediated activation of microRNA cluster 17~92 promotes proliferation and survival of ALK positive anaplastic large cell lymphoma[J]. Haematologica, 2014, 99(1):116-124.
[4] Grivennikov S, Karin E, Terzic J, et al. IL-6 and Stat3 are required for survival of intestinal epithelial cells and development of colitisassociated cancer[J]. Cancer Cell, 2009, 15(2):103-113.
[5] Iwamaru A, Szymanski S, Iwado E, et al. A novel inhibitor of the STAT3 pathway induces apoptosis in malignant glioma cells both in vitro and in vivo[J]. Oncogene, 2006, 26(17):2435-2444.
[6] Frank DA. STAT3 as a central mediator of neoplastic cellular transformation[J]. Cancer Letters, 2007, 251(2):199-210.
[7] Selvaraj BT, Frank N, Bender FL, et al. Local axonal function of STAT3 rescues axon degeneration in the pmn model of motoneuron disease[J]. The Journal of Cell Biology, 2012, 199(3):437-451.
[8] Hedvat M, Huszar D, Herrmann A, et al. The JAK2 inhibitor AZD1480 potently blocks Stat3 signaling and oncogenesis in solid tumors[J]. Cancer Cell, 2009, 16(6):487-497.
[9] Lin L, Hutzen B, Zuo M, et al. Novel STAT3 phosphorylation inhibitors exhibit potent growth-suppressive activity in pancreatic and breast cancer cells[J]. Cancer Research, 2010, 70(6):2445-2454.
[10] Haan S, Hemmann U, Hassiepen U, et al. Characterization and binding specificity of the monomeric STAT3-SH2 domain[J]. The Journal of Biological Chemistry, 1999, 274(3):1342-1348.
[11] Becker S, Groner B, Müller CW. Three-dimensional structure of the Stat3β homodimer bound to DNA[J]. Nature, 1998, 394(6689):145-151.
[12] Schust J, Berg T. A high-throughput fluorescence polarization assay for signal transducer and activator of transcription 3[J]. Analytical Biochemistry, 2004, 330(1):114-118.
[13] Mosmann T. Rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assays[J]. Journal of Immunological Methods, 1983, 65(1-2):55-63.
[14] Song H, Wang R, Wang S, Lin J. A low-molecular-weight compound discovered through virtual database screening inhibits Stat3 function in breast cancer cells[J]. Proc Natl Acad Sci USA, 2005, 102(13):4700-4705.
[15] Liby K, Voong N, Williams CR, et al. The synthetic triterpenoid CDDO-Imidazolide suppresses STAT phosphorylation and induces apoptosis in myeloma and lung cancer cells[J]. Clinical Cancer Research, 2006, 12(14):4288-4293.
[16] Siddiquee K, Zhang S, Guida WC, et al. Selective chemical probe inhibitor of Stat3, identified through structure-based virtual screening, induces antitumor activity[J]. Proceedings of the National Academy of Sciences, 2007, 104(18):7391-7396.
(责任编辑 马鑫)
The Establishment and Application of a High Throughput Screening Model for Inhibitors of STAT3
Pan Li Zhang Ning Niu Guojun Meng Jing Liu Xiang Yang Cheng
(1. College of Biotechnology,Tianjin University of Science and Technology,Tianjin 300457;2. College of Pharmacy,Nankai University,Tianjin 300071;3. Tianjin International Joint Academy of Biotechnology and Medicine,Tianjin 300457;4. College of Life Sciences,Nankai University,Tianjin 300071)
It was to establish a viable high-throughput drug screening model for discovering inhibitors of Signal Transducer and Activator of Transcription3, and applied the model to screen potential anti-cancer drugs. The STAT3 gene was amplified with PCR and cloned into the expression vector pET-28a. The recombinant STAT3 was over-expressed and purified, and then was used to bind with specific phosphotyrosine peptides. We established a high-throughput drug screening model based on ELISA to obtain some effective compounds. Further, we tested the effect of them on the growth ability and proliferation of the Hepatoma cells using MTT assay. Results showed that it was not only successfully constructed the expression vector pET-28a-STAT3, but also established a reliable and stable model for drug screening. Besides, 8 248 samples were screened, and a positive sample MDC6 was finally obtained. When the drug concentration was less than 500 μmol/L, the inhibition rate of MDC6 reached 92%. The minimum value of IC50was 3.37 μmol/L, while at the cellular level it was 15.92 μmol/L. In this work, we developed a repeatable and reliable assay for screening of STAT3 inhibitors.
STAT3 Target High-throughput drug screening model ELISA
2014-01-13
国家自然科学基金青年科学基金项目(31200641)
潘丽,女,硕士研究生,研究方向:高通量药物筛选;E-mail:panlippg@126.com
杨诚,男,博士,教授,研究方向:微生物与生化药学;E-mail:cheng.yang@htmdc.org
