产耐酸性α-淀粉酶菌株的分离、鉴定、酶学特性研究及发酵培养基的优化
2014-03-17王建玲陈志鑫刘逸寒路福平
王建玲 陈志鑫 刘逸寒 路福平
(天津科技大学生物工程学院 工业发酵微生物教育部重点实验室,天津 300457)
产耐酸性α-淀粉酶菌株的分离、鉴定、酶学特性研究及发酵培养基的优化
王建玲 陈志鑫 刘逸寒 路福平
(天津科技大学生物工程学院 工业发酵微生物教育部重点实验室,天津 300457)
从富含淀粉的土壤中筛选获得多株产耐酸性α-淀粉酶的菌株,将酶活最高的一株经16S rDNA鉴定为枯草芽孢杆菌(Bacillus subtilis),命名为Bacillus subtilis A-7,其所产的耐酸性α-淀粉酶最适温度和pH分别为60℃和4.5。通过单因素筛选及正交试验优化发酵培养基,得到最佳配方为可溶性淀粉 2%,蛋白胨 2%,CaCl20.07%,Na2HPO40.8%,在此条件下耐酸性α-淀粉酶活力达到221 U/mL,是未优化条件下的2.3倍。
耐酸性α-淀粉酶 16S rDNA鉴定 枯草芽孢杆菌 最适温度 最适pH 正交试验
α-淀粉酶可从淀粉分子内部切开α-1,4糖苷键,生成糊精、低聚糖和单糖,广泛用于粮食加工、酿造、纺织品工业、制药、纺织及石油开采等行业[1],在工业生产中占有极其重要的地位,是目前用途较广泛的一种酶制剂[2-4]。目前,国内市场中常用的中温和高温α-淀粉酶的适用pH范围一般为6.0-8.0,在酸性条件下其酶活性明显降低,已不能满足一些酸性条件下淀粉原料的深加工工艺的要求,因此,酸性α-淀粉酶的开发与生产势在必行。
耐酸性α-淀粉酶是一类可以在较低pH值条件下水解淀粉的酶类,最适pH一般为4.0-5.5[5,6]。凭借其良好的耐酸性,酸性α-淀粉酶被广泛应用于制糖、酿造和药物生产等领域,并能有效减少加工工艺过程中化学试剂的消耗[7],降低副产物的形成,减少环境污染,具有重要的经济和社会效益。国外对耐酸性的α-淀粉酶的研究较早,日本学者Minoda等[8]在1963年发现黑曲霉可以产酸性α-淀粉酶以来,欧洲、美国、韩国等国家都开始对耐酸性α-淀粉酶进行了研究,其中得到的产耐酸性α-淀粉酶的微生物大多为芽孢杆菌和曲霉[9]。我国开展相关研究起
步较晚,刘雅琴等[10]在筛选获得的耐酸性α-淀粉酶产生菌基础上,对其进行发酵培养基与发酵条件的优化,最终α-淀粉酶活力比初始时提高了0.65倍,达到31.4 U/mL。张丽靖等[11]筛选获得了一株枯草芽孢杆菌B. subtulisB6,其所产耐酸性α-淀粉酶最适pH为5.0,最适温度为55℃,活力达到33.4 U/mL,且该酶对Ca2+没有依赖性,Fe2+和Mg2+抑制作用不明显。可以看出通过筛选得到耐酸性α-淀粉酶酶活均不高,在具有一定耐酸能力的情况下其酶活力还远未达到实际生产的需要,需要进一步筛选产酶能力强的菌株并优化其产酶条件。
本研究在筛选获得耐酸性α-淀粉酶菌株的基础上,利用单因素及正交法对其培养基组成进行优化,旨在实现该菌株耐酸性α-淀粉酶的高水平生产。
1 材料与方法
1.1 材料
1.1.1 土样来源 面粉厂、酒糟、食品厂和康师傅工厂附近水样和土样15余份。
1.1.2 培养基 双层筛选培养基(鉴别菌株是否产生耐酸性α-淀粉酶):底层培养基:胰蛋白胨1%,酵母浸出粉0.5%,NaCl 1%,琼脂粉1.5%,pH自然;上层为淀粉半固体培养基:可溶性淀粉1%,锥虫蓝0.05%,琼脂粉1%,pH4.5-5.0。种子培养基:蛋白胨1%、酵母粉0.5%、NaCl 1%,pH4.5-5.0。初始发酵培养基:蛋白胨1%、酵母粉0.5%、NaCl 1%,pH4.5-5.0。
1.2 方法
1.2.1 土样采集 分别从面粉厂、酒糟、食品厂、康师傅工厂附近采集土样和水样,4℃下保藏备用。1.2.2 菌种初筛 分别称取不同土样或水样1 g/1 mL,放入装有50 mL无菌水的三角瓶中。取上清液1 mL于装有9 mL无菌水的试管内,振荡摇晃,匀液取1 mL放入另一装有9 mL无菌水的试管内,重复上述步骤制成不同浓度梯度的稀释液。取适当稀释度(10-4、10-6、10-7、10-8)的样品200 μL涂布于筛选培养基,30℃倒置培养24 h,在此基础上倒入双层筛选培养基的上层培养基,30℃倒置培养24 h,由于锥虫蓝和淀粉胶联可形成蓝色复合物,在淀粉被淀粉酶水解后,蓝色褪去,在平板上直观地观察到透明水解圈。挑选透明圈直径(H)与菌落直径(C)之比较大者,即为初筛菌株。
1.2.3 菌种复筛 将初筛菌种接入液体发酵培养基,30℃、200 r/min摇床发酵2 d,取上清测酶活,酶活最大菌株即为筛选获得的耐酸性α-淀粉酶生产菌。
1.2.4 酶活测定 由于筛选得到的菌株所产的α-淀粉酶为耐酸性α-淀粉酶,故对国标GB/T 24401—2009的测量过程稍作修改。参照GB/T 24401—2009,酶活力单位定义:1 g固体酶粉(或1 mL液体酶)在60℃、pH4.5 条件下,1 h 液化1 mg 可溶性淀粉成为糊精所需要的酶量,即为1个酶活力单位,以U/mL(或U/g)表示。
X=c×n
式中,X:样品的酶活力(U/mL,或U/g);c:测试酶样的浓度(U/mL,或U/g);n:样品的稀释倍数。所得结果表示至整数。
1.2.5 菌种鉴定 常规鉴定参照文献[12]中的方法进行。基因组DNA的提取参照文献[13]所述的方法进行,采用通用引物27F(5'-AGAGTTTGATCCTGGCTAG-3')和1541R(5'-TACGGCTACCTTGTTACGACT-3')进行16S rDNA的扩增。扩增体系(50 μL):ddH2O 37 μL,10×buffer 5 μL,dNTPs(2.5 mmol/L each)5 μL,上、下游引物(20 μmol/L)各0.75 μL,DNA模板1 μL,TaqDNA 聚合酶0.5 μL;PCR反应条件为:95℃ 5 min;94℃ 45 s,55℃ 45 s,72℃ 90 s,25个循环;72℃ 10 min。
1.2.6 酶学性质初步研究 配置不同pH(3.0-7.0)柠檬酸-磷酸缓冲液,测定酶的最适反应pH;并在最适pH下测定不同温度(30-70℃)对酶活的影响,确定酶的最适温度。
1.2.7 发酵培养基的优化 通过单因素试验分别考察氮源、碳源、金属离子对菌体产酶的影响,在此基础上对碳源、氮源、CaCl2和NaH2PO44因素作3水平的正交试验,得到最优培养基的配比。
2 结果
2.1 菌株的筛选
从土样和水样中筛选得到130株产淀粉酶菌株,其中12株酶活较高(图1,表1),菌株A-7酶活最
高,达95 U/mL,将该菌株作为下一步试验菌株。BLASTH比对,得知该菌株与枯草芽孢杆菌(Bacillus subtilis)的16S rDNA 的序列同源性最高,达到99%以上,因此将该菌株归属为枯草芽孢杆菌,命名为Bacillus subtilisA-7。
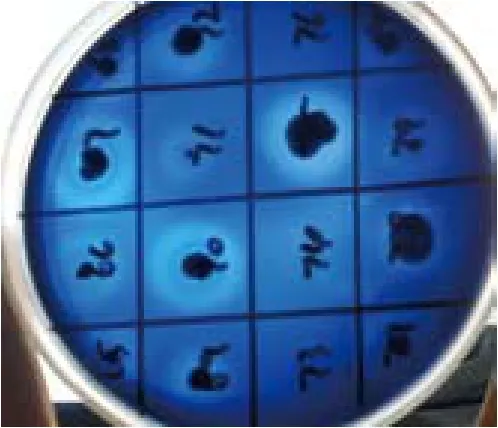
图1 产淀粉酶菌株的水解透明圈

表1 初筛菌株酶活比较
2.2 菌种鉴定
筛选出来的A-7菌株培养后观察菌落形态,发现菌落较大较圆,菌落边缘不规则,菌落表面较粗糙,不透明,菌落颜色为黄褐色。菌种经革兰氏染色呈紫色,为阳性,菌体呈杆状(图2)。
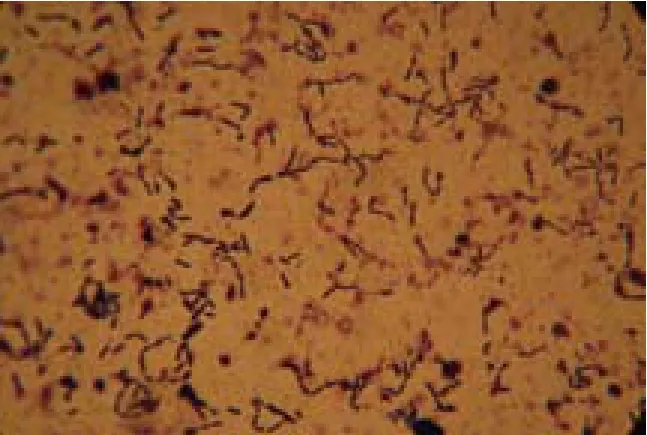
图2 菌种革兰氏染色结果
2.3 16S rDNA鉴定
16S rDNA 序列是细菌鉴定的重要指标,通过PCR扩增该菌株的16S rDNA 序列,大小约为1 500 bp(图3),将该片段的测序结果在NCBI上进行

图3 PCR结果
2.4 酶学性质的初步研究
2.4.1 最适pH 在不同pH值条件下,60℃测定A-7的活力,将酶活最高者定为100%,结果(图4)显示,菌株A-7所产的淀粉酶的活力受酸碱度影响较大,在偏酸的条件下酶活力较高。其最适pH为4.5,在pH4-6之间,相对酶活在60%以上。

图4 pH对α-淀粉酶活性的影响
2.4.2 最适温度 在不同温度条件下,pH4.5测定α-淀粉酶的活力。结果(图5)显示,A-7反应的最适温度均为60℃,在40-80℃之间相对酶活均较高,40-60℃范围内酶活力随温度上升而升高,60℃时酶活力达到最高,随后酶活力随温度上升而下降。
2.5 发酵培养基的优化
2.5.1 碳源对产酶的影响 考虑到发酵成本问题,本实验室选用了几种常见碳源进行优化,氮源为1%蛋白胨,由表2可知,可溶性淀粉是产酶的最佳碳源,淀粉酶的酶活达到142 U/mL,可溶性淀粉的最佳浓
度试验表明,随着可溶性淀粉浓度的增加,酶活不断提高,当浓度达到2%时,酶活最高,达到161 U/mL,当继续增大可溶性淀粉浓度时,淀粉酶活力反而随之下降,所以选取2%可溶性淀粉为最佳碳源。
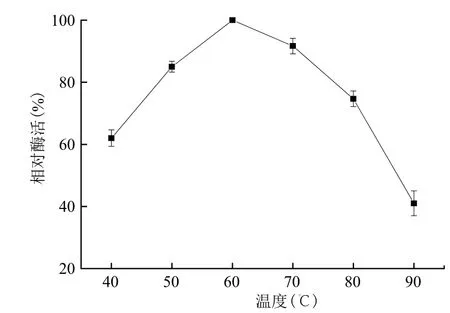
图5 温度对α-淀粉酶活性的影响

表2 碳源对酶活的影响
2.5.2 氮源对产酶的影响 为考察有机氮源和无机氮源对菌株产酶的影响,分别选取蛋白胨、酵母膏、牛肉膏、玉米浆、尿素、NH4Cl 作为氮源,碳源为2%的可溶性淀粉,其他条件相同,结果(表3)显示,有机氮源比无机氮源更有利于菌株产酶,其中蛋白胨为最优氮源,淀粉酶的酶活可达161 U/mL,蛋白胨的最佳浓度试验表明,当浓度为2%时,酶活最高,可达177 U/mL,蛋白胨浓度降低或升高,均抑制菌株的产酶。因此选取2%蛋白胨为最佳氮源。

表3 氮源对酶活的影响
2.5.3 金属Ca2+离子浓度对产酶的影响 据Machius等[14]的研究可知,添加Ca2+离子可促进芽孢杆菌产α-淀粉酶,其原因为芽孢杆菌所产的α-淀粉酶一般是一种金属酶,Ca2+离子可保持α-淀粉酶空间结构和活力的稳定性,故选用不同浓度的Ca2+离子进行发酵,试验结果(表4)显示,当Ca2+浓度达到0.06%时,淀粉酶的酶活最高,达到190 U/mL。
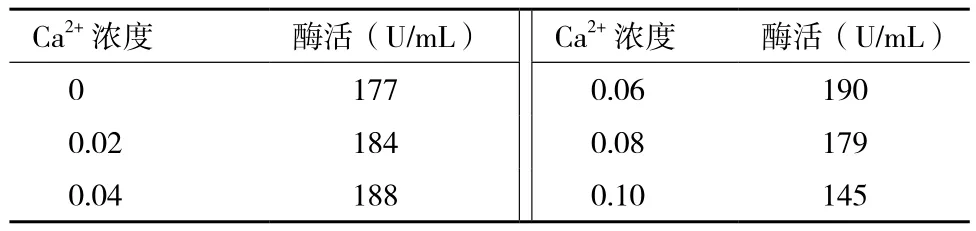
表4 Ca2+含量对酶活的影响
2.5.4 磷酸盐对产酶的影响 磷酸盐可维持发酵培养基pH的稳定,并且磷元素是细胞合成核酸的一种必须元素,可促进细胞的生长。结果(表5)显示,当磷酸盐达到0.8%时,酶活最高,达到225 U/mL,降低或升高磷酸盐浓度,酶活均受到抑制。
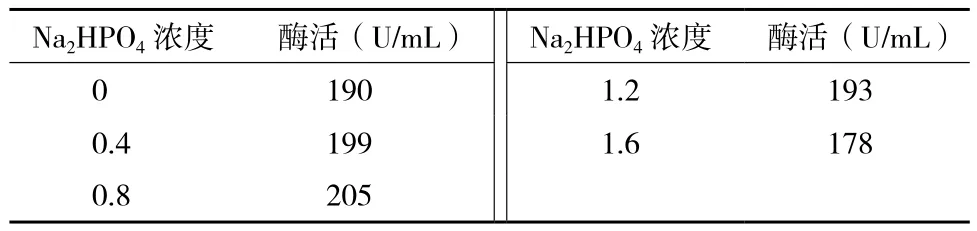
表5 Na2HPO4含量对酶活的影响
2.5.5 正交试验 在单因素试验的基础上,对可溶性淀粉、蛋白胨、CaCl2和Na2HPO44因素作3水平正交试验,结果如表6所示。方差分析表明,可溶性淀粉浓度对菌株产酶的影响较显著。结合极差分析结果,4个因素的影响程度依次为:可溶性淀粉>蛋白胨>磷酸盐>CaCl2,由正交分析可得出培养基配方最优水平组合为:可溶性淀粉 2%,蛋白胨2%,CaCl20.07%,Na2HPO40.8%。从理论上优化得到的培养基是否是最佳产酶条件,还需要进一步通过摇瓶发酵试验进行验证。验证结果表明,重组酶活力达到221 U/mL,此活力大于正交试验中出现的所有结果,验证了选取该结果的正确性。因此,确定最适发酵培养基配方为:可溶性淀粉 2%,蛋白胨2%,CaCl20.07%,Na2HPO40.8%。
3 讨论
世界工业酶市场市值约为3亿美元,其中α-淀粉酶是一种重要的酶制剂,占据酶制剂市场的25%左右[15]。在淀粉深加工产业中,酸性α-淀粉酶的需求量越来越大[16]。现阶段所筛选得到产耐酸性α-淀粉酶的菌株主要为芽孢杆菌和曲霉,最适pH4.5-5.5之间,最适温度在30-60℃之间[17],但初始酶活力均不高,无法满足实际生产的需要。所以仍需在自然界中进一步筛选可耐酸、具有一定耐热能力和高
活力的α-淀粉酶生产菌株。近几年,尽管我国酶制剂工业得到了长足的发展,但与国际先进水平仍存在不小的差距,其中最主要的差距就是我国α-淀粉酶的品种和生产菌株比较单一,为了缩小这种差距,利用基因工程手段改造菌株或筛选菌株的方法来扩充α-淀粉酶的品种和生产菌株就显得尤为重要。
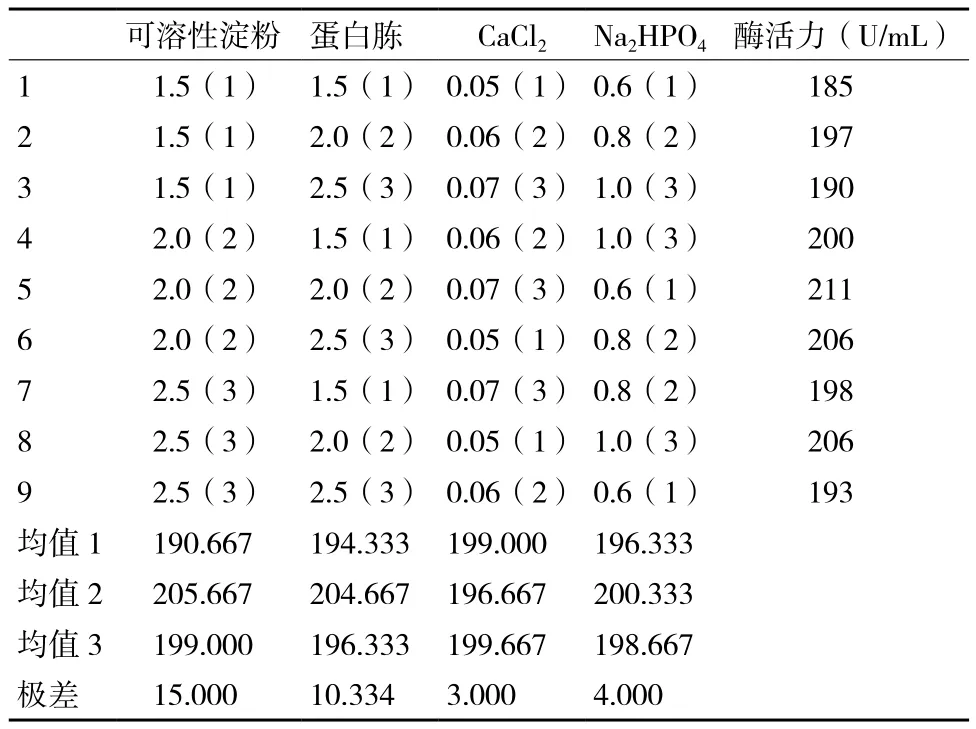
表6 培养基配方正交试验结果及其极差分析
4 结论
从采集到的土样中筛选出一株产耐酸性α-淀粉酶的菌株,经过16S rDNA鉴定为枯草芽孢杆菌。对该菌株所产的α-淀粉酶耐酸性的研究表明,该酶在pH4.5、中等温度下能表现出比较高的酶活,并在此基础上,分别对碳源、氮源、金属离子以及磷酸盐对菌株产耐酸性α-淀粉酶的影响,通过正交试验进一步分析确定了最优发酵培养基为可溶性淀粉2%,蛋白胨 2%,CaCl20.07%,Na2HPO40.8%。最高酶活达到221 U/mL,是初始酶活的2.3倍。
[1] 张树政.酶工业制剂(下册)[M].北京:科学出版社, 1998:458-489.
[2] Pandey A, Nigam P, Soccol C, et al. Advances in microbial amylases[J]. Biotechnol Appl Biochem, 2000, 31:135-152.
[3] Gupta R, Gigras P, Mohapatra H, et al. Microbial α-amylases:a biotechnological perspective[J]. Process Biochemistry, 2003, 38(11):1599-1616.
[4] Kandra L. α-Amylases of medical and industrial importance[J]. J Mol Struct, 2003, 666:487-498.
[5] 高崎义幸.日本开发耐热耐酸性α-淀粉酶[J]. 日本食品工业, 1994, 6(30):44-50.
[6] Sajedi RH, Naderi-Manesh H, Khajeh K, et al. A Ca-independent α-amylase that is active and stable at low pH from the Bacillus sp. KR-8104[J]. Enzyme Microb Technol, 2005, 36(5):666-671.
[7] Richardson TH, Tan X, Frey G, et al. A novel, high performance enzyme for starch liquefaction discovery and optimization of a low pH, thermostable α-amylase[J]. Journal of Biological Chemistry, 2002, 277(29):26501-26507.
[8] Minoda Y, ARAI M, TORIGOE Y, et al. Acid-stable α-amylase of black Aspergilli[J]. Agricultural and Biological Chemistry, 1968, 32(1):104-109.
[9] Morimura S, Zhang WX, Ichimura T, et al. Genetic engineering of white Shochu-koji to achieve higher levels of acid-stable α-amylase and glucoamylase and other properties when used for Shochu making on a laboratory scale[J]. Journal of the Institute of Brewing, 1999, 105(3):309-314.
[10] 刘雅琴, 乌日娜, 段金华.耐酸性α-淀粉酶产生菌的发酵条件优化[J].安徽农业科学, 2010, 38(35):19888-19890.
[11] 张丽靖, 沈江锋, 金庆超, 等.一株酸性淀粉酶产生菌的分离,鉴定及酶学特性初步研究[J].生物技术通报, 2011(5):143-145.
[12] Buchanan RE, Gibbons NE. 伯杰细菌鉴定手册[M].第八版.北京:科学出版社, 1984:353-357.
[13] Sambrook J, Russell DW. 分子克隆实验指南精编版[M]. 北京:化学工业出版社, 2008.
[14] Machius M, Declerck N, Huber R, et al. Kinetic stabilization of Bacillus licheniformis α-amylase through introduction of hydrophobic residues at the surface[J]. Journal of Biological Chemistry, 2003, 278(13):11546-11553.
[15] Sanchez S, Demain AL. Enzymes and bioconversions of industrial, pharmaceutical, and biotechnological significance[J]. Organic Process Research & Development, 2010, 15(1):224-230.
[16] 胡元森, 潘涛, 李翠香.酸性淀粉酶的分离纯化与酶学性质研究[J].生物技术通报, 2010(3):199-202.
[17] Sharma A, Satyanarayana T. Microbial acid-stable α-amylases:Characteristics, genetic engineering and applications[J]. Process Biochemistry, 2013, 48(2):201-211.
(责任编辑 马鑫)
Screening,Identification and Characterization of an Acid α-amylase Producing Strain and Optimization of Its Fermentable Condition
Wang Jianling Chen Zhixin Liu Yihan Lu Fuping
(Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,College of Biotechnology,Tianjin University of Science& Technology,Tianjin 300457)
Multiple new acid α-amylase producing strains were isolated from soil which is rich in starch. A strain which has the highest enzyme activity was identified as Bacillus subtilis A-7 through analysis of 16S rDNA gene. The optimum temperature and pH was 60℃ and 4.5. The single factor experiments and orthogonal experiments were adopted to optimize the liquid fermentation medium. The composition of the best medium was 2% soluble starch, 2% peptone, 0.07% CaCl2, 0.8% Na2HPO4. Under this optimal condition, the activity of acid α-amylase was 221 U/mL and 2.3-fold more than that of no optimization.
Acid α-amylase 16S rDNA Bacillus subtilis Optimum temperature Optimum pH Orthogonal experiment
2013-10-23
天津科技大学实验室开放基金项目(1204A211),国家自然科学基金资助项目(31101219),国家高技术研究发展计划(“863”计划)项目(2013AA102106-07)
王建玲,女,研究员,研究方向:酶与应用微生物;E-mail:wjl01@tust.edu.cn
路福平,男,教授,研究方向:酶与应用微生物;E-mail:lfp@tust.edu.cn
