金鱼寄生三代虫的形态学及基于rDNA ITS序列的分子鉴定
2014-03-17李冉冉李文祥吴旭东王桂堂
李冉冉李文祥吴旭东,王桂堂
(1. 甘肃农业大学动物科学技术学院, 兰州 730070; 2. 中国科学院水生生物研究所, 武汉 430072; 3. 宁夏回族自治区水产研究所, 银川 750001)
金鱼寄生三代虫的形态学及基于rDNA ITS序列的分子鉴定
李冉冉1李文祥2吴旭东1,3王桂堂2
(1. 甘肃农业大学动物科学技术学院, 兰州 730070; 2. 中国科学院水生生物研究所, 武汉 430072; 3. 宁夏回族自治区水产研究所, 银川 750001)
为查明我国金鱼三代虫的种类, 研究采用形态学与分子生物学相结合的方法, 对我国6个金鱼主要养殖区的三代虫进行了调查。通过形态测量分析, 发现了 4种三代虫, 分别为: 小林三代虫(Gyrodactylus kobayashii)、G. gurleyi、G. longoacuminatus和三代虫未定种(Gyrodactylus sp.)。而通过核糖体rDNA ITS序列比对分析, 发现有 2种三代虫分别与小林三代虫和 G. longoacuminatus相似性在 99.1%以上, 有 1种与 G. gurleyi的相似性在98.2%以上, 另外, 还有1种三代虫与现有序列的相似性都较低, 虽然它与小林三代虫的相似性最高, 也仅为91.0%, 暂为未定种。系统发育分析也显示, 金鱼寄生的3种三代虫分别与小林三代虫、G. gurleyi和 G. longoacuminatus聚集在一起, 另外 1种单独聚在一起, 这 4种三代虫均隶属于 G. (Limnonephrotus)亚属, 与G. (Gyrodactylus)亚属的秀丽三代虫(G. elegans)的亲缘关系很远。通过对三代虫样品的抽样调查发现, 小林三代虫存在于所有采样点, 在广州、武汉、郑州3个采样点为优势种, 所占的比率都在60%以上; G. gurleyi在海口、南京和上海为优势种, 所占的比率都在50%以上; G. longoacuminatus和三代虫未定种所占比率均较小。由此可见, 小林三代虫和 G. gurleyi是我国金鱼常见的三代虫, G. gurleyi 和 G. longoacuminatus是中国三代虫新记录种。
金鱼; 三代虫; 形态鉴定; ITS分子标记
三代虫(Gyrodactylus)一般寄生于鱼类的鳃和体表(鳍条), 是金鱼常见的体外寄生虫, 也是危害最严重的寄生虫病原之一[1]。除了细锚三代虫(G. sprostonae), 我国对寄生于金鱼的三代虫的报道仅见于综述[1,2], 没有详细的形态学与分子鉴定研究,并且与国外报道的种类存在较大的差异[3—5]。秀丽三代虫(G. elegans)、中型三代虫(G. medius)和细锚三代虫被认为是我国金鱼寄生的常见三代虫[1], 而国外报道的寄生于金鱼的三代虫主要有 3个种, 分别为: 小林三代虫(G. kaboyashii)、G. gurleyi和 G. longoacuminatus[3—5]。
三代虫的种类鉴定主要依靠后吸器和交配囊的几丁质结构[6], 这些几丁质结构的种间差异较小,而且宿主、地理位置和温度等因素可造成个体间的变异[7], 因此, 仅仅依靠形态学特征来鉴定容易出现错误, 而分子生物学方法可辅助对三代虫种类进行有效的鉴定和区分[8]。由于ITS序列种内变异较小,种间变异较大, 目前对于三代虫的分子鉴定, 一般基于rRNA 基因的内转录间隔区(ITS)序列分析[9]。为了查明我国金鱼寄生三代虫的种类, 本研究利用形态学和分子生物学相结合的方法对我国金鱼主要养殖区的三代虫种类进行了调查和鉴定。
1 材料与方法
1.1 材料来源
2012年5—7月, 对河南省郑州市(ZZ)、江苏省南京市(NJ)、湖北省武汉市(WH)、广东省广州市(GZ)、上海市(SH)和海南省海口市(HK)等6个地区的金鱼养殖场进行了调查, 每个采样点收集30条金鱼, 在解剖镜下检查鳍条和鳃, 收集三代虫, 固定于 80%的酒精中, 从每尾金鱼上收集的三代虫分开保存。
1.2 三代虫的形态学鉴定
每个采样点随机选取30条三代虫, 用苦味酸铵固定[10], 压片后在显微镜下观察并拍照, 根据测微标尺测量虫体、锚钩、边缘小钩和联结片等分类特征的大小[10], 通过与已发表三代虫的形态特征进行比较[4,5,11—13], 鉴定种类。
1.3 三代虫的分子鉴定
每个采样点随机选取10条三代虫, 每条三代虫作为一个样品提取基因组 DNA[8], 使用三代虫特异性引物扩增及测序[9], 将获得的 ITS1-ITS2在 NCBI上BLAST比对分析, 一般认为序列相似性在99%以上为同一种。并基于P-距离计算ITS序列的变异程度, 如果三代虫ITS序列的变异在1%以内, 则认为是同一物种[14]。
1.4 基于ITS1-5.8S-ITS2的系统发育分析
基于 ITS全序列(ITS1-5.8S-ITS2), 以坏鳃指环虫(Dactylogyrus vastator)为外类群, 每个采样点每种三代虫分别选取1条代表序列(在系统发育树中以采样点汉语拼音首字母加数字编号的形式表示, 如广州的3种三代虫序列表示为: GZ1、GZ2和GZ3), 与23种已发表的分属于6个亚属的三代虫的序列(表1)一起构建分子系统树。分子系统树的构建采用最大简约法(MP)、贝叶斯法(BI)和最大似然法(ML)。其中最大简约树和贝叶斯树参照彭作刚等的方法[15], 后者在TVM+I+G模型下构建; ML分析在 PhyMLv.3.0[16]软件上运行。使用PAUP*4.0b10的Shimodaira-Hasegawa test(S-H检验)[17]和Kishino-Hasegawa test ( K-H检验)[18]对上述三种方法产生的系统发育假设的同质性进行卡方检验。

表1 本实验中用到的已发表的三代虫ITS序列信息Tab. 1 List of published Gyrodactylus ITS sequences utilized in this study
2 结果
2.1 三代虫的形态学鉴定
三代虫的种类 通过形态学比较, 共发现 4种三代虫: 小林三代虫、G. gurleyi、G. Longoacuminatus和三代虫未定种。小林三代虫存在于所有采样点, 在广州、武汉、郑州3个采样点为优势种, 所占的比率均在60%以上; G. gurleyi在除郑州外的5个采样点有发现, 在海口、南京和上海为优势种; G. longoacuminatus仅在武汉和郑州采样点发现, 三代虫未定种存在于除南京和郑州外的 4个采样点, 这两种三代虫所占比率较小(表2)。
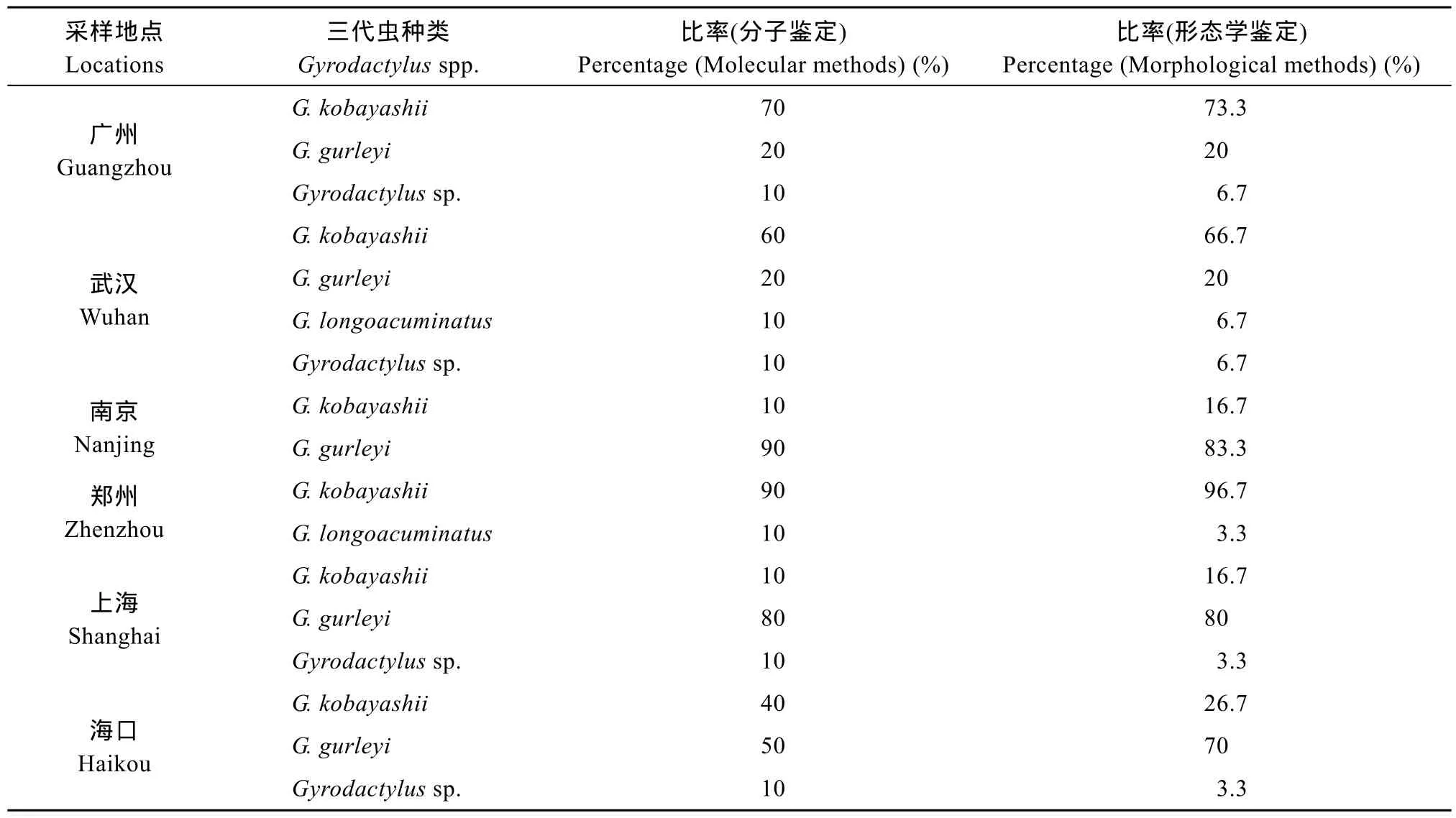
表2 不同采样地点金鱼寄生三代虫的种类与所占比率Tab. 2 Species of Gyrodactylus and their percentages in the sampling locations
四种三代虫的形态特征 小林三代虫(图 1 a-d)虫体长 517.8 μm (312.4—653.1), 虫体中部宽121.9 μm (67.8—179.7)。交配囊椭圆形, 由1个弯曲的大刺和 6个排成拱形的小刺组成, 靠近大刺的两个小刺与大刺形态类似, 其他 4小刺为尖形。锚钩全长58.7 μm (55.2—65.7), 基部长18.4 μm (15.9—22.5), 钩柄长43.4 μm (40.3—48.2), 钩尖长27.5 μm (25.2—29.9)。腹联结片长 23.3 μm (21.6—25.2), 基部宽8.7 μm (6.6—10.2), 中间宽6.0 μm (4.1—7.3),耳状突较小而钝, 长2.1 μm (1.1—3.1), 两耳状突起间长度22.3 μm (18.8—24.4), 小于腹联结片的最大长度; 腹联结片膜呈舌形, 高15.0 μm (12.1—16.3)。边缘小钩全长27.4 μm (24.3—28.7), 钩柄长21.9 μm (19.1—23.6), 钩体长5.5 μm (4.4—6.7), 镰部(末端)宽3.5 μm (2.2—4.1), 钩体基部宽2.9 μm (2.2—3.6),扣环长10.7 μm (8.2—12.2)。
G. gurleyi (图1 e-h)虫体长541.3 μm (309.8—730.9), 虫体中部宽122.6 μm (68.5—170.6)。交配囊椭圆形, 由1个弯曲的大刺和7—8个排成拱形的小刺组成, 靠近大刺的两个小刺与大刺形态类似, 其他小刺为尖形。锚钩全长53.8 μm (48.9—56.2), 基部长 15.9 μm (12.7—18.2), 钩柄长 40.5 μm (36.5—43.2), 钩尖长26.6 μm (22.5—28.4)。腹联结片长20.6 μm (18.2—23.6), 基部宽8.1 μm (6.6—9.5), 中间宽5.1 μm (3.5—6.1), 耳状突较小而略尖, 长2.6 μm (1.7—3.5),两耳状突起间长度22.2 μm (19.4—26.5), 长于腹联结片的最大长度; 腹联结片膜呈舌形延伸, 膜上具纹, 长13.4 μm (12.1—13.9)。边缘小钩全长27.3 μm (24.0—28.5), 钩柄长22.2 μm (18.7—22.4), 钩体长5.1 μm (4.5—5.5), 镰部(末端)宽3.5 μm (2.4—4.1),
钩体基部宽3.2 μm (2.0—3.9), 扣环长10.8 μm (8.8—13.0)。
G. longoacuminatus虫体长404.9 μm (312.5—497.2 ), 虫体中部宽122.9 μm (120.2—125.6)。锚钩全长60.0 μm (59.4—60.3), 基部长19.0 μm (18.6—19.6), 钩柄长45.3 μm (44.8—46.0), 钩尖长28.9 μm (28.8—29.0)。腹联结片长23.9 μm (23.2—25.1), 基部宽8.8 μm (8.3—9.6), 中间宽6.3 μm (6.1—6.4), 耳状突较小而略尖, 长2.4 μm (2.2—2.8), 两耳状突起间长度24.3 μm (23.31—25.98), 大于腹联结片的长度; 腹联结片膜呈舌形延伸, 膜上具纹。边缘小钩全长29.1 μm (29.0—29.1), 钩柄长23.4 μm (23.2—23.7),钩体长5.6 μm (5.4—5.8), 镰部(末端)宽2.8 μm (2.5—3.1), 钩体基部宽2.3 μm (2.2—2.3), 扣环长10.8 μm (10.7—11.0)。
还有一种三代虫, 与上述3种三代虫都有差异,暂定为三代虫未定种。虫体长 466.7 μm (388.8—585.2), 虫体中间宽128.2 μm (101.8—151.2)。交配囊椭圆形, 由1个弯曲的大刺和6个排成拱形的小刺组成, 靠近大刺的两个小刺与大刺形态类似, 其他小刺为尖形。锚钩全长50.0 μm (48.4—52.1), 基部长14.8 μm (13.9—16.4), 钩柄长37.0 μm (35.4—39.8), 钩尖长24.9 μm (24.1—26.6)。腹联结片长18.6 μm (17.1—20.0), 基部宽7.7 μm (7.0—9.1), 中间宽5.0 μm (4.1—6.2), 耳状突较小而略尖, 长2.3 μm (1.5—2.7), 两耳状突起间长 20.1 μm (17.3—21.8),大于腹联结片的长度。边缘小钩全长 25.3 μm (21.6—28.4), 钩柄长20.8 μm (17.3—23.5), 钩体长4.5 μm (3.8—5.4), 镰部(末端)宽3.5 μm (2.6—4.2),钩体基部宽 3.2 μm (2.9—3.6), 扣环长 10.2 μm (8.6—11.1)。
2.2 分子鉴定
获得的60条ITS1-ITS2序列经过多重比对, 为1236 bp, 保守位点815个, 变异位点406个, 简约信息位点351个; 聚类分析后分为4组: Gk、Gg、Gl和Gsp。通过与GenBank中已知三代虫的ITS序列的比对分析, Gk组中的序列与小林三代虫的相似性达到99.4%以上; Gg组中的序列与G. gurleyi的相似性为 98.2%以上; Gl 组中的序列与 G. longoacuminatus的相似性为99.1%以上; 而与Gsp组中的序列相似性最大的也只有91.0%, 无法确定种类。遗传变异分析显示, Gk、Gg、Gsp组内的ITS序列变异都在1%以内, Gl组变异稍高, 为1.3%—1.8%, 均为种内变异[12]; Gk、Gg和Gsp组间的变异均在15.1%以上,为种间变异。根据上述的ITS序列的相似性和遗传变异分析, 认为寄生于金鱼的三代虫有4种, Gk、Gg和Gl组分别为小林三代虫、G. gurleyi和 G. longoacuminatus (GenBank登录号分别为: KC922452, KC922453, KC922451), 而Gsp组为一种未知三代虫。
系统发育树也显示, 寄生于金鱼的三代虫有 3种分别与小林三代虫、G. gurleyi和 G. longoacuminatus聚在一起, 另外1种单独聚在一起, 这4种三代虫又与位于进化树顶端的 G. (Limnonephrotus)亚属的三代虫聚为一支, 而隶属于G. (Gyrodactylus)亚属的秀丽三代虫位于进化树的基部(图2)。
通过分子鉴定的三代虫种类与形态学鉴定的结果一致, 且 4种三代虫在各采样点所占比率较相似(表2)。
3 讨论
通过形态学和分子鉴定, 共发现 4种三代虫,即: 小林三代虫、G. gurleyi、G. longoacuminatus和三代虫未定种。在国外的金鱼中也发现并详细描述了小林三代虫[4]、G. gurleyi[3]和G. longoacuminatus[5]的形态特征, 本文描述的这 3种三代虫与国外报道的几乎完全一致。小林三代虫与G. gurleyi的主要区别在边缘小钩镰部的形态、腹联结片上耳状突的形态以及交配囊小刺的数目。小林三代虫镰部的镰刀状开口较大, 镰状尖指向水平方向与趾状末端指向呈钝角; 耳状突短而圆润, 两耳状突起间长度小于腹联结片的最大长度; 交配囊的小刺 6枚。而 G. gurleyi的镰刀状开口较小, 镰状尖指向大致与趾状末端指向平行, 且镰状尖和趾状末端更尖锐; 耳状突较为突出, 两耳状突起间长度大于腹联结片的最大长度; 交配囊的小刺7—8枚。G. longoacuminatus和G. gurleyi形态非常相似, 最大的区别仅在于前者固着器的几丁质结构更大, Cone和Wiles也认为该特征是两者最大的区别[3]。三代虫未定种与上述三种三代虫的主要区别在于其腹联结片更短, 耳状突比小林三代虫尖锐, 比 G. gurleyi的略小, 而且在GenBank中也没有较相似的 ITS序列, 所以暂定为三代虫未定种。

图2 基于ITS1-5.8S-ITS2序列构建的三代虫的最大简约树(节点上的数值依次为MP、ML法自展支持率及贝叶斯后验概率)Fig. 2 Phylogram constructed from ITS1-5.8S-ITS2 sequences for subgenera and selected species of Gyrodactylus by maximum parsimony (Statistical node support is consequently shown as follows: maximum parsimony bootstrap /maximum likelihood bootstrap / Bayesian posterior probability)
该结果与中国以往报道的种类存在较大差异。我国已报道的寄生于金鱼和鲫鱼的三代虫有中型三代虫、秀丽三代虫、舒里曼三代虫(G. shulmani)、细锚三代虫和小林三代虫等[11], 其中秀丽三代虫、中型三代虫和细锚三代虫等被认为是金鱼常见的三代虫种类, 尤其是秀丽三代虫, 被认为是金鱼上最常见的种类[1,2]。本次调查在 5—7月开展, 采样地点为我国的 6个主要金鱼养殖产区, 即郑州、武汉、南京、上海、海口、广州, 全国各地的金鱼很多都是从这些地方引进, 因此, 本文所调查的三代虫可基本上代表我国金鱼寄生三代虫的种类。然而在调查中并未发现秀丽三代虫, 而且通过系统发育分析,发现金鱼寄生的 4种三代虫亲缘关系较近, 都隶属于 G. (Limnonephrotus)亚属, 与秀丽三代虫所属亚属 G. (Gyrodactylus)的亲缘关系很远。G. (Limnonephrotus)亚属的三代虫具有“长”ITS的特征, ITS1的长度在600 bp以上, 而G. (Gyrodactylus)亚属的三代虫具有“短”ITS特征, ITS1的长度在300—500 bp之间[19]。另外, 秀丽三代虫系在欧鳊属(Abramis)鱼类中发现并命名, 尽管后来有些报道说在其他鲤科鱼类中发现了秀丽三代虫[20], 但是由于三代虫通常具有较强的宿主特异性, 秀丽三代虫一般不会感染欧鳊属以外的其他鱼类, 因此, 后来的研究认为金鱼寄生秀丽三代虫的鉴定是错误的[3,4]。上述结果说明, 尽管秀丽三代虫与金鱼寄生的几种三代虫形态上较相似, 但寄生于金鱼的三代虫中不应该有秀丽三代虫, 因此, 关于我国金鱼寄生秀丽三代虫的报道很可能是错误的。
小林三代虫和 G. gurleyi通常是金鱼中常见的三代虫种类。在日本、英国、澳大利亚等都已有小林三代虫的报道[4,21,22], G. gurleyi则在美国、加拿大、伊朗等地区都被广泛报道[3,8]。在本次调查中,所有的采样点均有小林三代虫, 而且小林三代虫在广州、武汉、郑州等3个采样点为优势种; G. gurleyi在5个采样点的金鱼中都有寄生, 而且在海南、南京和上海 3个采样点为优势种。因此, 小林三代虫和G. gurleyi应该是我国金鱼比较常见的三代虫种类。
我国对三代虫的研究始于 1948年[23], 目前已经发现并报道了三代虫属的52种三代虫[24], 但是还未见G. gurleyi和G. longoacuminatus的报道, 因此, G. gurleyi和G. longoacuminatus是中国三代虫新记录种。
[1] Wu H S. Monogenean diseases and their prevention and cure [J]. Journal of Aquaculture, 1990, 3: 20—21 [伍惠生. 金鱼单殖吸虫病及其防治. 水产养殖, 1990, 3: 20—21]
[2] Chen A P, Jiang Y L, Qian D, et al. Gyrodactyliasis [J]. China Fisheries, 2011, 9: 53—54 [陈爱平, 江育林, 钱冬,等. 三代虫病. 中国水产, 2011, 9: 53—54]
[3] Cone D K, Wiles M A. Redescription of Gyrodactylus gurleyi Price, 1937 (Monogenea), with notes on species of Gyrodactylus Nordmann, 1832 parasitizing goldfish (Carassius auratus (L.)) in North America [J]. Canadian Journal of Zoology, 1983, 61(12): 2932—2937
[4] Ergens R, Ogawa K. Redescription of Gyrodactylus kobayashii Hukuda (Monogenoidea) [J]. Vestnik Ceskoslovenské Spolecnosti Zoologické, 1978, 42: 101—104
[5] Ergens R. Redescription of Gyrodactylus longoacuminatus Zitiian, 1964 (Gyrodactylidae: Monogenea) [J]. Folia Parasitologica, 1980, 27: 123—126
[6] Zhang J Y, Qiu Z Z, Ding X J, et al. Parasites and Parasitic Diseases of Fishes [M]. Beijing: Science Press. 1999, 97—201 [张剑英, 邱兆祉, 丁雪娟, 等. 鱼类寄生虫与寄生虫病. 北京: 科学出版社. 1999, 97—201]
[7] Rokicka M, Lumme J, Ziętara M S. Identification of Gyrodactylus ectoparasites in Polish salmonid farms by PCR-RFLP of the nuclear ITS segment of ribosomal DNA (Monogenea, Gyrodactylidae) [J]. Acta Parasitologica, 2007, 52(3): 185—195
[8] Omidzahir S, Ebrahimzadeh Mousavi H A, Soltani M, et al. Identification of Gyrodactylus gurleyi in Carassius auratus using morphometric and molecular characterization [J]. Iranian Journal of Veterinary Medicine, 2012, 6(1): 41—46
[9] Cunningham C O. Species Variation within the internal transcribed spacer (ITS) region of Gyrodactylus (Monogenea: Gyrodactylidae) ribosomal RNA genes [J]. Journal of Parasitology, 1997, 83: 215—219
[10] Malmberg G. The excretory systems and the marginal hooks as a basis for the systematics of Gyrodactylus (Trematoda, Monogenea) [M]. Arkiv for Zoologi, 1970, 23(1/2): 1—235
[11] Wu B H, Lang S, Wang W J, et al. Fauna Sinica, Platyhelminthes, Monogenea [M]. Beijing: Science Press. 2000, 583—615 [吴宝华, 郎所, 王伟俊, 等. 中国动物志.扁形动物门. 单殖吸虫纲. 北京: 科学出版社. 2000, 583—615]
[12] Yao W J. Three new species of Gyrodactylus of fishes from Wuling mountains region [J]. Acta Hydrobiologica Sinica, 2002, 26(5): 517—520 [姚卫建. 武陵山地区鱼类寄生三代虫三新种. 水生生物学报, 2002, 26(5): 517—520]
[13] Yao W J. Four species of Gyrodactylus from fish of the family acheilognathinae [J]. Acta Hydrobiologica Sinica, 2002, 26(5): 513—516 [姚卫建. 亚科鱼类鳃部寄生的四种三代虫的记述. 水生生物学报, 2002, 26(5): 513—516]
[14] Huyse T, Buchmann K, Littlewood D T J. The mitochondrial genome of Gyrodactylus derjavinoides (Platyhelminthes: Monogenea)-A mitogenomic approach for Gyrodactylus species and strain identification [J]. Gene, 2008, 417(1-2): 27—34
[15] Peng Z G, Zhang Y G, He S P, et al. Phylogeny of Chinese catfishes inferred from mitochondrial cytochrome b sequences [J]. Acta Genetica Sinica, 2005, 32(2): 145—154 [彭作刚, 张耀光, 何顺平, 等. 从细胞色素b基因序列变异分析中国鲇形目鱼类的系统发育. 遗传学报, 2005,32(2): 145—154]
[16] Guindon S, Gascuel O. A simple, fast, and accurate algorithm to estimate large phylogenies by maximum likelihood [J]. Systematic Biology, 2003, 52(5): 696—704
[17] Shimodaira H, Hasegawa M. Multiple comparisons of log-likelihoods with applications to phylogenetic inference [J]. Molecular Biology and Evolution, 1999, 16(8): 1114—1116
[18] Kishino H, Hasegawa M. Evaluation of the maximum likelihood estimate of the evolutionary tree topologies from DNA sequence data, and the branching order in Hominoidea [J]. Journal of Molecular Evolution, 1989, 29(2): 170—179
[19] Ziętara M, Lumme J. Comparison of molecular phylogeny and morphological systematics in fish parasite genus Gyrodactylus Nordmann, 1832 (Monogenea, Gyrodactylidae) [J]. Zoollogica Poloniae, 2004, 49(1-4): 5—28
[20] Wagener G R. Translations: On Gyrodactylus Elegans, Nordmann [J]. Quarterly Journal of Microscopical Science, 1861, s2-1: 196—212
[21] Cable J, Harris P D, Tinsley R C, et al. Phylogenetic analysis of Gyrodactylus spp. (Platyhelminthes: Monogenea) using ribosomal DNA sequences [J]. Canadian Journal of Zoology, 1999, 77: 1439—1449
[22] Jones M K, Whittington I D. Nuclear bodies in the egg cells of a Gyrodactylus species (Platyhelminthes, Monogenea) [J]. Parasitology Research, 1992, 78(6): 534—536
[23] Yin W Y, Sproston N G. Studies on the monogenetic trematodes of China [J]. Sinensia, 1948, 19: 57—85
[24] He H Y, Shi Y R, You P. Catalogue of the Gyrodactylidae (Monogenea) of China, with a key to the current nominal species [J]. Journal of Yan’an University (Natural Science Edition), 2012, 31(3): 22—30 [贺怀亚, 史妍茹, 尤平.中国三代虫科名录及已知种检索表. 延安大学学报(自然科学版), 2012, 31(3): 22—30]
IDENTIFICATION OF GYRODACTYLUS SPECIES IN GOLDFISH (CARASSIUS AURATUS) THROUGH MORPHOLOGICAL STUDY AND THE ANALYSIS OF THE rDNA ITS SEQUENCE
LI Ran-Ran1, LI Wen-Xiang2, WU Xu-Dong1,3and WANG Gui-Tang2
(1. Faculty of Animal Science and Technology, Gansu Agricultural University, Lanzhou 730070, China; 2. Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 3. Ningxia Fisheries Research Institute, Yinchuan 750001, China)
In order to determine the Gyrodactylus species in China, we applied morphological and molecular approaches to identify specimens of Gyrodactylus collected from 6 principal goldfish farming areas. Four Gyrodactylus species, including G. kobayashii, G. gurleyi, G. longoacuminatus and G. sp., were identified with morphological measurements. According to rDNA ITS sequence alignment, 2 species of Gyrodactylus were identical to G. kobayashii and G. longoacuminatus with a similarity of higher than 99.1%. One species of Gyrodactylus was identical to G. gurleyi with the similarity higher than 98.2%. The other Gyrodactylus species had low similarity to all the currently available sequences, with the relatively high similarity of only 91.0% to G. kobayashii. The results of Phylogenetic analysis indicated that these three Gyrodactylus species were clustered with G. kobayashii, G. gurleyi and G. longoacuminatus, respectively. The fourth Gyrodactylus species clustered in a separate clad. All the 4 Gyrodactylus species in goldfish belonged to G. (Limnonephrotus), and they were distant from G. elegans that belonged to G. (Gyrodactylus). G. kobayashii was found in all sampling areas and was dominant in Guangzhou, Wuhan and Zhengzhou with a proportion of more than 60%. G. gurleyi was found in 5 areas except for Zhengzhou, and dominated in Haikou, Nanjing and Shanghai with the percentage of higher than 50%. G. longoacuminatus and G. sp. formed a small proportion. The results suggested that G. kobayashii and G. gurleyi were the most common Gyrodactylus species in goldfish, and G. gurleyi and G. longoacuminatus were the newly reported in China.
Carassius auratus; Gyrodactylus; Morphological identification; rDNA ITS sequence
S941.5
A
1000-3207(2014)05-0903-07
10.7541/2014.135
2013-08-14;
2014-03-09
现代农业产业技术体系建设专项资金(CARS-46-08); 国家自然科学基金(31272695)资助
李冉冉(1986—), 女, 山东济宁人; 硕士研究生; 主要从事鱼类寄生虫研究。E-mail: respond@163.com
吴旭东, E-mail: amy95@126.com; 王桂堂, E-mail: gtwang@ihb.ac.cn
