生长激素/催乳素家族配体和受体成员在斑马鱼早期胚胎中的表达比较和交叉活性分析
2014-03-17于力群王厚鹏朱作言孙永华
于力群王厚鹏朱作言孙永华
(1. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
生长激素/催乳素家族配体和受体成员在斑马鱼早期胚胎中的表达比较和交叉活性分析
于力群1,2王厚鹏1朱作言1孙永华1
(1. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
为了进一步研究 GH/PRL家族信号通路在鱼类早期胚胎发育中的作用, 研究以斑马鱼为模型, 通过Real-time PCR技术和原位杂交技术刻画并比较了GH/PRL家族成员及其受体家族成员在胚胎发育早期的表达模式。结果发现, 在配体家族成员中, 生长激素(Growth hormone, GH)和生长催乳素(Somatolactin, smtl)存在母源表达, 在受体家族成员中, ghra、ghrb存在母源表达。利用荧光素酶分析spi2.1启动子活性的结果初步证明, 在斑马鱼早期胚胎发育中, 各配体家族成员与GHRa之间可以发生广泛的互作。这一系列结果对于我们认识GH/PRL家族信号通路在斑马鱼早期发育中的作用具有重要的指导意义。
生长激素; 生长激素受体; GH/PRL家族信号通路; 斑马鱼; 早期表达
生长激素(Growth hormone, GH)及催乳素(Prolactin, PRL)是同源蛋白质, 由190—209个氨基酸构成, 被认为是来源于同一个祖先基因的两段连续的串联重复序列[1]。之后的研究发现鱼类生长催乳素(Somatolactin, SMTL)与GH/PRL家族成员具有较高的相似性[2], 但是SMTL、GH和PRL是否来源于同一祖先基因依然是一个悬而未决的问题。不论在硬骨鱼还是其他脊椎动物中, GH/PRL家族成员都是由垂体分泌的。作为一类肽类激素, GH及其家族成员结合相应的膜受体后激活酪氨酸激酶詹纳斯激酶2(JAK2), 开启多条信号转导途径从而起始一系列生物反应。这些反应包括细胞的增殖、分化、迁移、抗凋亡、细胞骨架的重组以及调控代谢通路等[3]。
生长激素受体(Growth hormone receptor, GHR)及催乳素受体(Prolactin receptor, PRLR)属于细胞激酶受体超家族。与配体家族相似, GH/PRL蛋白家族的受体同样被认为由同一祖先进化而来。所有这些受体都是单链的跨膜蛋白, 由膜外区、跨膜区和膜内区三部分组成, 属于细胞激酶I型受体。它们本身不具有激酶活性, 对于下游信号传导过程的激活需要受体相关激酶如詹纳斯激酶(JAK)及Src激酶的参与[4, 5]。
不同于GH的受体GHR和PRL的受体PRLR,对于SMTL受体的鉴定工作一直存在争议。最早关于 SMTL受体的报道来自于鲑鱼(Salmo salar), 报道将SMTL受体划归为GHRa的进化分支[6]。后续在青 鳉(Oryzias latipes)及其他鱼类中的研究让人们更加相信GHRa是真正的SMTL的受体, 而GHRb才是GH的受体[7,8]。然而, 也有不少研究对这一观点持否定看法, 研究者在鲷鱼(Acanthopagrus schlegeli)、鳗鱼(Anguilla japonica)、虹鳟(Oncorhynchus mykiss)以及最近在斑马鱼(Danio rerio)中的研究都认为相比于SMTL, GH和GHR成员之间存在较高的亲和性[9—12]。这些结果都提示GH/PRL蛋白家族与它们相应的受体可能并非严格的一一对应关系,它们之间很可能存在交叉作用。
在之前的研究中, 我们在斑马鱼的卵巢中检测到gh及其受体ghra基因的转录, 并且在2细胞期的胚胎中检测到这2种基因的母源表达[13]。我们的合作者也发现在小鼠早期发育的时期中, GH的表达贯穿始终[14]。这些结果暗示, GH/PRL家族成员在脊椎动物早期胚胎发育过程中可能存在重要作用。但是, 目前对于 GH/PRL家族成员及其受体编码基因在胚胎发育早期进行详细表达分析的报道极少。对GH/PRL家族及其受体基因家族成员在胚胎发育早期的表达模式进行刻画, 对于我们进一步研究GH/PRL家族信号通路在斑马鱼早期发育中的作用有重要的指导意义。
1 材料与方法
1.1 实验鱼及胚胎收集
实验所用斑马鱼(Danio rerio)来自于国家斑马鱼资源中心(中国科学院水生生物研究所, 武汉),按照斑马鱼手册方法培养[15]。胚胎通过自然受精方法获得, 受精后的胚胎用200 μL的10 mg/mL 蛋白酶(Sigma-Aldrich, USA)脱去绒毛膜。脱膜后的胚胎置于底部有琼脂的塑料培养皿中, 使用 0.3X Danieau’s Buffer [58 mmol/L NaCl、0.7 mmol/L KCl、0.4 mmol/L MgSO4、0.6 mmol/L Ca(NO3)2、5 mmol/L Hepes, pH 7.6]在28.5℃培养。用于Real-time PCR分析的胚胎达到特定时期(2 细胞期、high oblong、75% 外包、体节早期、受精后 1d、受精后 2d、受精后 3d、成鱼的脑及肝脏)后, 将胚胎放于TRIzol®试剂, 保存于–70℃冰箱。用于原位杂交的胚胎达到特定时期(1 细胞期、75%外包、体节早期、体节中期、受精后1d、受精后2d)后, 用4%的多聚甲醛 4℃固定过夜。胚胎发育阶段的界定参见Kimmel等的描述[16]。
1.2 全长cDNA的克隆及基因亚克隆、质粒构建及体外转录
根据 GenBank(http://www.ncbi.nlm.nih.gov/genbank/)提供的序列信息, 设计用于克隆gh (NM_001020492.2)、prl (NM_181437.3)、prl2 (FJ475111.1)、smtla (NM_ 001037706.1)、smtlb (NM_001037674.1)、ghra (NM_ 001083578.1)、ghrb (NM_001111081.1)、prlra (NM_ 001128677.1)、prlrb (NM_001113500.1)基因全长cDNA的引物(表1)。以斑马鱼脑及肝脏cDNA为模板, 使用 dNTPs, LA Taq®(TAKARA, Japan), LA Taq®Buffer, MgSO4以及相应的引物扩增gh、prl、prl2、smtla、smtlb、ghra、ghrb、prlra、prlrb基因的CDS。然后使用单酶切或双酶切将扩增出的CDS序列亚克隆到 pCS2+质粒载体中, 挑克隆测序验证。重组质粒使用Not I 单酶切得到线性化质粒, 然后使用SP6 RNA聚合酶mMessage mMachine试剂盒(Ambion, USA)合成相应的 mRNA。全长 cDNA克隆所用引物见表1。

表1 全长cDNA克隆所用引物信息Tab. 1 Primers used for cDNA clone
1.3 斑马鱼 GH/PRL蛋白家族及其受体成员序列分析
通过我们克隆得到的全长 cDNA序列, 使用Vector NTI (美国Invitrogen公司)软件翻译得到GH、PRL、PRL2、SMTLα、SMTLβ、GHRa、GHRb、PRLRa、PRLRb的氨基酸序列信息。通过Vector NTI软件的Align X模块分别对配体家族成员及受体成员进行多序列比对, 并根据文献所述对配体及受体的重要功能域进行同源比对[17]。
1.4 实时定量聚合酶链式反应(Real-time PCR)
根据前述克隆得到的全长 cDNA序列以及GenBank中获得的β-actin (NW_001878804.3) 序列信息, 设计用于实时定量PCR的引物(表2)。将TRIzol中保存的胚胎充分匀浆, 用酚-氯仿法提取 RNA并将抽提产物用DNase I处理。使用ReverTra Ace反转录试剂盒(TOYOBO, Japan), 将 2 μg总 RNA产物以Oligo (dT)为引物反转录合成cDNA。将合成好cDNA与引物, 反应缓冲液以及iTaq Universal SYBR Green Supermix (BIO-RAD, USA)混合好放入 CFX96 实时定量PCR仪(BIO-RAD, USA)中反应。所有反应均按以下条件设置: 95℃预变性1min后, 以95℃ 15s、 60℃ 15s、72℃ 45s反应40个循环, 之后接一步默认的溶解曲线分析程序。实验数据(Ct值)通过 CFX manager软件(BIO-RAD, USA)获得, 以β-actin作为内参照物使用 2–ΔΔCt方法[18]处理实验结果。多组数据平均值之间的显著性差异使用SPSS 13.0 (SPSS Inc., USA)通过单因素方差分析及Duncan’s multiple range检验分析确定。实验中所用引物见表2。
1.5 全胚胎原位杂交
将前述的重组质粒用Hind III (NEB, USA)单酶切, 形成线性化质粒。以此线性化质粒为模板, 使用T7 RNA聚合酶(Promega, USA)和地高辛RNA标记混合物(Roche, USA)进行体外转录合成得到反义RNA探针。将 4%多聚甲醛固定的胚胎参照 Thisse等的方法进行全胚胎原位杂交[19]。

表2 实时定量PCR所用引物信息Tab. 2 Primers used for Real-time PCR
1.6 体内荧光素酶分析
向斑马鱼1细胞期胚胎注射pTKRenilla荧光素酶报告质粒(Promega, 0.5 pg)与 pGL3 spi2.1质粒(50 pg)混合注射液来评估GH/PRL家族信号通路活性水平。pTKRenilla荧光素酶报告质粒作为内参。之后向这些胚胎中分别注射 gh mRNA (300 pg)、ghra (400 pg)、gh+ghra (300 pg+400 pg)、prl+ghra(300 pg+400 pg)、prl2+ghra(300 pg+400 pg)、smtlα+ ghra (300 pg+400 pg)、smtlβ+ghra(300 pg+400 pg) mRNA注射液。待注射的胚胎发育至1dpf时, 使用Passive Lysis Buffer裂解胚胎。荧光素酶活性通过Dual Luciferase Reporter Assay System (Promega, USA)获得。荧光素酶相对活性的计算按本实验室已鉴定方法[20]。多组数据平均值之间的显著性差异使用SPSS 13.0 (SPSS Inc., USA)通过单因素方差分析及Duncan’s multiple range检验分析确定。P值< 0.05认为存在显著性。
2 结果
2.1 斑马鱼 GH/PRL蛋白家族成员及其受体的氨基酸序列分析
斑马鱼 GH/PRL基因家族主要包括 5个成员,分别是growth hormone (gh)、 prolactin (prl)、prolactin 2 (prl2)、somatolactin alpha (smtla)以及somatolactin beta (smtlb)。相应的, 在受体基因家族中有4个成员,分别是 growth hormone receptor a (ghra)、growth hormone receptor b (ghrb)、prolactin receptor a (prlra)以及prolactin receptor b (prlrb)。它们的核苷酸序列相似性较高, 配体基因之间的相似性在 40%左右,而受体基因的相似性则高达 63%, 这暗示配体和受体家族成员分别来源于同一祖先基因。对于这样 2类蛋白家族, 我们更多地是关注其氨基酸序列之间的相似性。
在斑马鱼 GH/PRL配体家族中, 虽然蛋白成员之间的氨基酸序列相似性仅为 30.9%, 但是几个重要功能域的序列存在较高的保守性。根据人GH相关研究推定的两个受体结合域中, 结合域 1中占据85%结合能力的8个关键氨基酸位点中的P61、K172位点在斑马鱼 GH/PRL配体家族成员中完全保守, R61、T175、F176和R176等4个位点在配体家族成员中高度保守; 结合域2中关键氨基酸位点G120在所有GH/PRL配体家族成员中完全保守[17]。这一结果揭示, GH/PRL蛋白家族的各成员可能都具有与GHR结合的能力。
斑马鱼GH/PRL受体家族成员的氨基酸序列更加保守, 序列相似程度达49.8%。与配体家族成员类似, 保守的氨基酸位点主要集中在关键的功能域。其中负责与配体结合的胞外段序列相似性为64.9%,值得注意的是与 GH结合的两个关键氨基酸位点W104、W169在受体家族成员中完全保守。此外, 受体成员的跨膜段以及膜内段的box1、box2也保持高度同源性, 其中box1结构域有高达75%的氨基酸位点完全保守(图1); 而主要的序列差异则发生在胞内段的box2下游, 这暗示不同的受体成员对下游信号有着不同的激活作用。
2.2 GH/PRL家族成员及其受体基因在斑马鱼早
期胚胎中的相对表达分析
为了研究GH/PRL家族配体和受体成员在斑马鱼胚胎发育早期的表达模式, 我们首先利用荧光定量PCR技术检测所有这些基因在斑马鱼早期发育重要时期的表达情况。在配体基因家族中, 可以检测到gh以及smtla在2细胞期存在转录(图2A、2C)。在此之后, 配体家族成员的基因表达全部消失。这一表达沉默一直持续到受精后 1d (1day postfertilization, 1dpf), 从1dpf开始, 可以检测到合子型的prl和smtla表达(图 2B、2C); 到2dpf, gh以及smtlb也开始了合子表达(图 2A、2D); prl2在 3dpf仍然没有表达。
在受体基因家族中, ghra以及ghrb的早期表达可以在 2细胞期检测到, 在此之后, 它们的表达量减少(图 3A、3B)。到75%外包时期, 所有的受体家族成员基因都出现了一次急剧的表达增加(图 3A—3D)。这一轮的表达持续到 1dpf的胚胎, 此时新的一轮表达开始出现, 4个基因的表达量又一次提升到更高的水平。形成与配体基因表达相对应的一个转录峰值。
2.3 GH/PRL家族成员及其受体基因在斑马鱼胚胎发育过程中的时空表达分析
通过实时荧光定量PCR实验, 我们在配体家族和受体家族中共发现了4个在2细胞期存在表达的基因, 分别是配体家族的gh、smtla和受体家族的ghra、ghrb。针对这4种可能存在母源表达的基因, 我们利用全胚胎原位杂交技术对它们在斑马鱼卵巢组织和胚胎形成期的时空表达进行详细分析。
与荧光定量PCR的结果相一致, 对卵巢组织的原位杂交分析表明gh以及smtla的转录本可以在卵巢组织中不同发育阶段的卵母细胞中被检测到(图4A、4C)。受精之后, 在1细胞期的胚胎中, 这些基因的表达产物广泛分布在整个细胞中(图 4E、4J)。而利用正义RNA探针作为对照的组织及胚胎中, 则没有检测到表达信号(图 4B、4D、4F、4K)。在此之后, 直到1 dpf, 配体基因的合子型表达才开始激活。此时, 在头部前端口凹形成处附近出现了有分泌功能的垂体细胞系[21], 这簇细胞开始表达合子型的smtla基因(图 4M、4N)。从受精后26h左右开始,功能性的垂体前体开始内化, 向头部内侧迁移, 到2 dpf的时候, gh的表达也开始在这一簇细胞出现(图 4H、4I)。

图1 斑马鱼GH/PRL受体家族成员序列的多重比对分析Fig. 1 Multiple alignment of members’ sequences in zebrafish GH/PRL receptor family

图2 GH/PRL家族成员在斑马鱼早期胚胎中的相对表达分析Fig. 2 Relative expression analysis of GH/PRL family members in Zebrafish embryos

图3 GH/PRL受体家族成员在斑马鱼早期胚胎中的相对表达分析Fig. 3 Relative expression analysis of GH/PRL receptor family members in Zebrafish embryos

图4 GH/PRL家族成员在斑马鱼卵巢组织和早期胚胎中的时空表达Fig. 4 Spatio-temporal expression of GH/PRL family members in Zebrafish ovary and embryos
在受体家族中, ghra以及ghrb的表达图式非常相似。在卵巢组织内就可以检测到基因在卵母细胞中的表达(图 5A、5C)。在1细胞期, 基因的表达分布在整个细胞中(图 5E、5J), 之后表达信号逐渐减弱。而利用正义RNA探针作为对照的组织及胚胎中,则检测不到表达信号(图 5B、5D、5F、5K)。从体节期开始, ghra定位表达在胚胎中线附近的内层细胞(图 5G), ghrb表达在胚胎的后部(图 5L)。到受精后20h, ghra以及ghrb的信号开始在体节区域表达(图 5H, 5M), 这一定位表达持续到 1 dpf左右(图5I、5N), 这些结果与荧光定量PCR的结果一致。

图5 GH/PRL受体家族成员在斑马鱼卵巢组织和早期胚胎中的时空表达Fig. 5 Spatio-temporal expression of GH/PRL receptor family members in zebrafish ovary and embryos
2.4 GH/PRL配体家族成员与 GHRa互作的初步分析
通过荧光定量PCR及原位杂交实验, 我们已经证明gh/prl家族成员及其受体基因存在母源和早期胚胎表达的现象。另外通过原位杂交的结果我们发现, 在 1细胞期, 无论是配体家族的 gh、smtla, 还是受体家族中ghra、ghrb的表达均广泛分布在整个细胞内。此外, 考虑配体和受体家族成员的重要功能域在氨基酸序列上的高度保守性(图2), 我们推测在斑马鱼早期胚胎中, GH/PRL家族成员与配体家族成员之间存在交叉互作。
为了初步验证我们的推测, 我们利用此前建立的评估GH/PRL家族信号通路活性的spi2.1启动子荧光素酶报告系统来评估GHRa与配体家族成员之间的相互作用[16]。实验结果显示(图6), 单独注射gh mRNA并不能显著增强spi2.1启动子的活性。单独注射ghra mRNA可以显著增强spi2.1启动子活性至约1.79倍。通过共注射ghra以及gh/prl家族成员的mRNA, spi2.1的启动子活性相较于野生型增加至1.86—5.10倍, 且配体mRNA与ghra mRNA共注射后激活spi2.1启动子的活性均显著高于ghra mRNA单独注射的效应, 这表明过表达的配体与GHRa均存在互作。同时,结果显示各配体与GHRa互作后激活下游信号通路能力的总趋势为PRL>SMTL>GH。通过以上结果,我们初步证实了GH/PRL家族各配体成员与受体成员GHRa之间在胚胎发育早期存在相互作用, 这为我们后续的实验提供了模型, 也为我们今后对GH/PRL家族信号通路的功能研究奠定了基础。
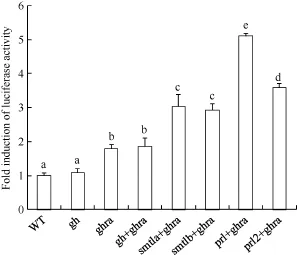
图6 GH/PRL配体家族成员与GHRa互作的spi2.1启动子活性分析Fig. 6 Spi2.1 promoter assay of GH/PRL family member coinjection with GHRa
3 讨论
生长激素属于GH/PRL蛋白质超家族, 是由垂体分泌的, 调控细胞增殖、分化和迁移, 促进生物体生长的一种重要多肽类激素[1]。目前关于GH/PRL超家族信号通路对动物出生后生长的研究已经相当成熟。但是, 最近的一些研究发现GH/PRL家族成员在生物体发育的早期存在表达[20], 这些结果暗示GH/PRL家族在生物体早期发育过程中可能存在重要功能。目前对于生长激素配体家族及受体家族成员在早期发育过程中的表达缺乏系统分析, 这严重阻碍了我们对于其功能的研究。
在本实验中, 我们以斑马鱼为研究对象, 首先通过氨基酸序列比对发现, 无论在配体家族还是受体家族中, 成员间的氨基酸相似程度较高, 而主要的保守区域集中在重要的功能域位置。在配体成员中, 与受体结合的两个重要功能域的重要氨基酸位点均高度保守。而在受体家族中, 与配体结合的膜外段也有较高的序列相似性。这些结果提示在GH/PRL配体家族与受体成员间可能存在相互作用。
虽然之前有研究者对GH/PRL家族成员的早期表达进行了刻画, 但是他们基本都针对家族中个别基因进行研究[20,22], 相关研究并不系统。为了进一步研究该家族配体和受体成员在斑马鱼早期胚胎中的表达情况, 我们通过荧光定量PCR技术对生长激素家族所有配体和受体成员的表达进行了细致分析。结果发现, gh和smtla存在母源表达。在2细胞期之后, mRNA的表达丰度大大降低, 从卵裂期到囊胚期维持在最低水平。到受精后1天, prl和smtla的合子型表达开始出现, 受精后2天, gh和smtlb的表达再次出现。在受体家族中, ghra和ghrb的mRNA表达可以在2细胞期被检测到, 其表达丰度在卵裂期大大降低。到原肠胚期所有受体家族成员的基因表达量明显升高, 表明合子型受体家族成员表达的开始显著早于功能性垂体的发育。
更进一步, 我们利用原位杂交技术详细刻画了该家族具有母源或早期表达的配体和受体成员在鱼类早期发育中的时空表达模式。通过对斑马鱼卵巢组织和发育的不同阶段的胚胎进行表达分析。我们发现, 具有母源表达的gh、smtla以及受体家族的ghra、ghrb的mRNA在发育的卵母细胞和受精后1细胞期的斑马鱼胚胎中广泛存在。在囊胚期开始后,这些基因的mRNA表达消失。到75%外包时期, ghra开始定位表达在胚胎中线附近的内层细胞而ghrb表达在胚胎的后部。到受精后20h, ghra以及ghrb的信号开始在体节区域并持续到1dpf。与此同时, smtla的合子表达特异性的出现在头部前端口凹形成处,到2dpf, gh的合子型mRNA也可以在头部检测到特异的表达信号。
GH/PRL家族成员与其受体之间的对应关系一直存在较大争议[12]。实际上, 由于GH/PRL家族成员及其受体成员之间的结构保守性较高, 很难在它们之间划定严格的一一对应关系。通过双荧光素酶报告系统, 我们发现在斑马鱼早期胚胎中共注射gh/prl家族成员与ghra mRNA后, 荧光素酶相对活性比野生型胚胎提高1.8—5.1倍。这说明在斑马鱼早期胚胎中GH/PRL配体家族成员均能与GHRa互作并激活下游基因的转录, 而这其中prl与ghra共注射之后的增强效果最为明显, 这可能与不同配体在早期胚胎发育中的内源表达水平相关。由于prl不存在母源的本底表达, 因此注射外源prl mRNA可能对下游信号有更强的激活作用。
综上所述, 我们的研究发现生长激素信号配体家族及受体家族中均存在母源表达的成员, 这暗示了GH/PRL家族信号通路在斑马鱼早期胚胎发育中的重要功能。而针对该信号通路靶基因 spi2.1的启动子活性分析结果也初步证明, 在斑马鱼早期胚胎中配体家族成员与受体之间存在交叉作用。这提示我们GH/PRL家族信号通路在斑马鱼早期发育中的作用是通过家族成员之间的协同作用来实现的。
[1] Lanning N, Carter-Su C. Recent advances in growth hormone signaling [J]. Reviews in Endocrine & Metabolic Disorders, 2006, 7(4): 225—235
[2] Rand-Weaver M, Noso T, Muramoto K, et al. Isolation and characterization of somatolactin, a new protein related to growth hormone and prolactin from Atlantic cod (Gadus morhua) pituitary glands [J]. Biochemistry, 1991, 30(6): 1509—1515
[3] Pantaleon M, Whiteside E, Harvey M, et al. Functional growth hormone (GH) receptors and GH are expressed by preimplantation mouse embryos: A role for GH in early embryogenesis [J]. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(10): 5125
[4] Frank S, Gilliland G, Kraft A, et al. Interaction of the growth hormone receptor cytoplasmic domain with the JAK2 tyrosine kinase [J]. Endocrinology, 1994, 135(5): 2228—2239
[5] Zhu T, Ling L, Lobie P E. Identification of a JAK2-independent Pathway Regulating Growth Hormone (GH)-stimulated p44/42 Mitogen-activated Protein Kinase Activity GH Activation of Ral and Phospholipase D is Src-dependent [J]. Journal of Biological Chemistry, 2002, 277(47): 45592—45603
[6] Fukada H, Ozaki Y, Pierce A L, et al. Identification of the salmon somatolactin receptor, a new member of the cytokine receptor family [J]. Endocrinology, 2005, 146(5): 2354—2361
[7] Benedet S, Björnsson B T, Taranger G L, et al. Cloning of somatolactin alpha, beta forms and the somatolactin receptor in Atlantic salmon: seasonal expression profile in pituitary and ovary of maturing female broodstock [J]. Reproductive Biology and Endocrinology, 2008, 6(1): 42
[8] Fukamachi S, Yada T, Mitani H. Medaka receptors for somatolactin and growth hormone: phylogenetic paradox among fish growth hormone receptors [J]. Genetics, 2005, 171(4): 1875—1883
[9] Jiao B, Huang X, Chan C B, et al. The co-existence of two growth hormone receptors in teleost fish and their differential signal transduction, tissue distribution and hormonal regulation of expression in seabream [J]. Journal of Molecular Endocrinology, 2006, 36(1): 23—40
[10] Ozaki Y, Fukada H, Kazeto Y, et al. Molecular cloning and characterization of growth hormone receptor and its homologue in the Japanese eel (Anguilla japonica) [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2006, 143(4): 422—431
[11] Reindl K M, Kittilson J D, Sheridan M A. Differential ligand binding and agonist-induced regulation characteristics of the two rainbow trout GH receptors, Ghr1 and Ghr2, in transfected cells [J]. Journal of Endocrinology, 2009, 202(3): 463—471
[12] Chen M, Huang X, Yuen DSH, et al. A study on the functional interaction between the GH/PRL family of polypeptides with their receptors in zebrafish: Evidence against GHR1 being the receptor for somatolactin [J]. Molecular and Cellular Endocrinology, 2011, 337(1—2): 114—121
[13] Ishtiaq Ahmed A, Xiong F, Pang S C, et al. Activation of GH signaling and GH-independent stimulation of growth in zebrafish by introduction of a constitutively activated GHR construct [J]. Transgenic Research, 2011, 20(3): 557—567
[14] Waters M, Kaye P. The role of growth hormone in fetal development [J]. Growth Hormone & IGF Research, 2002, 12(3): 137—146
[15] Westerfield M. The Zebrafish Book [M]. 5th ed. Eugene: University of Oregon Press. 2000, 1—348
[16] Kimmel C, Ballard W, Kimmel S, et al. Stages of embryonic development of the zebrafish [J]. American Journal of Anatomy, 1995, 203(3): 253—310
[17] Wells J A. Binding in the growth hormone receptor complex [J]. Proceedings of the National Academy of Sciences, 1996, 93(1): 1—6
[18] Livak K J, Schmittgen T D. Analysis of relative gene expression data using Real-time quantitative PCR and the 2−ΔΔCTmethod [J]. Methods, 2001, 25(4): 402—408
[19] Thisse C, Thisse B. High-resolution in situ hybridization to whole-mount zebrafish embryos [J]. Nature Protocols, 2007, 3(1): 59—69
[20] Ahmed I, Yu L Q, Zhu Z Y, et al. Comparative expression analysis of GHR signaling related factors in zebrafish (Danio Rerio) and an in vivo model to study GHR signaling [J]. Acta Hydrobiologica Sinica, 2011, 35(5): 727—738 [Abu Shufian Ishtiaq Ahmed, 于力群, 朱作言, 等. 生长激素受体信号相关因子在斑马鱼中的比较表达分析及 GHR 信号通路体内研究模型的建立. 水生生物学报, 2011, 35(5): 727—738]
[21] Pogoda H M, Hammerschmidt M. How to make a teleost adenohypophysis: molecular pathways of pituitary development in zebrafish [J]. Molecular and Cellular Endocrinology, 2009, 312(1-2): 2—13
[22] Di Prinzio C M, Botta P E, Barriga E H, et al. Growth hormone receptors in zebrafish (Danio rerio): Adult and embryonic expression patterns [J]. Gene Expression Patterns, 2010, 10(4): 214—225
THE COMPARATIVE EXPRESSION AND CROSS-INTERACTIONS OF GROWTH HORMONE/PROLACTIN LIGAND AND RECEPTOR FAMILY MEMBERS IN ZEBRAFISH EARLY EMBRYOS
YU Li-Qun1,2, WANG Hou-Peng1, ZHU Zuo-Yan1and SUN Yong-Hua1
(1. State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China)
Growth hormone (GH) is a member of the GH/Prolactin (PRL) protein super family. It is secreted by anterior pituitary and critically involved in the regulation of cell proliferation, differentiation and migration. Using RT-PCR (reverse-transcription PCR), our previous study revealed that both gh and its receptor gene ghra (growth hormone receptor a) were maternally expressed in zebrafish. This suggested that the GH/GHR signaling pathway might play an important role at the early stage of zebrafish development. To further study the function of GH/PRL signaling pathway in zebrafish embryogenesis, here we characterized and compared the expression patterns of gh/prl and their receptor family members in early embryonic development using real-time PCR and in situ hybridization. We found that the ligand family members, gh and somatolactin (smtl), and the receptor gene family members, ghra and ghrb, were maternally expressed in zebrafish. The analysis of spi2.1 promoter activity indicated the cross-interaction between various ligand family members and GHRa in the early embryos of zebrafish. Our results demonstrated the important role of the GH/PRL family signaling pathway in the early development of zebrafish.
Growth hormone; Growth hormone receptor; GH/PRL family signaling pathways; Zebrafish; Early expression
Q344+.1
A
1000-3207(2014)05-0809-10
10.7541/2014.122
2013-05-02;
2014-01-02
科技部973计划课题(2010CB126306); 国家自然科学基金面上项目(30972248、2011FBZ23)资助
于力群(1987—), 男, 山东烟台人; 硕士研究生; 主要研究方向遗传学。E-mail: biologyu@gmail.com
孙永华, 研究员; E-mail: yhsun@ihb.ac.cn
