真眼点藻纲的系统分类、生物学特性及应用研究
2014-03-17高保燕张成武万凌琳李爱芬
高保燕 张成武 万凌琳 李爱芬
(暨南大学水生生物研究所生态学系, 广州510632)
真眼点藻纲的系统分类、生物学特性及应用研究
高保燕 张成武 万凌琳 李爱芬
(暨南大学水生生物研究所生态学系, 广州510632)
真眼点藻纲是1970年、1971年Hibberd 和 Leedale根据其细胞学和超微结构的特征, 将原黄藻纲中的一些成员重新调整而成立的一个新纲。自该纲成立以来, 由于新种不断被发现, 科、属和种的数量都有所增加, 目前该纲已有1目6科13个属28个种。该纲藻类的主要细胞光合作用色素包括: 叶绿素a、堇菜黄素、无隔藻黄素和β-胡萝卜素; 细胞内具有一周生裂叶状的叶绿体或多个盘状的叶绿体, 具一柄状蛋白核或无, 叶绿体内具有三条类囊体为一组的片层, 无环带形的片层, 双层叶绿体膜外有一层叶绿体内质网膜包裹,它不与核膜相连; 细胞中具有一个相对较大的、近球形的液泡, 其中含有能振动的颗粒物和一个直径在 1—3 μm的红色球状体; 繁殖方式通常形成2个D形或4个四面体形的似亲孢子, 有时会形成8个或16个的似亲孢子; 大多种类能产生烧瓶状的游动孢子, 游动孢子具有单根两侧排列管状小茸毛的鞭毛(另一根退化)或另具一根为光滑型的鞭毛。通过18S rDNA和rbcL基因序列的分析, 该纲与异鞭藻门其他各纲藻类的亲缘关系得到确定。脂肪酸分析结果发现该纲的藻类皆含有长链多不饱和脂肪酸—二十碳五烯酸。真眼点藻纲的藻类在淡水、海水和土壤表面等环境中都有分布。该纲的拟微绿球藻属中多个种类被广泛应用于轮虫、卤虫及珍贵海产品幼苗的开口饵料, 亦已成为二十碳五烯酸和重要类胡萝卜素的潜在生产藻株。另外, 研究发现该纲的大多数种类富含油脂, 它们已成为微藻生物燃料开发的备选藻种资源。
真眼点藻纲; 超微结构; 系统演化; 生化组分; 商业应用价值
根据细胞学和超微结构的特征, 主要是游动孢子的一些特征, 尤其是位于叶绿体外尺寸较大的眼点和特殊结构, 以及鞭毛突起的位置; 营养细胞中红色球体的存在和蛋白核的形态结构。Hibberd和Leedale于1970—1971年把真眼点藻从黄藻纲中分出成立一个新的纲—真眼点藻纲(Eustigmatophyceae)[1,2], 后来的研究也发现这些藻类的光合作用色素组成也不同于黄藻纲种类的光合作用色素组成。
自真眼点藻从黄藻纲分出之后, 其分类系统已被藻类学家所接受, 由于研究的不断深入, 原属于黄藻纲的一些种又被重新再鉴定以及新种不断被发现, 原初归属于该纲的种类仅有 12个种[3], 增加到目前的 28个种, 同时新成立了 2个科[叶藻科(Loboaceae)和角绿藻科(Goniochloridaceae)]。而对于真眼点藻纲藻类的分子鉴定、细胞超微结构、生化组成和开发应用方面的研究亦已取得较大的进展, 本文拟对真眼点藻纲的系统分类、细胞超微结构、生化组成、生态分布和开发应用前景等进行较全面的综述。
1 真眼点藻纲细胞学和超微结构
真眼点藻纲的藻类为真核细胞, 大多数为单细胞, 球形、多角形或细胞壁表面有突起, 多数种类有一个周生裂叶状的、绿色或黄绿色的叶绿体或多个盘状的叶绿体。细胞质中具有一个相对较大的、近球形的液泡, 其中含有许多能振动的颗粒物; 还具有一个直径在1—3 μm的红色球状体(Reddish globule),它的颜色从灰黄—褐色到红—褐色变化, 通常随着培养时间的延长会变大变暗。大多种类具有一个明显的蛋白核, 但只出现在营养细胞中, 在游动孢子中未发现。通过电子显微镜可以观察到蛋白核以一个小茎从叶绿体内面突出, 被具有精细片层内容物的扁平状液泡环绕; 蛋白核基质没有被类囊体所贯穿; 营养细胞和游动孢子的叶绿体内具有三条类囊体为一组的片层, 无环带形的片层。双层叶绿体膜外有一层叶绿体内质网包裹, 同时叶绿体内质网不与核膜相连。绿囊藻科和拟单胞藻科的成员繁殖方式为形成2个D形或4个刚开始为四面体的似亲孢子。其余各科种类的繁殖方式除了形成似亲孢子外,还可产生游动孢子[4,5]。最近, 我们的观察还发现真眼点藻属和魏氏藻属的所有种在培养条件下均出现形成8个似亲孢子, 甚至16个似亲孢子的繁殖方式,真眼点藻是否具有休眠期和有性繁殖尚不清楚。
游动孢子裸露, 多数种类为烧瓶状(Lageniform), 后端三分之二平的, 窄的一面是倾斜截面形。大多数种类的游动孢子具有一根两侧排列管状小茸毛的鞭毛(但第二个基体通常存在), 靠近顶端着生, 运动时伸向细胞前端。少数种类具有第二根鞭毛, 且比第一根鞭毛要短, 光滑的, 运动时定向于细胞旁侧或后端。茸鞭型鞭毛临近末端有一个膨大的鞭毛膜形成的T形膨胀体, 压扁紧靠眼点上方。鞭毛过渡区有一个过渡螺旋, 有微管和十字纤丝状鞭毛根出现。眼点较大, 它是一位于游动细胞极前端的橙红色复合体, 该复合体由一组大小不一的不规则无膜包裹的微滴组成, 并且整个复合体外无膜包被, 完全独立于叶绿体[6]。核单个, 在眼点和叶绿体前端之间; 叶绿体单个, 拉长的, 核膜与叶绿体相连的内质网膜之间无直接连接。早期 Hibberd等研究者未发现单鞭毛游动孢子中存在高尔基体, 后来Snatos 和Leedale在斧形魏氏藻(Vischeria helvetica)的单鞭毛游动孢子中发现了高尔基体, 因此,单、双鞭毛种类的游动孢子中皆有高尔基体, 紧靠细胞核前端[4,5,7,8]。
2 真眼点藻纲系统分类与演化
真眼点藻纲中仅有一目—真眼点藻目(Eustigmatales Hibberd), 由刚建纲时的4个科6个属增加到现在的6个科13个属, 目前报道的种有28个种。
分科检索表
1. 繁殖至少部分产生游动孢子···············2
1’ . 繁殖不产生游动孢子····················3
2a. 细胞几乎是等径的, 自由漂浮; 游动孢子是单鞭毛的···真眼点藻科(Eustigmataceae Hibberd)
2b. 细胞是卵形的或椭圆形的, 可以产生柄和圆盘的吸附结构或无; 游动孢子具有两条鞭毛····假拟小椿藻科(Pseudocharaciopsidaceae Lee & Bold)
2c. 细胞有四个突起, 轻微的扭转成四面体形或几乎是平的, 卵形游动孢子, 具单条鞭毛, 无眼点················叶藻科(Loboaceae Hegewala)
2d. 单细胞, 三角形, 盘状四角或多角形, 一般具四个、有时多个、偶尔仅三个角; 或盘状、纺锤形、近球形, 偶尔出现多角形细胞; 形成具有单条鞭毛、无眼点的游动孢子······················· ·············角绿藻科(Goniochloridaceae Bailey)
3. 细胞大部分大于 10 μm, 并且通常成对出现, 被薄层胶质所包被···························· ···········绿葡萄藻科(Chlorobotryaceae Pascher)
3’. 细胞直径小于10 μm, 单个的, 不具有胶质层·· ··········拟单胞藻科(Monodopsidaceae Hibberd)
2.1 真眼点藻科(Eustigmataceae Hibberd)
真眼点藻科的种类都是单细胞, 差不多为等直径细胞, 球形, 多面体形或星形。游动孢子为拉长的烧瓶状, 平扁的, 有一条茸鞭型鞭毛[3]。
真眼点藻科的分属要点:
1a. 细胞壁光滑, 细胞为球形·················· ····················真眼点藻属 (Eustigmatos)
1b. 细胞壁典型的具有突起或脊, 细胞为球形····· ·························韦氏藻属(Vischeria)
1c. 细胞壁光滑, 生活史中细胞既有椭圆形又有球形···············假椭圆藻属(Pseudellipsoidion)
真眼点藻属(Eustigmatos Hibberd) 细胞大多为球形, 细胞壁光滑, 无花饰; 通常具有1个周生叶绿体; 细胞内具一液泡, 内含能够震动的颗粒,有一红色球体; 繁殖方式通过形成2或4似亲孢子和具单鞭毛的游动孢子。该属大多种类生活于土壤生境中。
真眼点藻属各种的分类要点:
1a. 细胞大多数直径为7—9 μm, 在培养条件下, 从未出现大于20 μm的细胞····················· ·············魏氏真眼点藻(Eustigmatos vischeri)
1b. 细胞大多直径为 9—18 μm, 在培养条件下, 可能或不可能产生大于20 μm的细胞 ···········2
2a. 细胞大多直径为 9—18 μm, 但在培养条件下会出现一些20—50 μm的细胞 ·················· ···············大真眼点藻(Eustigmatos magnus)
2b. 细胞大多直径为 11—15 μm, 在培养条件下很少出现大于20 μm的细胞····················· ···········波氏真眼点藻(Eustigmatos polyphem)
大真眼点藻(Eustigmatos magnus (Petersen) Hibberd): 营养细胞为球形或卵圆形, 具有蛋白核,拉长的、单鞭毛的游动孢子前端具有一个眼点。与真眼点藻属其他藻的区别是有较宽的细胞大小变化范围, 为20—45 μm, 在培养条件下, 会出现大细胞[3]。
波氏真眼点藻(Eustigmatos polyphem (Pistchmann) Hibberd): 波氏真眼点藻形态与大真眼点藻和魏氏真眼点藻形态相似, 其营养细胞为球形, 大多直径为10—11 μm, 最大为15 μm。具有1个裂叶状周生叶绿体, 有一背向叶绿体内面的蛋白核; 细胞质中有液泡, 内含能够震动的颗粒和一红色球体。生殖方式通过形成2或4似亲孢子或单鞭毛的游动孢子。
魏氏真眼点藻(Eustigmatos vischeri Hibberd):单个细胞, 球形, 大多直径为7—9 μm。叶绿体单个,裂叶状周生, 有一个具有茎杆多面体形的蛋白核。液泡有颗粒内容物和一个红色球状体。繁殖方式是产生2或4个似亲孢子, 刚开始为四面体或通过与母细胞挤压为平的, 或者产生烧瓶形的(Lageniform)游动孢子, 前端有单个鞭毛, 有一个突出于叶绿体外位于前端的眼点和一个不含有蛋白核的叶绿体[3]。
魏氏藻属(Vischeria Pascher) 魏氏藻属是Pascher在 1937年命名的, 其特征为细胞壁具有典型的突起, 其突起从少数的相对较大的圆形膨胀到大量的锥形突起不等。在培养条件下, 成熟的细胞大多数是光滑的, 细胞壁无突起, 细胞为等直径的。所有种的游动孢子都是单鞭毛的, 拉长的烧瓶状(elongate-lageniform), 它们和真眼点藻属所有种的游动孢子没多大区别[3]。
魏氏藻属各个种的分类要点:
1a. 细胞壁突起在培养条件下出现相对频繁, 球形;突起小, 圆锥形, 均匀分布···················· ·················星形魏氏藻(Vischeria stellata)
1b. 细胞壁突起在培养条件下相对较少出现, 多面体形····································2
2a. 细胞直径大多为 7—9 μm; 培养条件下罕见多面体形细胞, 视觉上为不规则的五角形或六角形,通常在相同的培养条件下比球形细胞要小········ ················点状魏氏藻(Vischeria punctata)
2b. 细胞直径大多为9—11 μm; 培养条件下罕见多面体形细胞, 视觉上大多为不规则的长菱形或五角形, 在相同的培养条件下大小类似于球形细胞… …斧形魏氏藻(Vischeria helvetica)
星形魏氏藻(Vischeria stellata (Chodat ex Poulton) Hibberd): 营养细胞大小一般为10—15 μm, 偶见细胞大小达到 30 μm以上, 分裂不久的细胞, 其细胞壁表面有脊状突起, 成熟的细胞通常为球形或近球形; 细胞中有一裂叶状周生叶绿体, 内含一蛋白核。能够形成游动孢子, 游动孢子呈瓶状, 长为10—15 μm, 最宽处 5 μm, 在靠近细胞表面和眼点处有一膨大区域。细胞最前端有一个橙红色独立于质体外的眼点, 叶绿体位于细胞后端, 并且缺乏蛋白核, 细胞中含有很多薄膜小泡和螺旋小泡; 一根茸鞭型鞭毛亚顶生, 细胞游动时, 始终伸向前; 透射电子显微镜观察发现, 细胞叶绿体蛋白核以一个小茎从叶绿体内面突出, 被具有精细片层内容物的扁平状液泡环绕; 蛋白核基质没有被类囊体所贯穿; 叶绿体内具有三条类囊体为一组的片层, 无环带形的片层。双层叶绿体膜外有一层叶绿体内质网包裹[3,9]。
点状魏氏藻(Vischeria punctata Vischer): 点状魏氏藻在培养时绝大部分细胞为球形, 只有小部分细胞的细胞壁表面有突起, 这些突起不规则分布而使细胞成多边形。点状魏氏藻中有角细胞大多直径为 6.25—7.5 μm, 明显小于相同培养条件下的球形细胞。而星形魏氏藻和斧形魏氏藻的有突起细胞与球形细胞的大小是相似的。点状魏氏藻尚未发现游动孢子[3]。
斧形魏氏藻(Vischeria Helvetica (Vischer & Pascher) Hibberd): 细胞直径大多为9—11 μm; 培养条件下罕见多面体形细胞, 视觉上大多为不规则的长菱形或五角形, 大小类似于球形细胞。在相同的培养条件下, 斧形魏氏藻的细胞比点状魏氏藻和星形魏氏藻的细胞稍微大一些, 其蛋白核(直径为4.5—5 μm)也一般比点状魏氏藻和星形魏氏藻的蛋白核(直径为3.5 μm)略大[3,8]。
假椭圆藻属(Pseudellipsoidion Neustupa & Němcová) 细胞生活史中既有椭圆形也有球形,细胞壁光滑。在球形细胞中, 多面体的蛋白核和红色球状体在逐渐变化。繁殖方式为产生游动孢子,半似亲孢子或似亲孢子。游动孢子为不规则形或卵形, 有一条显著的鞭毛和质体外前端的眼点[10]。代表种为土生假椭圆藻(Pseudellipsoidion edaphicum)。
土生假椭圆藻(Pseudellipsoidion edaphicum Neustupa & Němcová): 生活史中出现椭圆形和球形细胞。细胞壁光滑。椭圆形细胞的大小为(5, 7—)6, 3—9, 3(—10, 2)×(3, 2—)4, 2—5, 9(—7, 1)μm。球形细胞的大小为(5, 9—)7, 1—10(—12, 8)μm。球形细胞的多面体蛋白核和红色球状体是在不断变化的。细胞中有一到四个叶绿体。大多为1到2个, 很少情况下为 4个, 无环状内囊体片层。繁殖方式为产生游动孢子, 半似亲孢子或似亲孢子。似亲孢子为产生2到8个, 椭圆形或不规则形的细胞。大量产生半似亲孢子的情况很少见。半似亲孢子没有细胞壁和鞭毛, 但含有质体外的眼点。半似亲孢子的大小一般和其游动孢子的大小相同。裸露的游动孢子为不规则形或卵形, 大小为 4, 1—6, 1×2, 5—4, 1(—5) μm。它们具有一个, 极少数情况下为两个周生的叶绿体。在细胞的前端附近, 有一个显著的黄红色, 不规则球形的质体外眼点。游动孢子具有一个顶端鞭毛[10]。
2.2 假拟小椿藻科(Pseudocharaciopsidaceae Lee & Bold ex Hibberd)
单个细胞, 可以产生小柄或盘状吸附结构或无,游动孢子具有两条突出鞭毛。1974年 Lee和 Bold发表假拟小椿藻科(Pseudocharaciopsidaceae)并没有对科的界限进行描述或讨论, 仅包括一单种(德克萨斯假拟小椿藻(Pseudocharaciopsis texensis))的属—假拟小椿藻属(Pseudocharaciopsis), 后来又有 2个种(小假拟小椿藻(Pseudocharaciopsis minuta)和卵形假拟小椿藻(Pseudocharaciopsis ovalis))被并入假拟小椿藻属。起初认为假拟小椿藻是真眼点藻纲中细胞可以产生小柄和盘状吸附结构的种类, 已知的两个种的游动孢子和营养细胞的类型不同于真眼点藻科的细胞, 它们的游动细胞有一个高尔基体和两条突出鞭毛, 其中短的一条在它的长度的大部分都非常窄, 微管仅有两种成分, 这些特点表明假拟小椿藻属的种类组成了一个新的自然类群[3]。1989年Preisig和 Wilhelm 发现一新属—拟葡绿藻属(Botryochloropsis), 模 式 种 为 细 拟 葡 绿 藻(Botryochloropsis similis Preisig & Wilhelm), 其营养细胞无小柄或盘状吸附结构, 游动孢子具有两条突出鞭毛, Preisig和 Wilhelm 认为它应归属于假拟小椿藻科[11]。1937年 Pascher建立的椭圆藻属(Ellipsoidion Pascher), 其营养细胞亦无小柄或盘状吸附结构, 游动孢子具有两条鞭毛分别伸向细胞的前端和后端, 归属于假拟小椿藻科[12]。
假拟小椿藻科的分属要点:
1a. 营养细胞有柄或吸盘固着基质, 细胞形态类似小椿藻和拟小椿藻··························· ·············假拟小椿藻属(Pseudocharaciopsis)
1b. 营养细胞的细胞壁被黏液质层所包围, 细胞相毗邻形成小的或大的群体, 营养细胞无柄或吸盘·· ··················拟葡绿藻属(Botryochloropsis)
1c. 细胞单个, 椭圆形, 两端逐渐变尖, 营养细胞无柄或吸盘················椭圆藻属(Ellipsoidion)
假拟小椿藻属(Pseudocharaciopsis Lee & Bold)假拟小椿藻属的营养细胞非常类似于黄藻纲拟小椿藻属(Characiopsis), 因此也类似于绿藻纲小椿藻属(Characium)。Lee和Bold所描述的属基于游动细胞和营养细胞的结构很明显地属于真眼点藻纲。他们在最开始的分析中包括了有柄蛋白核的特征, 但这儿对于这个属的定义有所修改, 包含有柄的, 产双鞭毛游动孢子的种类, 不管它们是否产生有柄蛋白核。超微结构: 有柄的蛋白核吸附于叶绿体, 叶绿体无环状片层; 叶绿体内质网(CER)与核膜不相连接;游动孢子的眼点位于叶绿体外, 长鞭毛的基部为其膨胀部位[3]。
假拟小椿藻属各个种的分类要点:
1a. 细胞为狭窄的椭圆形, 端部尖锐, 叶绿体通常单个, 有一个球形的带柄的蛋白核·············· ········小假拟小椿藻(Pseudocharaciopsis minuta)
1b. 细胞多核, 圆柱形, 有1到多个叶绿体, 1—4个蛋白核····································德克萨斯假拟小椿藻(Pseudocharaciopsis texensis)
1c. 细胞的大小、形状多样, 有多个叶绿体, 但都不含有蛋白核································ ·······卵形假拟小椿藻(Pseudocharaciopsis ovalis)
小假 拟 小椿 藻 (Pseudocharaciopsis minuta(Braun) Hibberd): 在培养条件下, 生长活跃的细胞大小为(12)20(34)×(3)5(10), 后期的可能会出现大细胞, 35—60 μm长, 10—20 μm宽, 有一个球形带柄的蛋白核[3]。
卵形假拟小椿藻(Pseudocharaciopsis ovalis (Chodat) Hibberd): 细胞为卵形, 有时细胞会出现短柄和圆吸盘与环境底部相连。营养细胞内有两个到多个叶绿体, 有一个从红色到棕色变化的脂滴(又称红色球状体), 不含有蛋白核。卵形假拟小椿藻能产生双鞭毛的游动孢子, 游动孢子前端有一个大的红色眼点, 仅有一个叶绿体[3]。
德克萨斯假拟小椿藻(Pseudocharaciopsis texensis Lee & Bold): 营养细胞为多核, 圆柱形的, 长达32 μm、宽至12 μm, 远侧逐渐变窄, 具小柄和吸盘;细胞壁薄, 随着时间延长并不会显著增厚; 年轻的细胞中有一个周缘叶绿体, 而老细胞中通常有多个叶绿体, 1—4个蛋白核。游动孢子裸露, 粒状的, 变形虫样的, 瓶状的, 后端的三分之二为平的, 平面观8—11 μm长, 最宽处5 μm; 眼点非常靠前, 核也在前端, 游动孢子中有一个叶绿体, 但无蛋白核; 具有两个大的、明显地由膜包裹的嗜锇液泡; 茸鞭型鞭毛临近末端处有一个膨大的鞭毛膜形成的一个扇形膨胀体(不同于真眼点藻纲其他种类的游动孢子鞭毛的T形膨胀体); 游动孢子通过它前端的小孔吸附[13]。
拟葡绿藻属(Botryochloropsis Preisig & Wilhelm)营养细胞的细胞壁被黏液质层所包围, 细胞相毗邻形成小的或大的群体。营养细胞无叶柄或吸盘。在似亲孢子形成后, 细胞仍然相连接。繁殖时很少出现游动孢子。游动孢子有两条突出的鞭毛[11]。代表种为细拟葡绿藻(Botryochloropsis similis Preisig & Wilhelm), 其主要特征如下:
营养细胞通常为球形, 直径为 3—6 μm, 几个或多个细胞通过细胞壁连接形成不规则群体。每个细胞都具有一个不规则浅裂的周生叶绿体, 至今未观察到蛋白核。细胞含有一个红色的脂球体和一些能折射的颗粒。
繁殖主要通过母细胞产生2或4个(或8个)形状相同的似亲孢子。较少情况下, 母细胞会产生 2或4个(或8个)拉长形的游动孢子(4—7 μm长, 2—4 μm 宽)。游动孢子的大部分都被一个不含蛋白核的拉长的叶绿体所占据。在光学显微镜下, 不能观察到眼点。未观察到伸缩泡。在漂浮的游动孢子(长度为7—9 μm)里可观察到一个定向于前的鞭毛, 第二根鞭毛在阴影(Shadow-cast preparations)下较易观察。它与长鞭毛(长度为3—4 μm)相比, 更细, 更短。短鞭毛缺乏绒毛, 而长鞭毛除了尖端的一小段外,其余部分具有两侧排列的硬绒毛。游动孢子可以进行快速滑行游动, 但在盖玻片下, 由于细胞聚集而游动距离变短[11]。
超微结构观察发现, 游动孢子具有一个拉长的叶绿体, 叶绿体内有片层隔开而具有三层内囊体, 无环状片层和蛋白核。核在离叶绿体很近的前端, 但核膜并没有与其周围的任何叶绿体膜相连。线粒体在细胞核较后的位置。单个的高尔基体也在细胞核附近,包含 2—4个囊泡, 有一端处于鞭毛基体旁。在鞭毛基体旁还有一个大的类似眼点的脂类球体[11]。
椭圆藻属(Ellipsoidion Pascher) 细胞单个,椭圆形, 两端逐渐变尖; 每个细胞有 3—4个叶绿体。通过产生似亲孢子的方式繁殖, 同时会出现游动孢子, 游动孢子具有一条长的向前的茸鞭型鞭毛和一条短的向后的光滑型鞭毛。在中营养, 贫营养的水池中可观察到椭圆藻属(Ellipsoidion)[12,15,48]。代表种为尖头椭圆藻(Ellipsoidion acuminatum)。
2.3 叶藻科(Loboaceae Hegewala)
单细胞, 细胞大小 3—7 μm, 具有一个四裂叶状叶绿体, 未见蛋白核, 稍微扭曲成四角或近乎扁平, 休眠孢子球形。生长方式通过分裂形成 2个似亲孢子, 或形成长卵形游动孢子, 具单条鞭毛, 无眼点[14]。模式属为假四角藻属(Pseudotetraëdriella Hegewald)。
假四角藻属(Pseudotetraëdriella Hegewald)产生单鞭毛的游动孢子, 但游动孢子内没有眼点。代表种为卡米尼假四角藻(Pseudotetraëdriella kamillae), 其主要特征如下:
单个细胞, 有 4个突起, 轻微的扭转成四面体形或几乎是平的。突起的形状取决于培养条件。休眠孢子是球形的。年轻的细胞具有一个叶绿体, 在老细胞中有一个或两个叶绿体, 无蛋白核。细胞大小为3—7 μm。在扫描电镜(SEM)下观察细胞壁是光滑的。游动孢子是细长的卵形, 有一条鞭毛, 无眼点。未观察到游动孢子的释放。也未观察到似亲孢子的产生, 是否产生似亲孢子还不清楚[14]。
2.4 角绿藻科(Goniochloridaceae Bailey)
单细胞, 三角形; 或盘状四角或多角形, 一般具四个、有时多个、偶尔仅三个角; 或盘状、纺锤形、近球形, 偶尔出现多角形细胞。生长方式通过分裂形成 2个似亲孢子, 或形成具单条鞭毛、无眼点游动孢子[12,15]。
角绿藻科的分属要点:
1a. 营养细胞四面体形或多面体形, 一般有四个角,有时多个, 偶尔只有三个, 角会拉长分为两个····· ··············假十字趾藻属(Pseudostaurastrum)
1b. 细胞单个, 规则或不规则的三角形, 侧面类似透镜状, 有时扭曲; 细胞壁厚而坚固, 光滑, 有时会有凹凸纹路·············角绿藻属(Goniochloris)
1c. 营养细胞是圆盘状的或梭形的, 或圆端五角形的, 细胞壁有很多短小的突起而相对较厚········ ······················粗盘藻属(Trachydiscus)
假十字趾藻属(Pseudostaurastrum Chodat)营养细胞为四面体或多面体形, 有角, 角会拉长分为两个。有的角上还会有突出形成脊。代表种有:湖生假十字趾藻(Pseudostaurastrum limneticum)和巨大假十字趾藻(Pseudostaurastrum enorme)[12,15]。
湖生假十字趾藻(Pseudostaurastrum limneticum (Borge) Chodat): 营养细胞直径为20—25 μm, 盘形,四面体形或多面体形, 一般有四个角, 有时多个,偶尔只有三个。角会拉长分为两个, 长度达到12 μm。年轻的营养细胞内充满细胞质和叶绿体。横向细胞壁最初是凹的, 逐渐变直, 而老细胞则变得凸出。细胞壁在无损时, 0.2—0.3 μm厚。细胞内有许多透镜形的叶绿体, 大部分在外围。它们大约 5 μm 长, 0.5—1 μm厚, 不含有蛋白核。叶绿体有四层膜。外层膜是光滑的, 未与核膜相连。内囊体系统由互不相连的单个、大的片层所组成。每个片层组成了 3个内囊体。在内囊体内, 未观察到环带状片层和明显包含DNA的区域。细胞核的直径有4—5 μm, 但在光学显微镜下不易观察到。线粒体内有管状的脊。单个, 大的高尔基体与核紧密相连。营养细胞内的高尔基体包含 5—8个囊泡。游动孢子长约 13 μm,在细胞前端接近核的位置有一条明显嵌入、定向向前的, 与细胞同长的鞭毛。未见红色眼点[16]。
巨大假十字趾藻(Pseudostaurastrum enorme (Ralfs) Chodat): 细胞(20—)25—45 μm 大小, 不规则四面体形或多面体形, 有一个短粗的中心体和短的双分叉的臂, 臂上有5—10 μm长的脊; 细胞质内有时会包含许多不清楚特性的颗粒; 叶绿体偶尔会延伸出臂[12]。生态: 可能是世界性分布, 浮游或在酸水池或碱水池中与其他藻同生活。
角绿藻属(Goniochloris Geitler emend. Bourrelly)细胞单个, 规则或不规则的三角形, 侧面类似透镜状, 有时扭曲; 细胞壁厚而坚固, 光滑, 有时会有凹凸纹路; 顶端尖或圆, 偶尔有小的突起; 叶绿体2—6个, 周缘侧生, 盘状或带状; 存在油体和硅藻多糖(leucosin), 通常有1—2个红色色素点; 通过似亲孢子繁殖[12]。代表种为纹筋角绿藻(Goniochloris sculpta), 其主要特征如下:
细胞大多为12—16 μm, 形状为等边三角形, 有着直边和圆角; 细胞壁坚硬, 硅质化, 其上有蜂窝状排列的 1.4 μm大小的凹凸点; 叶绿体四或多个, 圆盘状或轻微拉长; 繁殖方式为产生4个似亲孢子[12]。
生态: 分布在全世界, 生活于沼泽, 池塘和湖泊里。
粗盘藻属(Trachydiscus(Bourr) Ettl) 代表种为小粗盘藻(Trachydiscus minutus), 其主要特征如下: 营养细胞是圆盘状的或梭形的, 或圆端五角形的。细胞的宽边大小范围在7—9 μm。细胞壁有很多短小的突起而相对较厚(0.15—0.25 μm)。单核细胞, 核的直径为0.8—1.4 μm, 有时可以观察到单个的核和染色质。线粒体是长方形的, 长0.7—1.2 μm,有管状的脊。在光学显微镜和透射电镜下, 均未发现蛋白核。细胞具有多个(通常为3—4个)透镜状的周生叶绿体, 叶绿体内不含有环状DNA。从未发现叶绿体的外层膜与核膜相连, 并且叶绿体缺乏环状片层。另一个典型特征是: 细胞内会出现一个清晰可见的淡黄色油滴。其游动孢子是卵形的或纺锤形,裸露的, 没有可以观察到的眼点, 总为单核。游动孢子的大小为(3.5—6) μm×(8.5—11) μm; 它们不具有蛋白核, 通常包含两个叶绿体。游动孢子在近顶端有一根鞭毛, 其上附有茸毛, 并具有公认的真眼点藻纲的特征, 即鞭毛基部膨大。鞭毛的长度轻微的超过游动孢子的长度[17]。
2.5 绿葡萄藻科(Chlorobotryaceae Pascher)
细胞光滑, 细瘦但易弯曲, 单个细胞或群体都被黏胶层包被, 未发现游动孢子。
绿葡萄藻属(Chlorobotrys Bohlin) 细胞球形或卵形; 单个或1到2个细胞被黏液质鞘所包围形成2—32个细胞群体。细胞壁厚而坚硬, 光滑, 常硅质化; 叶绿体周生, 圆盘状, 年轻细胞中单个, 老细胞中多个; 通常有显著的红色色素点, 通过产生似亲孢子繁殖, 未报道发现游动孢子。绿葡萄藻属(Chlorobotrys)是浮游的, 或偶然性浮游。代表种规则绿葡萄藻(Chlorobotrys regularis), 其主要特征为:细胞通常为2或3个, 很少4个或更多, 球形, 直径为(12—)15—20 μm, 被一个宽为34—90 μm的黏质层所包被[18,48]。
2.6 拟单胞藻科(Monodopsidaceae Hibberd)
单细胞、浮游藻类, 细胞为球形, 卵形, 椭圆形或圆柱形, 细胞直径小于10 μm。未发现产生游动孢子。
拟单胞藻科的分属要点:
1a. 细胞最大直径大于5 μm··················· ·····················拟单胞藻属(Monodopsis)
1b. 细胞最大直径小于5 μm··················· ················拟微绿球藻属(Nannochloropsis)
拟单胞藻属(Monodopsis) 细胞单个, 5—10 μm长, 不对称。叶绿体内有一个嵌入的蛋白核。未发现游动孢子[15]。
拟单胞藻属(Monodopsis)是单细胞植物, 生活在贫营养的水池里。在 pH 为 4.5—6.8, 温度为(0—15)℃的生境下全年生长。细胞单个, 自由生活,细胞壁薄, 细胞通常为一端圆, 一端钝的不规则形状, 有时会像梨形或纺锤形; 叶绿体周生, 1或多个,有或无蛋白核; 通过产生似亲孢子繁殖; 最频繁出现在土壤中。代表种为地下拟单胞藻(Monodopsis subterraneus (Petersen) Hibberd), 其主要特征如下:
细胞明显为椭圆体, 有时为不规则的椭圆形,偶尔几乎为纺锤形, 一端通常逐渐变窄到一点, 另一端通常为不规则圆形, 3—5 μm宽, 7—9 μm长; 叶绿体单个, 周生, 大而边缘深裂, 无蛋白核; 每个细胞产生2个似亲孢子。最频繁的为出现在土壤中[15]。
拟微绿球藻属(Nannochloropsis) 细胞球形到卵形, 直径为2—4 μm。或圆柱形, (3—4) μm×1.5 μm。具有一个缺乏蛋白核的黄绿色周生叶绿体。叶绿体表面有明显的突起。未发现游动孢子[19]。
拟微绿球藻属(Nannochloropsis)各个种的分类要点:
1a. 细胞为近球形, 直径为2—4 μm············· ········眼点拟微绿球藻(Nannochloropsis oculata)
1b. 细胞早期为圆柱形, 晚期卵形。红色体很少观察到, (3—4) μm×(1.5—1.7) μm··················· ·········盐生拟微绿球藻(Nannochloropsis salina)
1c. 细胞在早期为球形, 到晚期梨形, 细胞内有许多不动的小颗粒内含物, 大小(2—4) μm×(3—5) μm ········洋生拟微绿球藻(Nannochloropsis oceania)
1d. 细胞早期为球形, 到晚期卵形, 细胞直径为2—4 μm··································· ······颗粒拟微绿球藻(Nannochloropsis granulata)
1e. 细胞在早期为圆柱形, 到晚期卵形, 相对较小的红色体偶尔观察到, 大小(3.5—4) μm×(2.5—3) μm ·······迦得拟微绿球藻(Nannochloropsis gaditana)
1f. 淡水种, 细胞为直径1.5—6 μm的球形到卵形细胞····湖生拟微绿球藻(Nannochloropsis limnetica)
眼点拟微绿球藻(Nannochloropsis oculata (Droop) Hibberd)为单细胞, 自由生活, 细胞为近球形, 直径为2—4 μm, 或圆柱形, (3—4) μm × 1.5 µm, 黄绿色周生叶绿体, 具典型的真眼点藻纲的色素组成, 没有游动孢子出现, 海产种[3]。
洋生拟微绿球藻(N. oceania Suda & Miyashita)的细胞在早期为球形, 到晚期梨形, 细胞内有许多不动的小颗粒内含物。折射体和一个相对较小的红色体较罕见[20]。
颗粒拟微绿球藻(N. granulata Karlson & Potter)的细胞早期为球形, 到晚期卵形, 细胞直径为 2—4 μm,具 1(—4)个叶绿体, 叶绿体片层包含三个相毗邻的内囊体, 无环带状片层。细胞质内无片层囊泡, 无蛋白核, 细胞内有许多折射小颗粒内含物, 其中有些颗粒震动活跃, 许多细胞内有大的红色体, 18S rRNA基因序列与这属的其他种不同[21]。
迦得拟微绿球藻(N. gaditana Lubián)的细胞在早期为圆柱形, 到晚期卵形, 相对较小的红色体和颗粒内含物有时会观察到, 但未见折射体[22]。
盐生拟微绿球藻(N. salina Hibberd)的细胞早期为圆柱形, 晚期卵形。红色体很少观察到, 未见折射体[3]。
迦得拟微绿球藻(N. gaditana)、颗粒拟微绿球藻(N. granulata)、洋生拟微绿球藻(N. oceanica)、眼点拟微绿球藻(N. oculata)和盐生拟微绿球藻(N. salina)这五种拟微绿球藻细胞质均有片状囊泡, 类似蛋白核的结构和细胞壁乳头突起。拟微绿球藻的这个塞子似的乳头在真眼点藻纲中是一个独特的结构, 但其功能还不清楚[23]。
淡水种的湖生拟微绿球藻(N. limnetica)在指数期生长的细胞为直径1.5—6 μm的球形到卵形细胞,自发荧光和DAPI染色显示细胞具有1—8个叶绿体和1—8个细胞核, 其中细胞核的数目与细胞体积相关。偶尔出现直径达到10 μm的大细胞具有多个叶绿体和细胞核。细胞质中出现含有片层体的囊泡、具有双折射力的杆状体和小油脂滴及液泡。在TEM观察下, 叶绿体内3—4条内囊体垛叠形成片层, 含有质体油滴, 叶绿体内质网膜与核膜相连, 出现类似蛋白核的结构。细胞壁具乳头状突起, 除此之外,细胞壁外发现类似丝状结构[24,25]。
3 异鞭藻门各纲的亲缘关系
参照 Přibyl等的研究结果[17], 基于 18S rDNA的序列分析, 使用 MEGA4软件, 通过邻接法, 以Kimura双参数模型建立起异鞭藻门的系统进化树(图1)。由该图可以看出真眼点藻纲在系统演化上与异鞭藻门其他14个纲的亲缘关系, 真眼点藻纲与富含二十碳五烯酸的油藻纲(Pinguiophyceae)和仅具叶绿素a的黄球藻纲(Aurearenophyceae)亲缘关系较近,而与黄藻纲(Xanthophyceae)的亲缘关系较远。
4 真眼藻纲生态习性
真眼点藻经常出现在开放水域, 是真浮游群体,有的是偶然性浮游生物。偶尔, 真眼点藻可能附着于其他植物生活。陆生生境中同样生活有许多真眼点藻, 来源于土壤之中, 特别是高山土壤[12]。
真眼点藻生活的水环境包括池塘、水池、沼泽、溪流、湖泊和海洋。许多真眼点藻适宜的生境为贫营养或中营养、低温(0—15 ) ℃[12,26]。
5 真眼点藻纲藻类细胞主要生化组成及其应用性研究
叶绿素a为仅有的光合作用叶绿素成分, 不含有叶绿素b和c。堇菜黄素(Violaxanthin)是其主要的类胡萝卜素, 另外, 还含有无隔藻黄素酯(Vaucheriaxanthinester) 、玉米黄素、角黄素和 β-胡萝卜素[27,28], 许多拟微绿球藻仍可在细胞中积累一定量的虾青素和角黄素[29]。由于细胞中叶绿素与类胡萝卜素的比例随着培养时间的延长会发生变化, 因此, 培养初期的真眼点藻为绿色(或黄绿色), 随培养时间延长变为褐色到橘红色。有少量文献报道了微藻堇菜黄素的生理活性研究, Pasquet等发现从杜氏藻(Dunaliella tertiolecta)中提取的堇菜黄素具有很强的抗肿瘤细胞增殖作用, 在0.1—40 μg /mL都能抑制人类乳腺癌细胞系MCF-7增殖, 并存在数量效应, 同时会引起肿瘤细胞凋亡[30]。Soontornchaiboon等研究了椭圆小球藻(Chlorella ellipsoidea)中堇菜黄素的抗炎症活性, 结果表明堇菜黄素明显抑制脂多糖刺激的 RAW 264.7小鼠巨噬细胞中一氧化氮合成酶(iNOS)和环氧酶(COX-2)的表达, 从而降低了一氧化氮(NO)和前列腺素 E2(PGE2)的产生; 同时堇菜黄素对转录因子—核因子-κB(NF-κB) p65亚基易位到细胞核的抑制作用, 表明这种抗炎活性的主要机制是抑制转录因子NF-κB途径[31]。鉴于真眼点藻细胞中能够积累多种重要的初生和次生类胡萝卜素, 因此, 它们是一潜在的类胡萝卜素商业化生产的微藻新资源。
真眼点藻纲藻类的主要脂肪酸组成为豆蔻酸(Myristic acid, C14:0)、棕榈酸(Palmitic acid, C16:0)、棕榈油酸(Palmitoleic acid, C16:1)、油酸(Oleic acid, C18:1)、亚油酸(Linoleic acid, C18:2)、花生四烯酸(Arachidonic acid, C20:4)和 二 十 碳 五 烯 酸(Eicosapentaenoic acid, EPA, C20:5), 真眼点藻纲的藻类富含长链多不饱和脂肪酸, 特别是EPA[32—36]。相关的研究报道拟微绿球藻属(Nannochloropsis)的多个品种可以规模化培养, 同时在细胞中可以积累一定量的EPA, 它们已被作为EPA商业化生产的重要藻株[36]。另外, 拟微绿球藻的脂质成分已被用于化妆品和护肤品[38]。
真眼点藻纲的拟微绿球藻(Nannochloropsis sp.)的捕光色素蛋白复合物(Light-harvesting chlorophyllprotein complex)既不含叶绿素 b, 又不含叶绿素 c,捕光色素复合物分子大小为26 kD, 平均含有9个叶绿素a和4个堇菜黄素, 活体荧光光谱证明从叶黄素到叶绿素 a的能量传递, 捕光蛋白与高等植物和杂色藻类的捕光蛋白不发生免疫交叉反应, 但其N-末端的结构与叶绿素 a/c捕光复合物相似, 与叶绿素a/b捕光复合物不同[39—41]。
由于拟微绿球藻细胞个体较小、繁殖速度快、易规模化培养, 并富含长链多不饱和脂肪酸、维生素 E和甾醇, 这些成分都是水产动物发育所需的调节物质和生长所必须的营养物质, 所以, 不同品种的拟微绿球藻已被用作海水鱼苗、螃蟹幼苗和对虾幼苗的开口饵料及其幼体所需的动物性饵料轮虫和卤虫的重要饵料[37,42,43]。拟微绿球生长过程中能够吸收水体中的氮和磷, 因此, 它们在育苗过程中除作为幼虫的饵料外, 还起到净化育苗水体的作用。
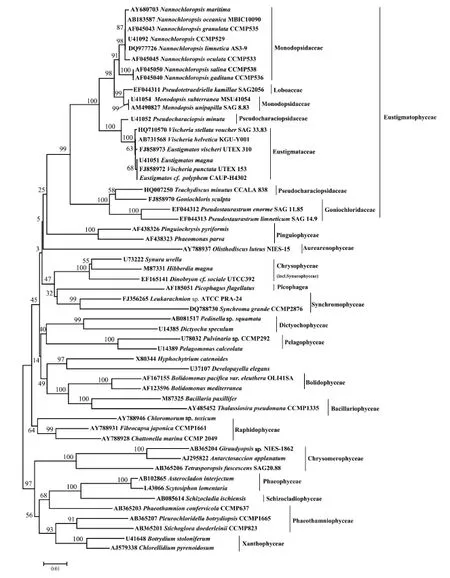
图1 异鞭藻门的系统进化树Fig. 1 Phylogenetic tree of Heterokontophyta
大量的研究发现, 真眼点纲的大多数藻类能够积累大量的储藏性脂类, 特别是三酰甘油, 而三酰甘油是生物柴油生产的重要原料, 通过这些高产油真眼点藻纲藻类的规模化培养, 可以获得大量富含油脂的藻粉用于藻油的提取, 并进一步提炼长链多不饱和脂肪酸, 剩余的脂肪酸转化为生物柴油, 从而为生物柴油的生产提供新的原料[45,46]。
目前还没有具体的研究报道关于真眼点纲藻类的光合作用储藏性碳水化合物的组成成分, 当用碘—碘化钾染色时不出现淀粉所特有的蓝色, 光学显微镜观察到细胞中具有明显的折射颗粒液泡, 细胞超薄切片透射电子显微镜观察细胞中具有片层结构的液泡围绕蛋白核或散布在细胞质中, 具体的光合作用储藏性碳水化合物成分还需进行详细的研究[47]。
[1] Hibberd D J, Leedale G F. Eustigmatophyceae—a new algal class with unique organization of the motile cell [J]. Nature, 1970, 225: 758—760
[2] Hibberd D J, Leedale G F. A new algal class: the eustigmatophyceae [J]. Taxon, 1971, 20(4): 523—526
[3] Hibberd D J. Notes on the taxonomy and nomenclature of the algal classes Eustigmatophyceae and Tribophyceae (synonym Xanthophyceae) [J]. Botanical Journal of the Linnean Society, 1981, 82(2): 93—119
[4] Hibberd D J. Eustigmatophytes [A]. In: Elenor R C (Eds.), Phytoflagellates [C]. Amsterdam: Elsevier. 1980, 319—334
[5] Hibberd D J, Leedale G F. Observation on the cytology and ultrastructure of the new algal class, Eustigmatophyceae [J]. Annual Botany, 1972, 36(1): 49—71
[6] Santos L M A, Melkonian M, Kreimer G. A combined reflection confocal laser scanning, electron and fluorescence microscopy analysis of the eyespot in zoospore of Vischeria spp. (Eustigmatales, Eustigmatophyceae) [J]. Phycologia, 1996, 35(4): 299—307
[7] Santos L M A. The eustigmatophyceae: Actual knowledge and research perspectives [J]. Nova Hedigia, 1990, 112(1): 391—405
[8] Santos L M A, Leedale G F. First report of a Golgi body in a uniflagellate eustigmatophycean zoospore [J]. Phycologia, 1992, 31(1): 119—124
[9] Santos L M A, Leedale G F. Vischeria stellata (Eustigmatophyceae): ultrastructure of the zoospores, with special reference to the flagellar apparatus [J]. Protoplasma, 1991, 164(1—3): 160—167
[10] Neustupa J, Němcová Y. Morphological and taxonomic study of three terrestrial eustigmatophycean species [J]. Nova Hedwigia, 2001, 123: 373—386
[11] Preisig H R, Wilhelm C. Ultrstructure, pigments and taxonomy of Botryochloropsis similis gen. et sp. nov. (Eustigmatophyceae) [J]. Phycologia, 1989, 28(1): 61—69
[12] Ott D W, Oldham-Ott G K. Eustigmatophyceae, Raphidophyceae, and Tribophyceae [A]. In: Wehr J D, Sheath R G (Eds.), Freshwater algae of north America ecology and classification [C]. Academic Press. 2003, 421—427
[13] Lee K W, Bold H C. Pseudocharaciopsis texensis gen.et sp. nov., A new member of the Eustigmatophyceae [J]. British Phycological Journal, 1973, 8(1): 31—37
[14] Hegewald E, Padisak J, Friedl T. Pseudotetraëdriella kamillae: taxonomy and ecology of a new member of the algal class Eustigmatophyceae (Stramenopiles) [J]. Hydrobiologia, 2007, 586(1): 107—116
[15] John D M. Phylum Eustigmatophyta [A]. In: John D M, Whitton B A, Brook A J (Eds.), The freshwater algal flora of the British Isles [C]. Cambridge University Press. 2003, 271—272
[16] Schnepf E, Niemann A, Wilhelm C. Pseudostaurastrum limneticum, a eustigmatophycean alga with astigmatic zoospores: Morphogenesis, fine Structure, pigment composition and taxonomy [J]. Archive Protistenkd, 1996, 146(3): 237—249
[17] Přibyl P, Eliáš M, Cepák V, Lukavský J, Kaštánek P. Zoosporogenesis, morphology, ultrastructure, pigment composition, and phylogenetic position of Trachydiscus minutus (Eustigmatophyceae, Heterokontophyta) [J]. Journal of Phycology, 2012, 48(1): 231—242
[18] Hibberd D J. Observations on the cytology and ultrastructure of Chlorobotrys regularis (West) Bohlin with special reference to its position in the Eustigmatophyceae [J]. British Phycological Journal, 1974, 9(1): 37—46
[19] Andersen R A, Brett R W, Potter D, et al. Phylogeny of the Eustigmatophyceae Based upon 18S rDNA, with emphasis on Nannochloropsis [J]. Protist, 1998, 149(1): 61—74
[20] Suda S, Atsumi M, Miyashita H. Taxonomic characterization of a marine Nannochloropsis species, N. oceania sp. nov. (Eustigmatophyceae) [J]. Phycologia, 2002, 41(3): 273—279
[21] Karlson B, Potter D, Kuylenstierna M, Andersen R A. Ultrastructure, pigment, composition, and 18S rRNA gene sequence for Nannochloropsis granulata sp. nov. (Monodopsidaceae, Eustigmatophyceae), a marine ultraplankter isolated from the Skagerrak, northeast Atlantic Ocean [J]. Phycologia, 1996, 35(3): 253—260
[22] Lubián L M. Nannochloropsis gaditana sp., nov., una nueva Eustigmatophyceae marina [J]. Lazaroa, 1982, 4: 287—293
[23] Fawley, K P, Fawley M W. Observation on the diversity and ecology of freshwater Nannochloropsis (Eustigmatophyceae),with descriptions of new taxa [J]. Protist, 2007, 158(3): 325—336
[24] Krienitz L, Hepperle D, Stich H B, et al. Nannochloropsis limnetica (Eustigmatophyceae), a new species of picoplankton from freshwater [J]. Phycologia, 2000, 39(3): 219—227
[25] Fietz S, Bleiβ W, Hepperle D, et al. First record of Nannochloropsis limnetica (Eustigmatophyceae) in the autotrophic picoplankton from Lake Baikal [J]. Journal of Phycology, 2005, 41(4): 780—790
[26] Kabirov R R, Safiullina L M. Peculiarities of ecology and distribution of unicellular soil alga Eustigmatos magnus (J.B. Petersen) Hibberd (Eustigmatophyta) in Southern Ural (Russia) [J]. International Journal on Algae, 2008, 10(2): 105—116
[27] Whittle S J, Casselton P J. The chloroplast pigments of the algal classes Eustigmatophyceae and Xanthophyceae. I. Eustigmatophyceae [J]. British Phycological Journal, 1975, 10(2): 179—191
[28] Whittle S J. The major chloroplast pigments of Chlorobotrys regularis (West) Bohlin (Eustigmatophyceae) and Ophiocytium majus Naegeli (Xanthophyceae) [J]. British Phycological Journal, 1976, 11(2): 111—114
[29] Lubián L M, Montero O, Moreno-Garrido I, et al. Nannochloropsis (Eusrigmatophyceae) as source of commercially valuable pigments [J]. Journal of Applied Phycology, 2000, 12(3—5): 249—255
[30] Pasquet V, Morisset P, Ihammouine S, et al. Antiproliferative activity of violaxanthin isolated from bioguided fractionation of Dunaliella tertiolecta extracts [J]. Marine Drugs, 2011, 9(5): 819—831
[31] Soontornchaiboon W, Joo S S, Kim S M. Anti-inflammatory effects of violaxanthin isolated from microalga Chlorella ellipsoidea in RAW 264.7 macrophages [J]. Biological Parmaceutical Bulletin, 2012, 35(7): 1137—1144
[32] Volkman J K, Brown M R, Dunstan G A, et al. The biochemical composition of marine microalgae from the class eustigmatophyceae [J]. Journal of Phycology, 1993, 29(1): 69—78
[33] Krienitz L, Wirth M. The high content of polyunsaturated fatty acids in Nannochloropsis limnetica (Eustigmatophyceae) and its implication for food web interactions, freshwater aquaculture and biotechnology [J]. Limnologica, 2006, 36(3): 204—210
[34] Cohen Z. Production potential of eicosapentaenoic acid by Monodus subterraneus [J]. Journal of American Oil Chemical Society, 1994, 71(9): 941—945
[35] Volkman J K, Barrett S M, Blackburn S I. Fatty acids and hydroxy fatty acids in three species of freshwater eustigmatophytes [J]. Journal of Phycology, 1999, 35(5): 1005—1012
[36] Řezanka T, Petránková M, Cepák V, et al. Trachydiscus minutus, a new biotechnological source of eicosapentaenoic acid [J]. Folia Microbiology, 2012, 55(3): 265—269
[37] Briassoulis D, Panagakis P, Chionidis M, et al. An experimental helical-tubular photobioreactor for continuous production of Nannochloropsis sp. [J]. Bioresource Technology, 2010, 101(17): 6768—6777
[38] Gellenbeck K W. Utilization of algal materials for nutraceutical and cosmeceutical applications—what do manufacturers need to know [J]. Journal of Applied Phycology, 2012, 24(3): 309—313
[39] Sukenik A, Livne A, Neori A, et al. Purification and characterization of a light-harvesting chlorophyll-protein complex from the marine eustigmatophyte Nannochloropsis sp. [J]. Plant Cell Physiology, 1992, 33(8): 1041—1048
[40] Arsalane W, Rousseau B, Thomas J C. Isolation and characterization of native pigment-protein complexes from two eustigmatophyceae [J]. Journal of Phycology, 1992, 28(1): 32—36
[41] Sukenik A, Livne A. Chracterization of a gene encoding the light-harvesting violaxanthin-chlorophyll protein of Nannochloropsis sp. (Eustigmatophyceae) [J]. Journal of Phycology, 2000, 36(3): 563—570
[42] Rebolloso-Fuentes M M, Navarro-Pérez A, García-Camacho F, et al. Biomass nutrient profiles of the microalga Nannochloropsis [J]. Journal of Agricultural Food and Chemistry, 2001, 49(6): 2966—2972
[43] Durmaz Y. Vitamin E (α-tocopherol) production by the marine microalgae Nannochloropsis oculata (Eustigmatophyceae) in nitrogen limitation [J]. Aquaculture, 2007, 272(1): 717—722
[44] Ferreira M, Coutinho, P, Seixas P, et al. Enriching rotifer with “premium” microalgae, Nannochloropsis gaditana [J]. Marine Biotechnology, 2009, 11(5): 585—595
[45] Rodolfi L, Zittelli G C, Bassi N, et al. Microalgae for oil: Strain selection, induction of lipid synthesis and outdoor mass cultivation in a low-cost photobioreactor [J]. Biotechnology & Bioengineering, 2009, 102(1): 100—112
[46] Huang W C, Hu H H. Study on the salinity tolerance and oil accumulation of Nannochloropsis [J]. Acta Hydrobiologica Sinica, 2013, 37(2): 383—387 [黄伟超, 胡晗华. 微拟球藻属对盐度的耐受及其产油特性分析. 水生生物学报, 2013, 37(2): 383—387]
[47] Georg G, Maya P S, Blagoy A, et al. Ultrastructure of vegetative cells and autospores of an aerophytic strain of Vischeria stellata (Chodat ex Poulton) Pascher (Eustigmatophyceae) from Bulgaria [J]. Fottea, 2012, 12(2): 273—280
[48] Wang Q X. Flora of Freshwater Algae in China-Xanthophyceae [M]. Beijing: Science Press. 2007, 5—37 [王全喜. 中国淡水藻志-黄藻纲(第 11卷). 北京: 科学出版社. 2007, 5—37]
SYSTEMATICS, BIOLOGICAL CHARACTERISTICS AND POTENTIAL APPLICATION OF EUSTIGMATOPHYCEAE
GAO Bao-Yan, ZHANG Cheng-Wu, WAN Ling-Lin and LI Ai-Fen
(Institute of Hydrobiology & Department of Ecology, Jinan University, Guangzhou 510632, China)
The Eustigmatophyceae was segregated from the Xanthophyceae according to the cytological and ultrastructural properties by Hibberd & Leedale in 1970 and 1971. At present, it includes one order, six families, thirteen genera, and about thirty species. The major photosynthetic pigments of the Eustigmatophyceae are chlorophyll a, violaxanthin, vaucheriaxanthin, β-carotene, and carotene-ester. The cells possess a parietal lobed chloroplast or several discoid chloroplasts. The pyrenoid with a narrow stalk presents only in the vegetative cells. The chloroplast contains three-thylakoid lamellae and no girdle lamellae. The chloroplast is surrounded by a double-membrane envelope and then a layer of endoplasmic reticulum that is not continuity with the nuclear envelope. There is a large spheroidal vacuole with lots of vibrating granular contents and a conspicuous reddish globule in the cytoplasm. In general, eustigmatophytes are reproduced by the formation of autospores. The larger spherical species produce either two D-shaped or four tetrahedral autospores. Eight or sixteen autospores sometimes were observed in the mother cell. Most species can produce lageniform zoospores. The zoospores in most species produce only one emerge flagellum with tubular mastigonemes laterally while others degenerate. In biflagellate species, the second flagellum is short, posteriorly directed and smooth. The relationship between the Eustigmatophyceae and other Heterokontophyta was established by the 18S rDNA and rbcL gene sequence analysis. Fatty acid analysis showed that the Eustigmatophyceae contained eicosapentaenoic acid (EPA). The eustigmatophytes distribute widely in the freshwater bodies, seawater and soil surface. Several species of Nannochloropsis are widely used as aquacultural feeds for rotifer, artemia and larvae of marine fishes, prawns and crabs, and many species are potential producers of EPA and carotenoids. In addition, many species of the Eustigmatophyceae are rich in oil, so they are the potential source for biofuels production.
Eustigmatophyceae; Ultrastructure; Systematics Phylogenic evolution; Biochemical components; Potential application
Q949.25
A
1000-3207(2014)05-0945-12
10.7541/2014.140
2013-07-11;
2014-02-21
国家 863计划(2009AA06440、2013AA065805); 国家 973计划 (2011CB2009001); 国家自然科学基金(31170337、41176105); 广东省教育部产学研结合项目(2010A090200008); 广东省发改委低碳专项资金(2011—051); 珠海市科技重点项目(PC20081008)资助
高保燕(1988—), 女, 汉族; 硕士研究生; 研究方向为微藻分子系统分类学与资源利用。E-mail: gaobaoyan1211@126.com张成武(1963—), 男, 博士, 教授, 博士生导师; 研究方向为微藻生物学与生物技术。E-mail: tzhangcw@jnu.edu.cn
猜你喜欢
杂志排行
水生生物学报的其它文章
- GILL MEDIATES IMMUNE RESPONSES AFTER GRASS CARP REOVIRUS CHALLENGE IN GRASS CARP (CTENOPHARYNGODON IDELLA)
- MORPHOLOGICAL OBSERVATION AND RBCL SEQUENCE ANALYSIS OF A NEW SPECIES FROM CHINA, GRATELOUPIA BOAOENSIS WANG ET LUAN SP. NOV.(HALYMENIACEAE, RHODOPHYTA)
- GILL MEDIATES IMMUNE RESPONSES AFTER GRASS CARP REOVIRUS CHALLENGE IN GRASS CARP (CTENOPHARYNGODON IDELLA)
- 养殖密度对俄罗斯鲟幼鱼的生长、生理和免疫指标的影响
- 一种快速构建集胞藻6803 petBD必需基因定点突变株的方法
- 大通湖环棱螺的次级生产力
