转染RNF6基因对肝癌细胞IRS-2表达的影响
2014-03-17巩健宋健
巩健 宋健
(淄博职业学院制药与生物工程系,淄博 255314)
转染RNF6基因对肝癌细胞IRS-2表达的影响
巩健 宋健
(淄博职业学院制药与生物工程系,淄博 255314)
构建环指蛋白6(RNF6)真核表达载体,并探讨其对胰岛素受体底物1(IRS-2)表达的影响。以人cDNA为模板,PCR扩增RNF6 全长编码基因,并将其克隆至载体pcDNA3.1-CHA中,将重组质粒转染肝癌细胞株HepG2,利用Real time-PCR、Western blot检测细胞内IRS-2 mRNA水平及蛋白表达情况。携带RNF6目的基因的质粒转染HepG2细胞48 h后IRS-2的mRNA表达降低,为对照组的37%,显著低于对照组,差异有统计学意义(P<0.01)。 RNF6引起IRS-2的表达下调,这一过程可能由于泛素化导致胰岛素信号转导通路障碍。
胰岛素受体底物-2 泛素化 环指蛋白6 胰岛素
全世界每年新发肝癌患者约60万,居恶性肿瘤的第5位。肝源性糖尿病是其一种常见的并发症,外周胰岛素抵抗是导致肝源性糖尿病的主要原因[1]。胰岛素与其受体结合后,磷酸化胞内胰岛素受体底物(Insulin receptor substrate,IRS),从而产生一系列生理生化反应[2]。IRS-2作为一种船坞蛋白在胰岛素/类胰岛素生长因子信号通路中发挥非常重要的作用[3,4]。胰岛素受体底物蛋白是胰岛素经典信号通路中的一个关键因子,参与调控胰岛素受体后水平的许多生理过程。泛素化是胞内蛋白质转录后修饰的重要方式,整个细胞质膜系统(从细胞膜、内质网到核膜等)都存在泛素化底物及其降解过程[5]。有研究[6,7]表明,细胞内蛋白质去泛素化与泛素化过程与恶性肿瘤发生有密切关系,认识理解此降解过程与分子机制,对治疗由泛素系统功能紊乱引起的各种疾病具有重要作用。泛素活化酶E1、泛素结合酶E2 和泛素连接酶E3共同介导细胞内泛素化反应,其中连接酶E3能特异识别相关底物,由此决定泛素-蛋白酶体系统(UPS)蛋白降解的特异性,所以连接酶E3引起科研工作者的广泛关注[8]。环指蛋白6(Ring finger protein 6)作为泛素连接酶E3,结合E2从而降解相应靶蛋白[8]。因此,本研
究构建人RNF6全长基因的真核表达载体,转染肝癌细胞HepG2研究RNF6对IRS-2表达的调节作用。
1 材料与方法
1.1 材料
人肝癌细胞株HepG2由中科院上海生命科学研究院提供;pcDNA3.1载体、DNA连接酶、EcoR I和BamH I均购自TaKaRa公司;4XdNTP、TaqDNA聚合酶购自美国Promega公司;Lipofecter脂质体转染试剂购自碧云天;质粒提取、RNA提取及胶回收试剂盒购自德国QIAGEN公司;Marker-DL2000购自上海生工;HRP标记的β-actin内参购自上海康成生物;Anti-IRS-2抗体购自美国Upstate公司;羊抗兔IgG二抗购自美国SouthernBiotech公司。
1.2 方法
1.2.1 真核表达质粒的构建 针对人RNF6的序列设计并合成PCR 引物,在引物序列中分别添加Hind III酶切位点(引物1:5'- ATC AAGCTTatgaatcagtctagatcga- 3')和SalI酶切位点(引物2:5'-ATC GTCGACcccattgtttgctatgttag- 3'),以人cDNA为模板扩增RNF6,PCR反应条件为:98℃预变性1 min,98℃变性10 s,50℃复性15 s,68℃延伸15 s,30个循环。将PCR产物和真核表达载体pcDNA-CHA分别用Hind III、SalI双酶切,酶切产物凝胶回收纯化后用T4DNA连接酶16℃连接过夜,连接液转化感受态大肠杆菌DH5α扩增,涂布LB琼脂平板后37℃培养过夜,挑取单克隆再在LB试管中37℃振荡培养过夜。按试剂盒说明书抽提质粒,用Hind III、SalI双酶切鉴定重组质粒,并送去上海生工进行测序。
1.2.2 细胞培养与分组 在含CO25%、37℃恒温培养箱中,用含10%胎牛血清的DMEM培养人肝癌细胞株HepG2,每隔1-2 d传代一次。按转染试剂盒说明书进行转染。试验细胞分为3组:即空白对照组(不做任何处理的HepG2)、转染空载质粒组、转染组。
1.2.3 Real-time PCR 检测 收集转染后48 h的细胞及未转染细胞,用Trizol提取细胞总RNA,使用MMLV逆转录酶逆转录为cDNA 以各组cDNA为模板,加入缓冲液引物等进行PCR,各样本重复3次。反应条件:95℃ 30 s预变性,94℃ 30 s,60℃退火30 s,72℃ 1 min,40个循环,72℃ 7 min。PCR结束后加入上样缓冲液后对产物进行1.5%的琼脂糖电泳,凝胶成像系统观察结果。反应结束后根据定量PCR的扩增曲线和溶解曲线分析相关基因的表达情况。
1.2.4 Western blot检测 IRS-2蛋白表达 转染后48 h收集细胞及未转染细胞,用蛋白裂解液处理细胞提取蛋白样品,蛋白样品经10%的SDS-PAGE分离后,恒流200 mA转移至PVDF膜上,用5%脱脂奶粉封闭,TBST洗膜,之后加入相应的一抗、二抗进行孵育并洗膜,ECL试剂发光检测目标蛋白的表达情况。
1.2.5 统计分析 相关数据处理运用SPSS17.0,以均数±标准差(x-±s)表示计量资料,组间比较采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 目的片段的获取
经PCR扩增后,用1.5%琼脂糖凝胶电泳进行产物鉴定,在约2 000 bp处有目的条带,目的片段大小与预期扩增的基因片段大小一致,见图1。

图1 目的基因RNF6的PCR扩增
2.2 阳性克隆的鉴定
将重组质粒转化E coli.DH5α,筛选阳性克隆后,抽提质粒进行Hind III和SalI双酶切鉴定和RT-PCR检测RNF6基因表达情况。图2显示重组质粒双酶切后产生目的条带和pcDNA-CHA载体部分条带,证明人RNF6的cDNA序列已插入表达载体pcDNACHA中。RT-PCR检测(图3)显示,与未转染组及空载体组比较,阳性克隆稳定高表达RNF6 mRNA。

图2 重组pcDNA-CHA-RNF6载体的双酶切鉴定

图3 转染RNF6 后HepG2细胞IRS-2 mRNA表达的变化
2.3 Real time PCR、Western blot检测 IRS-2的表达情况
试验结果如图4所示,携带RNF6的重组质粒转染48 h后HepG2细胞中IRS-2的mRNA表达明显下降(P<0.01),为对照组的37%。蛋白表达情况如图5所示,在RNF6转染细胞中,IRS-2蛋白表达显著减少(P<0.01),空白对照与空载质粒IRS-2表达不变。
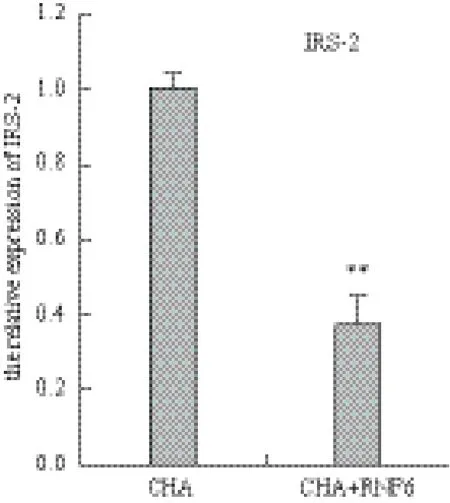
图4 转染RNF6 后HepG2细胞IRS-2 mRNA表达的变化

图5 Western blot检测IRS-2表达
3 讨论
RNF6 是泛素-蛋白酶体系统中的一种E3连接酶,基因序列全长2 058 bp,能编码685个氨基酸,包括C-端的RING-H2指结构和N端的螺旋结构域。研究表明[9],RNF6通过C-端的RING-H2指结构诱发肾上腺受体(AR)的非水解泛素化而稳定AR,进而招募ARA54上调AR介导的基因转录活性。在糖尿病、胰岛素抵抗时,肝脏、胰腺、肌肉和脂肪组织均出现异常的信号转导[10]。有研究表明[11-13],胞内蛋白降解除溶酶体途径外,还有细胞凋亡过程中的caspases 途径,以及降解大部分短周期寿命蛋白的泛素-蛋白酶体系统;选择性降解某种蛋白能够调节细胞增殖与分化、基因转录、细胞周期调控、抗原呈递及信号转导等各种生命过程;胰岛素信号相关蛋白的异常降解在糖尿病发病机理中发挥至关重要的作用。
本试验从cDNA 文库中扩增出人RNF6基因的全长序列,并将其构建到pcDNA3.1-CHA 真核表达载体中,重组质粒转染到HepG2细胞中,实时定量PCR检测到IRS-2基因的mRNA水平明显降低。有研究表明,机体内胰岛素高浓度或长期高水平表达,可通过胰岛素生长因子-1受体活化丝氨酸激酶,磷酸化Ser/Thr,进而抑制酪氨酸激酶活性磷酸化Tyr[14]。Pederson等[15]研究证实,Ser/Thr磷酸化后的IRS-1,空间构象改变易与泛素共价结合,进而被蛋白酶体降解。本研究结果显示,泛素连接酶RNF6
下调靶蛋白IRS-2表达水平,但是否确实由于泛素化作用引起IRS-2基因表达下调,有待进一步验证。由于泛素化下调的IRS-2可能导致胰岛素信号通路障碍,是导致Ⅱ型糖尿病发生的分子机制,泛素化相关信号蛋白将是研究糖尿病治疗药物的新靶点。
4 结论
本研究以人cDNA为模板,成功构建RNF6基因全长编码序列真核表达载体,重组质粒pcDNA3.1-CHA-RNF6转染HepG2肝癌细胞株48 h后,使HepG2细胞IRS-2表达显著下调,这一过程可能会由于RNF-6的泛素化作用导致胰岛素信号通路障碍。
[1] Yen SL, Chiu TY, Lin YC, et al. Obesity and hepatitis B infection are associated with increased risk of metabolic syndrome in university freshmen[J]. Int J Obes(Lond), 2008, 32(3):474.
[2] Pagliassotti MJ, Kang J, Thresher JS, et al. Elevated basal PI 3-kinase activity and reduced insulin signalling in sucrose-induced hepatic insulin resistance[J]. Am J Physiol Endocrinol Metab, 2002, 282(1):170-176.
[3] Myer MG Jr, Sun XJ, White MF. The IRS-1 signaling system[J]. Trends Biochem Sci, 1994, 19(7):289-293.
[4] Wiedmann M, Tamaki S, Silberman R, et al. Constitutive overexpression of the insulin receptor substrate-1 causes functional upregulation of Fas receptor[J]. J Hepatol, 2003, 38(6):803-810.
[5] Kim SJ, DeStefano MA, Oh WJ, et al. mTOR complex 2 regulates proper turnover of insulin receptor substrate-1 via the ubiquitin ligase subunit Fbw8[J]. Molecular Cell, 2012, 48:875-887.
[6] Banker GA, Cowan WM. Rat hippocampal neurons in dispersed cell culture[J]. Brain Res, 1977, 126:397-425.
[7] Banker GA, Cowan WM. Further observations on hippocampal neurons in dispersed cell culture[J]. J Comp Neurol, 1979, 187:469-493.
[8] Zhu L, Tong G, Chen J, et al. Cloning and identification of a novel RNF6 transcriptional splice variant Spg2 in human development[J]. Science in China(Life Sciences), 2008, 51(4):302-307.
[9] Xu K, Shimelis H, Linn DE, et al. Regulation of androgen receptor transcriptional activity and specificity by RNF6-induced ubiquitination[J]. Cancer Cell, 15(4):270-282.
[10] Rome S, Meugnier E, Vidal H. The ubiquitin-proteasome pathway is a new partner for the control of insulin signaling[J]. Curr Opin Clin Nutr Metab Care, 2004, 7(3):249- 254.
[11] Glickman MH, Ciechanover A. The ubiquitin-proteasome proteolytic pathway:destruction for the sake of construction[J]. Physiol Rev, 2002, 82(2):373- 428.
[12] Kornitzer D, Ciechanover A. Modes of regulation of ubiquitin mediated protein degradation[J]. J Cell Physiol, 2000, 182(1):1-11.
[13] Groll M, Huber R. Substrate access and processing by the 20S proteasome core particle[J]. Int J Biochem Cell Biol, 2003, 35(5):606- 616.
[14] Rhodes CJ. Type 2 diabetes a matter of beta cell life and death[J]. Science, 2005, 307(5):380-384.
[15] Pederson TM, Kramer DL, Rondinone CM. Serine/threonine phosphorylation of IRS-1triggers its degradation:possible regulation by tyrosine phosphorylation[J]. Diabetes, 2001, 50(1):24-31.
(责任编辑 李楠)
Effect of Gene Ring Finger Protein 6 on the Expression of Insulin Receptor Substrate-2 in Hepatoma Cells
Gong Jian Song Jian
(Department of Pharmaceutical and Biological Engineering,Zibo Vocational Institute,Zibo 255314)
It was to construct an eukaryotic expression vector of ring finger protein 6(RNF6)gene and investigate the effect of RNF6 on the expression of insulin receptor substrate-2(IRS-2). The coding sequence of hRNF6 gene was amplified by PCR with human cDNA as template. The pcDNA3.1-CHA-RNF6 was constructed and transfected into hepatocarcinoma cells(HepG2)by routine mole cular biology technology. The total RNA was extracted from HepG2 cells 72 hours post-transfection, the expression levels of IRS-2 was detected by real-time quantitative PCR. Western blotting was applied to detect the protein levels of IRS-2. Result showed that the mRNA level of IRS-2 gene in transfected HepG2 was 37% of the control. The expression level of IRS-2 was lower than the control group significantly(P<0.01). The expression of IRS-2 was down-regulated in HepG2 significantly, and the disorder in insulin signal transduction pathway, which may result from enhanced ubiquitylation level of IRS-2.
Insulin receptor substrate-2 Ubiquitin RNF6 Insulin
2013-12-25
巩健,女,副教授,研究方向:生物技术应用;E-mail:ghfh2008@126.com
