黑曲霉(AS0006)产纤维素酶的纯化研究
2014-03-17张欢曹焱鑫蒋林王晓明刘齐董晓莹寇巍
张欢曹焱鑫蒋林王晓明刘齐董晓莹寇巍
(1.辽宁省能源研究所,营口 115003;2.营口市疾病预防控制中心,营口 115003)
黑曲霉(AS0006)产纤维素酶的纯化研究
张欢1曹焱鑫1蒋林2王晓明1刘齐1董晓莹1寇巍1
(1.辽宁省能源研究所,营口 115003;2.营口市疾病预防控制中心,营口 115003)
利用实验室中黑曲霉菌株AS0006进行粗酶发酵,对产出的纤维素酶液进行不同饱和度(NH4)2SO4的分级沉淀,经过Sephadex G-25、Sephadex G-100分离纯化后,得到两种内切酶(EG)组分、一种外切酶(CBH)组分。通过酶活性及电泳检测发现,两种EG酶组分的相对分子质量分别为29.63 kD、37.49 kD,CBH酶组分相对分子质量为56.51 kD。相较原始粗酶液,EG回收率可达18.07%、纯化倍数为3.46,CBH回收率可达12.96%、纯化倍数为4.14,β-葡萄糖苷酶(CB)回收率可达22.37%、纯化倍数为3.58。
黑曲霉 纤维素酶 分离纯化
黑曲霉作为一种重要的产纤维素酶菌种,广泛应用于发酵工业。相对于常用的绿色木霉和里氏木霉等菌株,黑曲霉具有安全无毒素,胞外分泌纤维素酶便于提纯,β-葡萄糖苷酶糖化能力较强等优点,成为产酶菌种的重要研究对象[1-3]。目前,国内外学者对于黑曲霉的研究多集中在培育条件的优化、分离提纯、固定化以及基因遗传操作等方面,但在产出酶的相互作用关系和酶解机制方面研究进展缓慢,成为制约纤维素酶菌种应用的瓶颈[4-6]。纤维素酶是一组起协同作用的复合酶系,菌种来源不同,所产生的纤维素酶系组分亦不相同,而即使同一来源的纤维素酶组分也会随菌株生长培养条件的不同而有所差异,对单一的酶组分的纯化研究可实现对其性质及其它酶组分之间相互作用关系的了解,分析纤维素酶的酶解机制,从而为获得针对秸秆等不同纤维原料复合酶制剂提供理论依据,因此在纤维素酶的分离纯化技术和研究方法上取得突破至关重要[7-9]。针对上述问题,本试验选用课题组自行筛选出的一株产纤维素酶的黑曲霉菌株AS0006,并对其所产酶系进行分离纯化。纯化过程采用不同饱和度(NH4)2SO4分级沉淀、Sephadex G-25除盐、Sephadex G-100分离提纯、SDS-PAGE电泳检测。并详细计算了各酶组分比活力、纯化倍数及回收率等重要参数。
1 材料与方法
1.1 材料
1.1.1 菌种 黑曲霉菌株AS0006筛选自黑龙江省伊春金山屯林区土壤,因筛选出的6株产纤维素酶菌株中,其各协同酶组分活力及滤纸酶活力均达到最大(内切葡聚糖酶活力为60.88 U/mL,外切葡聚糖酶活力为14.94 U/mL,β-葡萄糖苷酶活力为65.08 U/mL,滤纸酶活力为76.72 U/mL),故选用黑曲霉AS0006所产的纤维素酶作为分离纯化的研究对象。
1.1.2 培养基 利用Design-Expert正交设计软件得到黑曲霉AS0006优化培养基为稻草粉9.47 g/L,麸皮49.33 g/L,(NH4)2SO42.0 g/L,MgSO4·7H2O 0.5 g/L,KH2PO40.5 g/L,蒸馏水3 L,pH6.0。121℃灭菌20 min。
1.1.3 试验仪器 CXG-A电脑恒温层析柜(上海精科公司);HL-2恒流泵,HD-2000紫外检测仪,BSZ-100自动部分收集器,HD-A电脑层析采集仪(上海嘉鹏公司);DZF-6020浓缩真空干燥箱(上海博迅公司);DYY-10C电泳系统(北京六一仪器厂)。
1.2 方法
1.2.1 纤维素酶活力的测定 纤维素各协同酶组分活力测定参照Horikoshi方法[10],酶活力单位定义参照行业标准QB2583-2003。蛋白质含量测定按考马斯亮蓝(Bradford)染色法[11],以A595牛血清白蛋白为标准。
1.2.2 (NH4)2SO4盐析分级沉淀 将经离心抽滤后得到的酶清液依次用30%、60%、70%、90%饱和度的(NH4)2SO4进行分级沉淀,8 000 r/min、4℃离心20 min,收集蛋白沉淀,分别溶于量柠檬酸-磷酸(pH 5.0)缓冲液中,4℃保存备用。
1.2.3 Sephadex G-25凝胶过滤除盐 本试验采用Sephadex G-25凝胶过滤技术对(NH4)2SO4分级沉淀后所得的各蛋白酶液除盐,5 mL蛋白上样量至1.0 cm×20 cm层析柱中,以pH 5.0的柠檬酸-磷酸缓冲液平衡并洗脱,洗脱速度1 mL/min,收集对应各峰的蛋白酶液进行酶活性及蛋白含量的测定。
1.2.4 酶液的浓缩 将酶液至于30℃条件下,0.08 MPa恒压真空干燥。干燥后的酶蛋白用柠檬酸-磷酸(pH5.0)缓冲液定溶至5 mL,4℃保存备用。
1.2.5 Sephadex G-100分子筛凝胶过滤层析 将去盐浓缩后的5 mL蛋白清液上样于经柠檬酸-磷酸(pH5.0)平衡好的Sephadex G-100凝胶层析柱(1.6 cm×80 cm),以平衡缓冲液洗脱,洗脱速度0.5 mL/min,收集所有出峰酶液,对其进行酶活性及蛋白含量的测定。
1.2.6 SDS-PAGE蛋白电泳 采用SDS-PAGE不连续垂直凝胶电泳,电极液采用Tris-甘氨酸缓冲体系,分离胶缓冲液pH8.8,浓度为10%,浓缩胶缓冲液pH6.8,浓度为5%,70 V恒压电泳2.5 h[12]。
2 结果
2.1 Sephadex G-25凝胶过滤脱盐效果分析
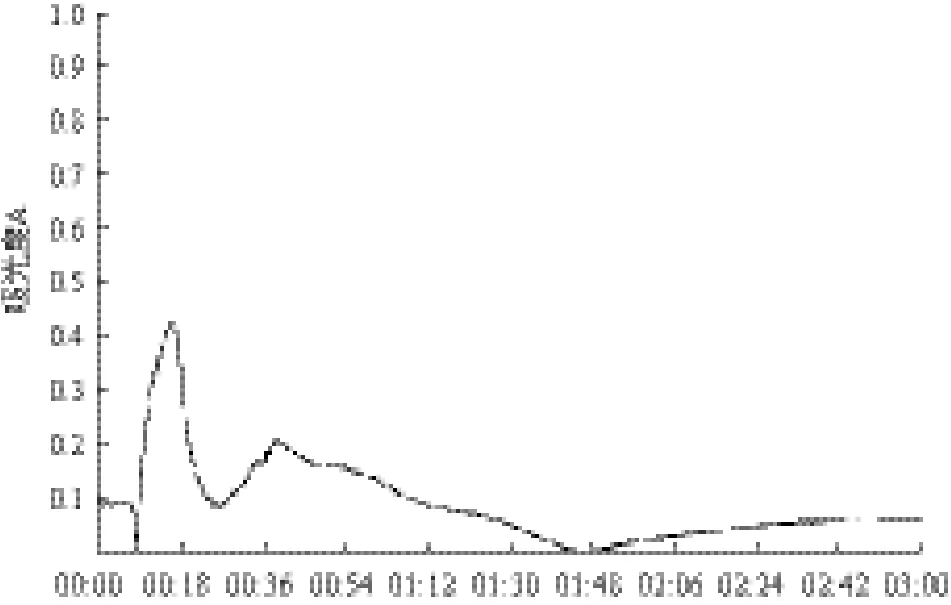
图1 60%(NH4)2SO4沉淀蛋白脱盐层析图

图2 70%(NH4)2SO4沉淀蛋白脱盐层析图
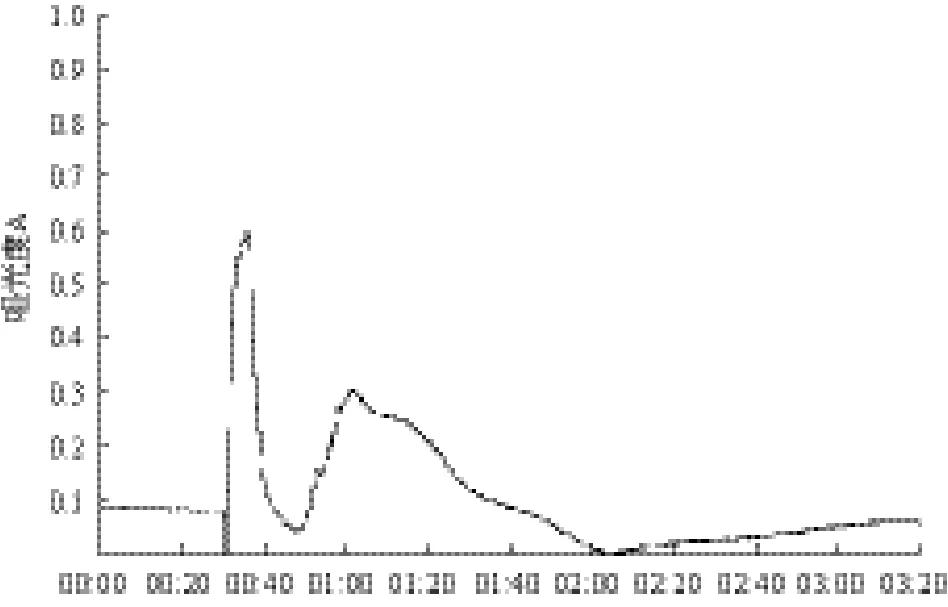
图3 90%(NH4)2SO4沉淀蛋白脱盐层析图
图1 -图3分别为3种不同饱和度(60%、70%、90%)(NH4)2SO4沉淀出的蛋白经过Sephadex G-25凝胶过滤后的层析谱图,其中30%饱和度析出的为杂蛋白,故忽略不计。经分析得知各图中对应的第1个峰均为蛋白活性峰,第2个是无机盐和小分子蛋白峰。这是因为在分子筛层析脱盐的过程中蛋白质相对分子量和盐的相对分子量差异巨大,蛋白酶液中小分子盐会随着溶剂进入凝胶颗粒的网孔中,使其保留时间变长、迁移速率变慢。而相对分子量较大的蛋白质却不能随着溶剂进入到凝胶网孔中,因此可以先于小分子盐从层析柱中流出,从而实现除盐效果。经过研究分析后,将各图中对应第一个峰中的蛋白清液分别收集起来,进行酶活力及蛋白含量测定试验。
2.2 脱盐酶液酶活性检测分析
图4中每组柱形图分别表示经过不同饱和度(60%、70%、 90%)(NH4)2SO4分级沉淀除盐后,蛋白酶液中各协同酶组分活力参数的比较。在每组饱和度情形下,柱形图从左至右的顺序依次为内切葡聚糖酶(EG)、外切葡聚糖酶(CBH)和β-葡萄糖苷酶(CB)活力。

图4 不同饱和度(NH4)2SO4沉淀脱盐后酶活力测定
由图4可知,经过60%饱和度(NH4)2SO4沉淀脱盐后的蛋白酶液中CBH和CB酶活力很低,几乎没有;EG酶活力低于70%、90%饱和度(NH4)2SO4脱盐酶液中的酶活性。经90%饱和度(NH4)2SO4沉淀脱盐酶液中,虽然含有的CB要高于70%饱和度的脱盐酶液,但其不存在CBH,且EG活力要低于70%饱和度的脱盐酶液,所以综合考虑到各单一酶活力及协同效应。本试验选取经70%饱和度(NH4)2SO4沉淀后的脱盐蛋白酶液作为进一步分离纯化的研究对象。测试分析后,经70%饱和度(NH4)2SO4沉淀除盐后的蛋白酶液中EG酶活力可达180.21 U/mL,CBH酶活力可达41.53 U/mL,CB酶活力为217.35 U/mL,蛋白质含量为596.75 μg/mL。
2.3 Sephadex G-100层析
将脱盐浓缩后的5 mL蛋白酶液用Sephadex G-100葡聚糖凝胶分离提纯,层析结果如图5所示。
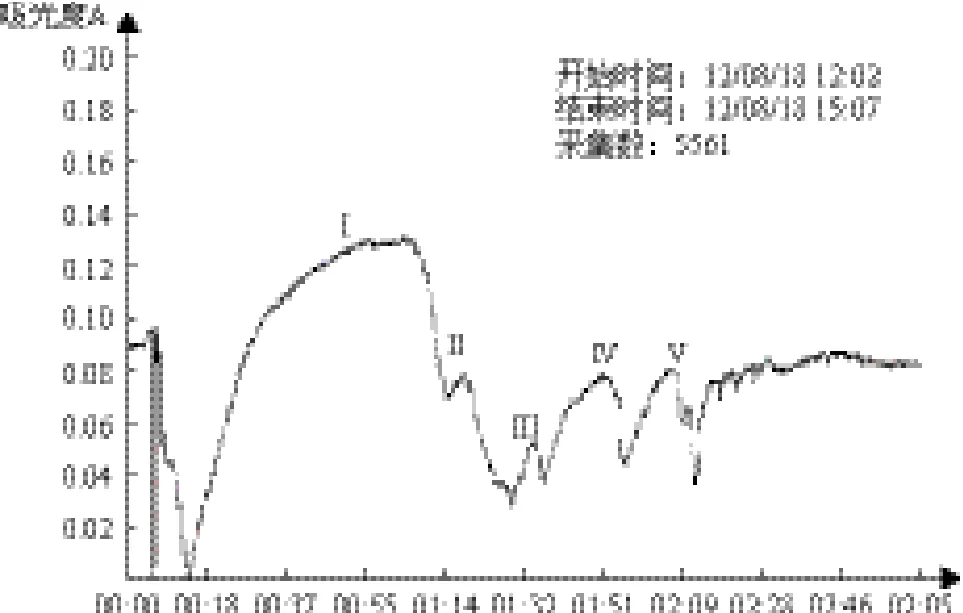
图5 Sephadex G-100纯化蛋白层析图
从图5凝胶层析谱图中可以看出,脱盐酶液经过Sephadex G-100进一步分离纯化后,出现了5个主要的蛋白活性峰。通过对各协同酶组分活力参数的分析发现EG酶主要集中在主峰Ⅴ中,CBH主要集中在Ⅲ峰中,而CB酶则主要集中在Ⅰ峰内。
2.4 纯化回收率的计算
对比分析各分离纯化步骤中单一酶组分的比活力、回收率及纯化倍数,其结果见表1-表3所示。
分析表中数据可知,Sephadex G-25脱盐虽会造成部分蛋白酶的损失,但却存在一定分离提纯的效果。经Sephadex G-25脱盐后各协同酶组分纯化倍数分别为1.59、3.12、1.36。经Sephadex G-100分离纯化后各组分酶比活力得到显著提高,其数值分别为1 031.43 U/mg、274.73 U/mg、1 280.18 U/mg,纯化倍数分别为3.46、4.14、3.58。
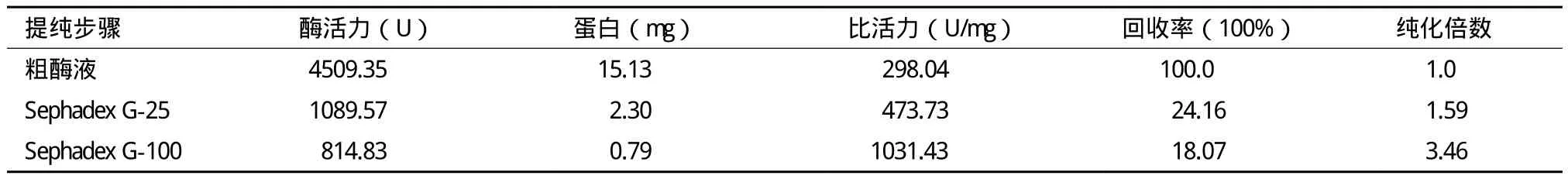
表1 EG酶的纯化效果

表2 CBH酶的纯化效果

表3 CB酶的纯化效果
2.5 SDS-PAGE蛋白电泳检测
经上述研究发现,分离纯化后3种协同酶组分主要集中在3个不同的主峰中,分别收集3个峰对应的蛋白酶液,通过SDS-PAGE电泳检测(图6),计算出现的单一条带酶组分的相对分子质量。

图6 Sephadex G-100纯化后各酶组分的电泳检测结果
从图6泳道1中可以看出有两条单一的蛋白电泳条带存在,说明分离纯化出两种EG酶组分,分析原因可能是因为在Sephadex G-100层析图谱主峰Ⅴ旁出现一个较小的肩峰,但因相对分子质量太过接近,出峰时间太快,未能使得EG酶组分得到较好的分离,根据标记蛋白分子量及其相对迁移率,计算出两种EG酶组分相对分子量分别为29.63 kD、 37.49 kD。CBH酶在泳道2中呈现出一条单一蛋白电泳条带,表明已达到电泳纯程度,计算其相对分子量为56.51 kD。CB酶在泳道3中基本为单条带,但稍有拖带现象出现,说明样品的纯度不够,使得杂质蛋白成为CB酶蛋白的干扰项,这与在Sephadex G-100层析图谱中看出的,且在CB酶纯化的过程中形成一个相对较宽的谱峰(Ⅰ)结论相吻合,虽然未能达到电泳纯程度,但可知其相对分子量范围在115.74 -168.33 kD之间。可见,通过上述纯化步骤,已基本实现了不同种类纤维素酶的纯化工作。
3 讨论
综合考虑除盐后各单一酶组分活性及协同效应,本试验选取经70%饱和度(NH4)2SO4沉淀后的除盐酶液进行后续分离纯化的工作,经Sephadex G-100分子筛凝胶过滤后发现,与粗酶液相比,其EG酶的比活力由298.04 U/mg提高到1 031.43 U/mg,回收率达到18.07%、纯化倍数达到3.46,CBH酶的比活力由66.37 U/mg升高到274.73 U/mg,回收率为12.96%、纯化倍数为4.14,而CB酶的比活力由原来的357.67 U/mg提高到1 280.18 U/mg,回收率可达22.37%、纯化倍数达到3.58。单一酶组分的回收率均较低下,其原因可能是由于纯化过程操作步骤较繁琐,导致纤维素酶部分失活所致[13,15]。通过SDS-PAGE电泳检测分析可知,纯化出的两种EG酶
组分相对分子质量分别为29.63 kD、37.49 kD,CBH酶相对分子量为56.51 kD,至于CB酶蛋白因为一些干扰项的存在,没有达到电泳纯程度,可确定其相对分子量范围在115.74 -168.33 kD之间[16,17]。
4 结论
本试验选用黑曲霉菌株AS0006产生的纤维素酶系进行纯化特性分析,为纤维素酶在酶解机理方面的研究奠定了理论基础,使其对纤维素复合酶制剂的开发具有一定指导意义,以达到能够获得高活性纤维素复合酶制剂的目的。
[1] 闫会平, 陈士华, 吴兴泉.黑曲霉 β-葡萄糖苷酶的研究进展[J].纤维素科学与技术, 2007, 15(1):59-63.
[2] 蔡凤. 黑曲霉产纤维素酶的分离纯化及性质研究[D].南京:南京理工大学, 2006.
[3] 梁翠谊, 许敬亮, 袁振宏, 等. β-葡萄糖苷酶高产菌株及其应用研究[J].中山大学学报:自然科学版, 2013(1):118-122.
[4] 郭艳梅, 郑平, 孙际宾.黑曲霉作为细胞工厂:知识准备与技术基础[J].生物工程学报, 2010, 26(10):1410-1418.
[5] 张莹莹, 张会, 李杰.构建β-甘露聚糖酶的黑曲霉工程菌[J].生物技术, 2013, 23(3):31-36.
[6] 刘玲玲, 朱松, 朱婷, 等.重组β-葡萄糖苷酶生产龙胆低聚糖的工艺条件优化[J].微生物学报, 2009, 49(5):597-602.
[7] 刘家英, 唐芳, 张林波, 等.担子菌纤维素酶的分离与纯化[J].吉林农业, 2010, 5:30-31
[8] Hanhui M, Janel RM, Lucy FC, et al. A highly efficient multifunctional tandem affinity purification approach applicable to diverse organisms[J]. Mol Cell Proteomics, 2012, 11:501-511.
[9] Rabinovich ML, Melink MS, Bolobova AV. Cellulases from microorganisms[J]. Prikl Biokhim Microbiol, 2002, 38(4):355-373.
[10] Mesut T, Gani ET, Umit I. Citric acid production from Aspergillus nigerMT-4 using hydrolysate extract of the insectLocusta migratoria[J]. Toxicology and Industrial Health, 2013, 29:426-434.
[11] Kimran H, Malcolm S, David BA. Structural features of sugars that trigger or support conidial germination in the filamentous fungusAspergillus niger[J]. Appl Envir Microbiol, 2013, 79:6924-6931.
[12] Lintao B, Mark RN, Michael RS, et al. Product binding varies dramatically between processive and nonprocessive cellulase enzymes[J]. J Biol Chem, 2012, 287:24807 - 24813
[13] 王希国. 梅林青霉对纤维素降解特性及机制的研究[D].哈尔滨:哈尔滨工业大学, 2007.
[14] 孙宪昀. 斜卧青霉木质纤维素酶系的合成调控研究[D].济南:山东大学, 2007.
[15] Mun KC, Krupakar P, Hui YY, et al. Optimized sequential purification protocol forin vivosite-specific biotinylated full-length dengue virus capsid protein[J]. Protein Eng Des Sel, 2013, 26:377-387.
[16] 燕红. 两株芽胞杆菌纤维素酶诱导产生机制及其作用的研究[D].哈尔滨:哈尔滨工业大学, 2007.
[17] Miguel R, Najla V, Dongli G, et al. Engineering split intein DnaE fromNostocpunctiforme for rapid protein purification[J]. Protein Eng Des Sel, 2013, 26:215-223.
(责任编辑 李楠)
Study on Purification of Cellulase from Aspergillus niger AS0006
Zhang Huan1Cao Yanxin1Jiang Lin2Wang Xiaoming1Liu Qi1Dong Xiaoying1Kou Wei1
(1. Liaoning Institute of Energy Resources,Yingkou 115003;2. Yingkou Center for Disease Control and Prevention,Yingkou 115003)
Two endoglucanases(EG)components and a cellobiohydrolase(CBH)from Aspergillus niger AS0006 were separated and purified by(NH4)2SO4fractional precipitation, Sephadex G-25 and Sephadex G-100 chromatography. According to cellulase activity and electrophoresis detection found that the molecular weight of two EG components were 29.63 kD and 37.49 kD, respectively, the molecular weight of CBH component was 56.51 kD. Compared to the crude enzyme, the recovery rate of EG components could reach 18.07%, the purification fold was 3.46, the recovery rate of CBH component could reach 12.96%, the purification fold was 4.14, the recovery rate of β-glucosidase(CB)could reach 22.37% and the purification fold was 3.58.
Aspergillus niger Cellulase Purification
2013-11-03
国家“863”课题(2013AA050701)
张欢,女,助理研究员,研究方向:木质纤维素燃料乙醇技术;E-mail:zhanghuan032987@163.com
寇巍,E-mail:kouwei6@126.com
