滑桃树种子化学组分对其内生菌影响的研究
2014-03-17吴欣
吴欣
(国家海洋局第三海洋研究所,厦门 361005)
滑桃树种子化学组分对其内生菌影响的研究
吴欣
(国家海洋局第三海洋研究所,厦门 361005)
Streptomyces sp. WXC菌株是从滑桃树(Trewia nudiflora L.)种子中分离到的一株内生菌。提取植物种子的化学成分,对其进行溶剂分组,检测各组分对内生放线菌S. sp. WXC的生长、代谢和活性化合物的影响,结果表明,滑桃树种子水溶性提取物Water ext.对S. sp. WXC的生长、次生代谢产物和活性化合物都有明显的促进作用。
滑桃树种子化学组分 Streptomyces sp. WXC菌株 活性化合物 化学防御
在生物间的各种相互作用中,生物的化学防御(共生化学防御)是特别有趣的,因为它既是保持生物物种分布平衡的基本因素,也是促进生物协同进化的重要因素。共生通过水平基因转移来影响基因库,并且对次生代谢的进化施加影响;更重要的是,共生微生物产生次生代谢产物可能是共生微生物影响其宿主的一种重要适应机制[1]。过去研究较多的是植物和土壤微生物的化学防御,例如,植物与固氮菌Frankia的相互关系[2],而植物与其内生放线菌的化学防御[3],尤其是与链霉菌的化学防御研究得较少[4,5]。滑桃树(Trewia nudifloraL.)是大戟科滑桃树属植物,热带大乔木,该植物的主要化学成分为具有抗肿瘤活性的美登木素类化合物[6-8]。Streptomycessp. WXC(S. sp. WXC)菌株是从滑桃树种子中分离到的一株内生链霉菌。前期试验发现,
S. sp. WXC菌株在常见的培养基上生长缓慢,菌株生物量低,当培养基中加入滑桃树种子提取物后,菌株生长良好,生物量明显增加,菌株发酵产物的抗菌活性也随之提高。因此,我们推测很可能是植物种子中的化学成分诱导S.sp. WXC菌株提高了生物量和活性化合物的产量。本研究提取植物种子的化学成分,对其进行溶剂分组,检测各组分对内生放线菌S. sp. WXC的生长、代谢和活性化合物的影响,旨在探究滑桃树种子化学成分对其内生菌S.sp. WXC菌株的影响。
1 材料与方法
1.1 材料
滑桃树(T. nudifloraL.)种子由云南西双版纳植物园提供。
分析纯级石油醚、甲醇、乙酸乙酯、正丁醇,色谱级甲醇,无水Na2SO4均购于英杰生命科技有限公司。
1.2 方法
1.2.1 滑桃树内生菌S. sp. WXC菌株的分离和保藏S. sp. WXC菌株是由滑桃树无菌苗中分离到的一株内生菌。用含有赤霉素(1 mg/mL)的琼脂培养基诱导滑桃树无菌苗,当其生长到5-6 cm时,将其切成5 mm的片段,置于高氏一号培养基上,28℃培养分离得到WXC菌株。该菌株的形态特征和GenBank序列比对结果表明,该菌株属于链霉菌属(Streptomycessp.)。菌株置于10%甘油中,密封于安培管中,-70℃保藏。
1.2.2 滑桃树种子化学组分的提取 将滑桃树种子去壳,称重得100 g,研磨成细小的碎块,用石油醚浸泡,在50℃水浴中加热大约2 h,待冷却后过滤,共提取3次,获得石油醚提取液,减压回收溶剂,获得石油醚提取物1(PE ext.1)。将石油醚加热回流提取过滤后获得的种子残渣用乙酸乙酯加热回流提取并过滤,方法同前,提取3次,获得乙酸乙酯提取液,减压回收溶剂,得到乙酸乙酯提取物。用石油醚∶甲醇=1∶1对乙酸乙酯提取物进行萃取,获得甲醇提取物1(MeOH ext.1)和石油醚提取物2(PE ext.2),将PE ext.1和PE ext.2合并得到石油醚提取物(PE ext.)。将经过石油醚和乙酸乙酯加热回流提取后的种子残渣用80%的甲醇进行加热回流提取,重复3次,获得稀甲醇提取液,减压回收溶剂,得到甲醛提取物2(MeOH ext.2)。将MeOH ext.1和MeOH ext.2合并,减压回收溶剂,并用乙酸乙酯∶水=1∶1萃取3次,得到乙酸乙酯萃取液和水相。在乙酸乙酯萃取液中加入过饱和的无水Na2SO4,静置、过滤后,减压回收溶剂,得到乙酸乙酯提取物(EA ext.)。水相部分用等体积正丁醇萃取3次,获得正丁醇萃取液和水相,分别减压回收溶剂,得到正丁醇提取物(Bu ext.)和水溶液提取物(Water ext.)。将PE ext.、EA ext.、Bu ext.和Water ext.定容至250 mL溶液中,每组分浓度相当于400 mg/mL滑桃树种子的浓度。
1.2.3 滑桃树种子化学组分对S.sp. WXC菌株生长状态的影响 蘸取S.sp. WXC菌株的孢子于10 mL无菌水中,制成菌悬液,将菌悬液涂布于高氏一号培养基上,用微量注射器分别吸取25 μL的化学组分(EA ext.,Bu ext.,Water ext.)于纸片上,待纸片吹干后,平铺于培养基上,并用空白的纸片作对照(blank control),将平板置于28℃培养10 d,观察菌株生长状态。
1.2.4 滑桃树种子化学组分对S. sp. WXC菌株生物量的影响 在100 mL高氏一号培养基中分别加入250 μL滑桃树种子化学组分(EA ext.,Bu ext.,Water ext.),将S.sp. WXC菌株接种在添加了滑桃树种子化学组分的高氏一号培养基和未添加任何化学组分的高氏一号培养基中分别进行培养,在28℃,180 r/min的条件下,分别培养3、4、5和6 d。根据不同培养时间收菌,4℃,6 000 r/min,15-20 min,菌体经过冷冻抽干后,称菌体干重。以上每个样品分别作3个重复。
1.2.5 不同浓度的滑桃树种子化学组分与S. sp. WXC菌液浓度的关系 将不同浓度的滑桃树种子化学组分加入高氏一号培养基中(终浓度分别为0、1、5、25、125、250、500和1 000 μg/mL),将S.sp. WXC菌株接种到培养基中,于28℃,180 r/min,培养48 h。通过检测菌体的OD600值判断滑桃树种子化学组分的浓度与菌液浓度的关系。以上每个样品分别作3个重复。
1.2.6 滑桃树种子化学组分对S.sp. WXC菌株次生代谢产物的影响 在100 mL高氏一号培养基中分别加入250 μL滑桃树种子化学组分(EA ext.,Bu ext.,Water ext.),将S.sp. WXC菌株接种在添加了滑桃树种子化学组分的高氏一号培养基和未添加任何化学组分的高氏一号培养基中分别进行培养,在28℃,180 r/min的条件下,分别培养3、4、5和6 d。根据不同培养时间,收集菌体,4℃,6 000 r/min,15-20 min,上清用等体积乙酸乙酯萃取2遍,浓缩得到胞外的乙酸乙酯相;菌体经过冷冻抽干后,用乙酸乙酯提取得到胞内的乙酸乙酯相。以上每个样品分别作3个重复。
1.2.7 滑桃树种子化学组分对S.sp. WXC菌株活性化合物的影响 对胞内和胞外的乙酸乙酯相,分别用HPLC技术来检测其中活性成分frenolicin B的含
量。以纯品frenolicin B作为标准样,分别取3、6、12、25和50 μg 上样,洗脱剂为甲醇∶水(60∶40),洗脱条件为1 mL/min,27℃。根据所得的数据制作frenolicin B的标准曲线。将胞内和胞外的乙酸乙酯相分别经过HPLC检测,洗脱剂为甲醇∶水(60∶40),洗脱条件为1 mL/min,27℃。根据标准曲线,算出各样品中frenolicin B的含量,frenolicin B的产量与S.sp. WXC菌株的生物量的比值,即为frenolicin B的相对表达量。
2 结果
2.1 滑桃树种子化学组分对S. sp. WXC菌株生长和生物量的影响
本研究在前期试验现象基础上,提取了滑桃树种子的化学成分,根据成分的化学极性,对其进行溶剂分组,排除组分PE ext.(主要为常见的脂溶性化学成分),通过纸片法研究滑桃树种子化学组分(Water ext.、EA ext.和Bu ext.)对S.sp. WXC菌株生长状态的影响。结果(图1)表明,位于Water ext.纸片周围的菌株生长较多且紧密,其次为Bu ext.,EA ext.对菌株生长并没有明显的作用,说明滑桃树种子中的水溶性物质对S.sp. WXC菌株的生长起到明显的促进作用。

图1 滑桃树种子化学组分对S. sp. WXC菌株生长状态的影响
除此以外,与不加种子化学成分的培养条件相比,S.sp. WXC菌株在添加种子化学成分后,菌株生物量发生了较大的变化,从3、4、5和6 d的数据来看,添加Water ext.的菌株干重几乎是不添加时的3倍(图2)。Bu ext.对菌株干重的影响次之,EA ext.对菌株干重并没有明显的作用。该结果进一步确定了滑桃树种子的水溶性成分能刺激菌体生长。而且S.sp. WXC的菌液浓度随着Water ext.浓度的提高而升高,当Water ext.浓度在1-25 μg/mL时,菌株WXC的菌液浓度急剧上升,但在125-1 000 μg/mL时,菌液浓度增加较为平缓(图3)。
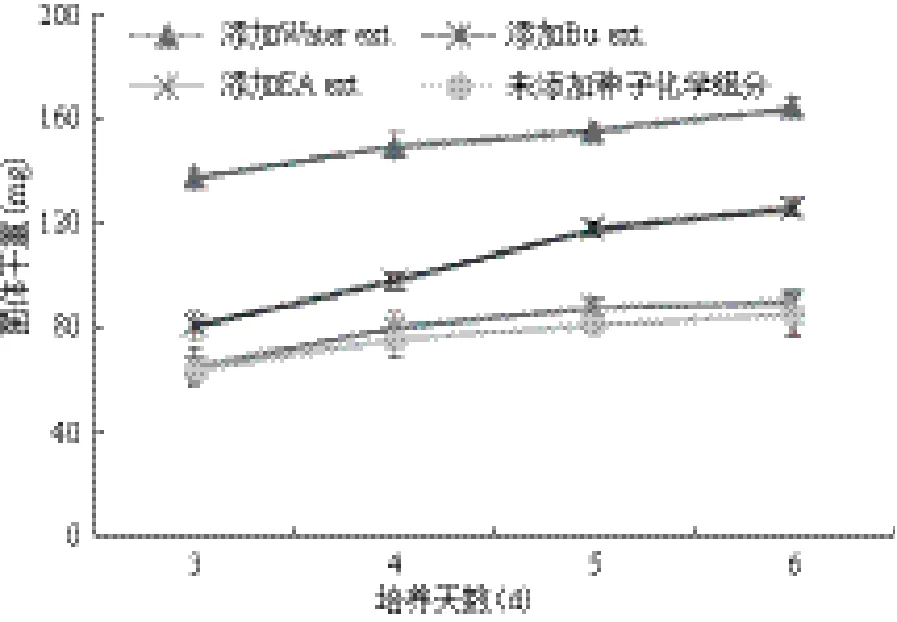
图2 滑桃树种子化学组分对S. sp. WXC菌株生物量的影响

图3 不同浓度Water ext.对S. sp. WXC菌液浓度的影响
2.2 滑桃树种子化学组分对S.sp. WXC菌株次生代谢产物的影响
从S.sp. WXC菌株胞内和胞外次生代谢产物的产量来看,滑桃树种子的Water ext.对胞外的产物有明显的促进作用,相比之下,Bu ext.和EA ext.对胞外的产物没有明显的作用。在第3天添加Water ext.的菌株胞外次生代谢产物的产量与不加种子成分的菌体产量一致,但在菌体的指数生长期,添加Water ext.的菌株胞外次生代谢产物的产量逐渐增加,到第6天产量几乎是不添加种子成分的2-3倍(图4)。可见,种子的水溶性提取物对S.sp. WXC菌株胞外的次生代谢产物有明显的诱导作用,而对胞内的次生代谢产物无明显作用。

图4 滑桃树种子Water ext.对S. sp. WXC菌株次生代谢产物的影响
2.3 滑桃树种子化学组分对S.sp. WXC菌株活性化合物的影响
从3-6 d HPLC的检测结果(图5)表明,添加了Water ext.的fenolicin B的产量逐渐增加,而Bu ext.和EA ext.对fenolicin B的产量影响并不大。在第6天时,添加了Water ext.的fenolicin B的产量达到不添加Water ext.的3倍左右,说明滑桃树种子的水溶性提取物诱导内生菌提高了活性化合物fenolicin B的产量。

图5 滑桃树种子化学组分对fenolicin B产量的影响
3 讨论
S.sp. WXC菌株是从滑桃树种子中分离到的一株内生菌,在长期与宿主植物相互作用的过程中,S.sp. WXC菌株已经适应了植物的内生小环境,当将它从植物中分离出来,并培养在人工培养基上时,其生长速度缓慢。大部分不可培养或难以培养的内生菌也出现同样的现象,较为典型的如菌株Frankia,在人工培养时,与大多数自由生长的细菌相比,该菌的生长非常缓慢,并且呈现出各种不同的形态[9]。本研究发现,滑桃树的种子水溶性提取物Water ext.对S.sp. WXC菌株的生长有明显的促进作用,并且菌株的生物量随着Water ext.浓度的升高而提高。Water ext.对S.sp. WXC菌株的次生代谢产物也有明显的促进作用,诱导菌株提高了主要活性化合物fenolicin B的产量。滑桃树种子的化学组分Water ext.、Bu ext.和EA ext.的分子极性由大到小,各组分对S.sp. WXC菌株的影响程度中Water ext.最明显,EA ext.对菌株的影响不明显,说明对S.sp. WXC菌株有诱导作用的植物成分是分子极性比较大的物质,很可能是水溶性的成分。本试验为进一步研究对其内生菌S.sp. WXC有影响的滑桃树种子化学成分奠定了基础。
滑桃树水溶性化学组分对S.sp. WXC菌株的活性化合物fenolicin B的影响,说明了S.sp. WXC菌株作为滑桃树的内生菌,在与植物宿主的长期协同进化过程中,通过产生具有抑制真菌活性的物质,形成了共生化学防御,并且这种活性物质可以被植物宿主所诱导。植物与土壤微生物的化学防御机制主要应用于生物防治。由于植物内生菌分布于植物的不同组织中,有充足的营养物质,同时受到植物组织的保护,不受外部恶劣环境如强烈日光、紫外线、风雨等的影响,具有稳定的生态环境。因此,相对于附生菌内生菌更易于发挥生防作用[10]。而且植物内生菌可以直接面对病菌的侵染,通过降解病菌菌丝、产生拮抗物质或诱导植物产生系统抗性抑制病原物,对病菌的致病因子或病菌本身发起攻击,而植物本身的基因并未发生改变,仍然可以保持植物的天然性状[11]。因此,植物内生放线菌是植物病害生物防治的天然资源菌,具有广阔的理论研究价值和开发应用前景。
4 结论
主要研究滑桃树种子不同化学组分对其内生菌Streptomycessp. WXC生长、代谢和活性化合物的影响。结果表明,滑桃树种子水溶性提取物Water ext.对S. sp. WXC的生长、次生代谢产物甚至是活性化合物都有明显的促进作用。
[1] Maynard-Smith J. A Darwinian view of symbiosis. Symbiosis as a source of evolutionary innovation[M]. Margulis L, Fester R, eds. Speciation and Morphogenesis. Camibridge:MIT Press, 1991:26-39.
[2] Benson DR, Silvester WB. Biology of Frankia strains, actinomycete symbionts of actinorhizal plants[J]. Microbiology Review, 1993, 57(2):293-319.
[3] Schrey SD, Tarkka MT. Friends and foes:streptomycetes as modulators of plant disease and symbiosis[J]. Antonie Van Leeuwenhoek, 2008, 94(1):11-19.
[4] Conn VM, Walker AR, Franco CMM. Endophytic actinobacteria induce defense pathways inArabidopsis thaliana[J]. Molecular Plant Microbe Interaction, 2008, 21(2):208-218.
[5] Coombs JT, Franco CMM. Isolation and identification of actinobacteria isolated from surface-sterilized wheat roots[J]. Applied Environment Microbiology, 2003, 69(9):5603-5608.
[6] Powell RG, Weisleder D, Smith CR. Novel maytansinoid tumor inhibitors fromTrewia nudiflora:trewiasine, dehydrotrewiasine and demethyltrewiasine[J]. Journal Organic Chemistry, 1981, 46(22):4398-4403.
[7] Powell RG, Weisleder D, Smith CR, et al. Treflorine, Trenudine, and N-Methyltrenudone:novel maytansinoid tumor inhibitors containing two fused macrocyclic rings[J]. Journal of the American Chemical Society, 1982, 104(18):4929-4934.
[8] Powell RG, Smith CR, Plattner RD, et al. Additional new maytansinoids fromTrewia nudiflora:10-epiterwiasine and nortrewiasine[J]. Journal of Natural Proctors, 1983, 46(5):660-666.
[9] Benson DR, Silvester WB. Biology of Frankia strains, actinomycete symbionts of actinorhizal plants[J]. Microbiol Rev, 1993, 57(2):293-319.
[10] Andrews JH. Biological control in the phyllosphere[J]. Annual Review Phytopathology, 1992, 30:603-635.
[11] Shudo E, Iwasa Y. Inducible defense against pathogens and parasites:optimal choice among multiple options[J]. J Theor Biol, 2001, 209(2):233-247.
(责任编辑 马鑫)
The Research on the Influence of Trewia nudiflora Seed Chemical Components on Its Endophyte
Wu Xin
(Third Institute of Oceanography State Oceanic Administration,Xiamen 361005)
Streptomyces sp. WXC was an endophytic strain isolated from the seed of Trewia nudiflora. Trewia nudiflora seed chemical components were extracted and classified. The results showed that the production of frenolicin B was induced by the addition of the Water ext., which was correlated to the upregulation of growth and secondary metabolites. Therefore, we speculated that the inducible production of the antifungal frenolicin B may be an important adaptation mechanism allowing the symbiont, S. sp. WXC, to affect its host, T. nudiflora, through the function of symbiotic chemical defense.
Trewia nudiflora seed chemical components Streptomyces sp. WXC Active compound Chemical defence
2013-12-03
吴欣,女,博士,工程师,研究方向:微生物学;E-mail:careless78@gmail.com
