小麦面筋蛋白脱酰胺改性研究进展
2014-03-17李小艳李高阳任国谱
李小艳,李高阳,任国谱,*
(1.中南林业科技大学食品科学与工程学院,湖南长沙410004;2.湖南省农产品加工研究所,湖南长沙410006)
小麦面筋蛋白脱酰胺改性研究进展
李小艳1,李高阳2,任国谱1,*
(1.中南林业科技大学食品科学与工程学院,湖南长沙410004;2.湖南省农产品加工研究所,湖南长沙410006)
对国内外小麦面筋蛋白的研究现状、面筋蛋白改性的意义和面筋蛋白脱酰胺改性的具体方法进行了阐述,对小麦面筋蛋白脱酰胺改性的应用和发展前景作出了展望。
小麦面筋蛋白,脱酰胺改性,进展
蛋白质是生命的基础,而其功能特性会影响食品的外形、风味、色泽等,因此掌握并运用好蛋白质功能特性是发展蛋白质工业的基础。小麦面筋蛋白是由小麦粉中提取出来的天然蛋白质,是人类饮食中的一个重要蛋白质来源。小麦面筋蛋白来源丰富,营养价值高,应用范围广,具有较高的经济价值。但是,目前全球小麦面筋蛋白市场需求总体“供大于求”,导致小麦面筋蛋白大量库存无法及时转变为实际产品,因此,进一步提高小麦面筋蛋白的功能特性具有巨大的商业价值。
小麦面筋蛋白可应用于食品、医药、鱼虾的饲料、可降解可重新利用的绿色粘贴剂等,但其本身有一个缺点,即低溶解性。控制溶解度的最主要因素是电荷率(charge frequeney)和疏水性(hydrophobicity)[1]。脱酰胺改性可以改变蛋白质电荷分布状态,使蛋白质分子空间结构得到伸展,改善其疏水性,最终增大了蛋白质的溶解性,使蛋白质获得良好的功能特性,从而拓宽它的应用范围。经改性的面筋蛋白机械强度好、粘结度大,可用于各种热塑产品、粘结剂、包裹材料的生产[2]。上世纪70~90年代,国外已经开始深入研究植物蛋白,国内起步相对较晚,至20世纪初期,才有相关文献报道[3]。
1 小麦面筋蛋白脱酰胺改性
1.1 小麦面筋蛋白的组成
沿用Osborne[4]对蛋白质分类的方法,按其在不同溶剂中的溶解性可划分为:溶于水的清蛋白;溶于低盐溶液的球蛋白;溶于稀酸或稀碱的麦谷蛋白以及溶于醇的麦醇溶蛋白,具体见表1。
1.2 脱酰胺改性原理
自然界中,多数蛋白侧链富含酰胺基团(谷氨酰胺和天门冬氨酰胺),它们通过氢键稳定蛋白质结构,使得蛋白质与蛋白质之间紧密相连,在一定条件下,去除这些侧链基团会使其脱酰胺基生成谷氨酸和天冬氨酸,引起氢键的减少和静电排斥的增加,导致蛋白质的空间构象发生变化,从而增加蛋白质的溶解度,有利于功能特性的提高[5],其具体过程如图1[3]。蛋白质一级、二级结构的改变对其功能性质的改变影响颇多,但Noah等[6]认为天冬酰胺脱酰胺过程中初级结构和三级结构有重要关联。而由分子内部作用力变化则说明了非共价分子内作用力(包括疏水键、氢键),是小麦面筋蛋白改性过程中聚集体形成的最主要的作用力,二硫键处理后期才开始发生效应,并逐步加固面筋蛋白网络结构[7]。
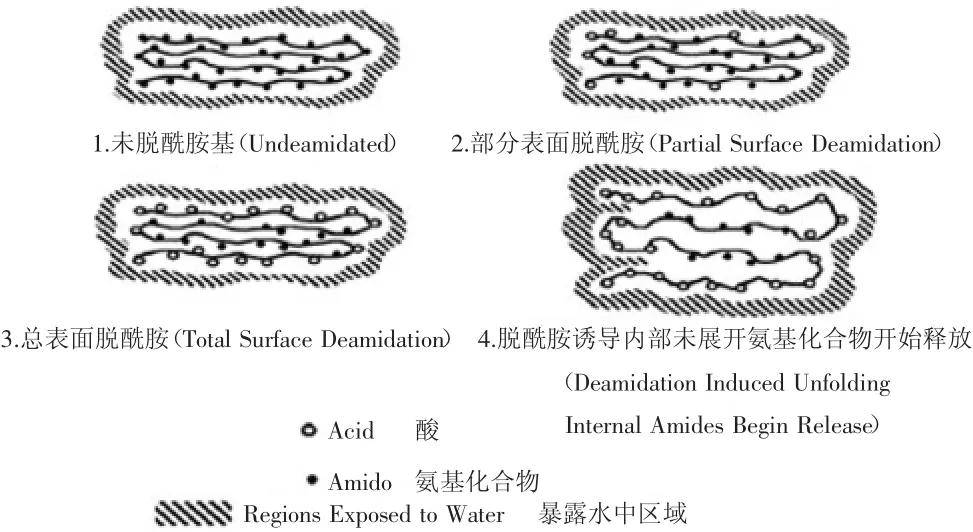
图1 脱酰胺过程中酰胺基团暴露到蛋白表面的步骤Fig.1 Exposure of amides to protein surfaces

表1 小麦面筋蛋白种类及性质Table 1 Types and properties of wheat gluten

表2 脱酰胺改性方法Table 2 The methods of deamidation of wheat gluten
1.3 脱酰胺改性方法
目前,蛋白质脱酰胺改性的方法主要有非酶法、酶法、混合脱酰胺法。蛋白质的非酶法脱酰胺改性包括物理法和化学法,其中,物理法可分为湿热法和双螺杆挤压法,化学法有温和酸/碱、盐改性。具体见表2。
1.3.1 非酶法脱酰胺—物理法 该方法下,温度是影响蛋白脱酰胺的重要条件之一,一般情况在较高的温度下,有利于加快脱酰胺反应速率。周非白等[8]以经琥珀酸脱酰胺改性、透析处理后的小麦面筋蛋白为原料,研究超声处理提高小麦面筋蛋白氮溶指数的最佳条件。得出结果为:超声功率100W、超声时间10min、超声温度44℃时,有最高氮溶指数,达到了77.28%,处理后的样品起泡性提高约11%,泡沫稳定性提高20%。另外,廖兰等[9]研究了小麦面筋琥珀酸脱酰胺(SDWGH)下两种干燥方法冷冻干燥或喷雾干燥对可溶性氮指数、电动电势、分子量分布、二次结构、功能性质的影响。结果表明,在喷雾干燥和冷冻干燥下,麦谷蛋白变成分子量较小的高分子蛋白质。这项研究使用改性后的小麦面筋在新产品配方和强化产生了一些重要的信息,比如蛋白质强化饮料、婴儿配方奶粉、咖啡美白产品、乳化剂和调味剂。
1.3.2 非酶法脱酰胺—化学法 蛋白质的化学改性是指蛋白质分子化学结构的改变,包括两个方面:蛋白质分子的侧链的基团改变;蛋白质主链结构的改变[2]。小麦面筋蛋白化学改性的主要方法有磷酸化改性、酰化改性、脱酰胺改性、糖基化改性[10]。其中,脱酰胺化学改性方法包括酸脱酰胺、碱脱酰胺、盐脱酰胺。
酸脱酰胺,具体又可分为无机酸法和有机酸法,是蛋白质脱酰胺最常用方法之一。Woodar等[11]将小麦面筋蛋白用1.0mol/L HC1溶液在75℃下处理30min,面筋蛋白去酞胺后具有很好的溶解性、乳化性和起泡性。孔祥珍等[12]采用酸法对小麦面筋蛋白进行了去酰胺改性,实验得出最佳工艺条件为:盐酸浓度0.3mol/L,物料比12.5g/100mL,反应时间5h,反应温度65℃。改性后的面筋蛋白的溶解性和乳化性均有很大提高。李红梅等[5]采用酸法去酰胺作用改变玉米蛋白的结构和乳化性能,考察了反应时间,盐酸浓度以及反应温度对反应的影响。结果表明:反应时间8h,温度60℃,盐酸浓度0.05~0.1mol/L为较好的反应条件,且该反应条件下有效地抑制蛋白质的水解,去酰胺度达到28.6%。胡庆玲等[13]优化了盐酸对小麦面筋蛋白的脱酰胺工艺:小麦面筋蛋白浓度为24%,0.30mol/L的HCl,脱酰胺24h达到最高脱酰胺度65.67%。
目前,关于蛋白质脱酰胺酸法改性的研究不仅仅局限于使用无机酸,出于对脱酰胺改性蛋白的安全性考虑,可食性有机弱酸,如醋酸、琥珀酸、柠檬酸等被开发应用到小麦面筋蛋白的脱酰胺改性中。此类有机酸含有羧酸根可电离出氢离子,并可作为酸味调节剂广泛使用于食品加工中。2010年,仇超颖等[14]研究了琥珀酸不同脱酰胺程度对小麦面筋蛋白Pancreatin酶解过程中蛋白回收率、水解度、总酸、总糖的影响,结果显示蛋白回收率、水解度、总酸在酶解过程中逐渐上升,总糖含量在酶解12h后下降。2011年,廖兰等[15]以盐酸对小麦面筋蛋白的脱酰胺作用效果为参比,选取氮溶指数、脱酰胺程度为表征指标,利用SDS-PAGE、FTIR和SEM研究柠檬酸脱酰胺改性过程中小麦面筋蛋白分子构象和功能特性的内在关系。实验结果表明:在相同的脱酰胺程度下,柠檬酸脱酰胺改性明显改善小麦面筋蛋白的起泡性,其改性蛋白的起泡性是盐酸脱酰胺改性样品的4倍;当脱酰胺程度为60%时,柠檬酸改性的蛋白其乳化性高于盐酸改性效果,且其改性蛋白的分子柔性较原始面筋蛋白有所提高。2013年,Chaoying Qiu等[16]利用琥珀酸脱酰胺,改变小麦面筋蛋白的二级结构,从而大大提高小麦面筋蛋白的溶解性。
1.3.3 酶法脱酰胺 酶法脱酰胺改性蛋白具有专一性强、保持蛋白良好特性且无副作用等优点。孔祥珍等[17]用木瓜蛋白酶对小麦面筋蛋白进行改性,在温度25℃,pH11.0,物料浓度6%,加酶量E/S为1/200条件下水解3h,去酞胺度达50%,溶解度和乳化度都大大提高。YIE HUI YONG等[18]利用从金黄杆菌中提纯的蛋白质谷氨酰胺酶来做它对小麦面筋的脱酰胺基作用的研究。水不溶性蛋白在40℃下磷酸钠缓冲溶液(pH为7)作用30h,脱酰胺程度可以达到72%。与未进行脱酰胺面筋相比,面筋脱酰胺作用时间仅为1.5~2.0h,脱酰胺程度为35%~45%,且十二烷基硫酸钠-聚丙烯酰胺凝胶电泳呈现出上移趋势。pH为7时面筋蛋白的溶解性和乳化性因为脱酰胺作用得到改善,但在pH为3时,脱酰胺作用却会使两种性能恶化。酶联免疫吸附实验鉴定了脱酰胺面筋的致敏性,与未脱酰胺面筋相比,致敏性随着脱酰胺作用时间延长显著降低。Sang Eon Lee等[19]研究了在美拉德反应中酶法改性对小麦蛋白质的吡嗪形成和其他挥发组分的影响。水解酶水解小麦面筋水解物(WGH)是使用谷氨酰胺酶脱酰胺产生脱去酰胺基的水解小麦蛋白(DWGH)。在加热情况下分析了在WGH和DWGH葡萄糖或果糖挥发组分反应。发现了在美拉德反应中通过小麦蛋白的脱酰胺作用有氨的释放,并生成了不同的挥发组分包括吡嗪。Petra Nordqvist等[20]发现,在运用小麦水解蛋白酶对小麦面筋蛋白进行改性过程中,轻度水解(0.3%~0.6%)或热处理(90℃)可以提高小麦面筋蛋白的粘结强度和耐水性。
1.3.4 混合处理脱酰胺 混合处理脱酰胺可看作酶法和化学处理方法连用,主要有酶法与磷酸处理连用,酶法与盐酸、酶法与碱连用,或者是多酶混用。
2 脱酰胺改性蛋白的应用
2.1 在食品工业中的应用
小麦面筋蛋白在食品领域应用广泛。在烘烤食品和面粉强化中,小麦面筋被用来调整面粉蛋白含量。通过采用添加小麦面筋蛋白粉来达到面包粉的要求是许多面粉生产厂家的普遍做法。用于生产甜点、馅卷、面包及其他各式各样发酵产品的小麦面筋蛋白粉约为70%。面筋蛋白通过赋予面团持水性、黏结性、粘弹性等来对烘烤品质起着决定性的作用[21]。
另外,小麦面筋蛋白也可以作为黏结剂添加进肉饼、香肠等畜肉产品中。这主要是因为当面筋被水化后,蛋白质结构得到伸展,可被拉成丝或膜,形成所需的人造肉。
在水产类饲料中,小麦面筋蛋白以其高黏合性、黏弹性及丰富的营养价值,被作为鱼虾类的优质饲料应用到现代渔业发展。这是因为小麦蛋白的黏弹性将饲料粘结成球状颗粒,悬浮于水中,这既有利于水产动物吞食又提高了饲料在水中的利用率,同时也减少了饲料对水的污染,对于发展我国的绿色生态渔业有重大意义。
小麦面筋蛋白分子量较大,分子间作用力较强,可形成较好凝胶[22]。因此,还可将小麦面筋蛋白应用于包装膜和食品贮藏保鲜膜。彭海萍等[23]以小麦面筋蛋白为原料,制备可食性包装膜。首先,通过单因素实验考察小麦面筋蛋白浓度和增塑剂用量、成膜溶剂、成膜溶液的pH及热处理等条件对膜性能的影响,并进一步做正交实验,确定了小麦面筋成膜的最佳工艺条件:小麦面筋-甘油配比为4∶1,乙醇浓度为50%,成膜溶液的pH为11,热处理温度为80℃。汤虎[24]运用改性后的小麦面筋蛋白涂膜液对杨桃进行涂膜处理,发现其更好地抑制了杨桃的蒸腾作用和呼吸作用,延长保质期至20~24d,比对照延后6~8d。
2.2 非食品工业中的应用
作为一种植物蛋白,小麦面筋蛋白有着大部分高分子石化材料不可比拟的优点:来源丰富、可再生、可降解。通过物理、化学、生物学等方法改性,小麦面筋蛋白可开发成小麦面筋蛋白膜、小麦面筋蛋白塑料、小麦面筋蛋白胶等新型的可生物降解的功能材料[25]。
蛋白类高分子均有易于代谢的优点,并且能以相对非专一的形式包埋药物,随着新材料、新技术、新方法的涌现,采用天然高分子材料(尤其是可降解的植物蛋白)来制备纳米、微米颗粒得到了更加广泛的关注。2012年,廖兰等[26]介绍了琥珀酸脱酰胺小麦面筋(SDWG)微粒采用加热聚合的乳化SDWG通过OWO复合包埋法包装鱼油(FO)。研究了不同的SDWG浓度(16.8~67.2mg/mL)和FO/SDWG比例(1∶3~4∶3,w/w)。优化工艺,分析了SDWG-FO乳化的粒度和电动电势及FO的包埋率。最佳情况是改性小麦面筋蛋白浓度为50.4mg/mL时鱼油包埋率达到最高81.8%。该研究拓展了小麦面筋蛋白在药物缓释体系的应用范围,同时为以小麦蛋白为基础设计其他敏感性油脂性或非油脂性药物提供了理论依据。佟颖[27]利用玉米醇溶蛋白和麦醇溶蛋白对WG膜进行改性,结果表明:添加适量的玉米醇溶蛋白可有效地降低膜的脆性,提高膜的韧性、阻水性、机械性和阻氧性。该研究为拓展WG膜的应用范围起到积极作用,为以小麦面筋蛋白为基础设计的新型材料提供了理论基础。
3 展望
我国是小麦种植大国,产量居世界之首,小麦的供大于求在我国尤为突出,因此深度开发小麦产品显得尤为重要。目前,我国对小麦的研究尚处于初级阶段,而且主要集中于食品领域,小麦的深加工技术亟待开发。王怡然等[21]认为小麦面筋蛋白将来的研究重点可以放在通过改变从植物生长合成蛋白质到焙烤得到最终产品中的二硫结构来改变面筋蛋白的特性。另外,还可以通过加入食品添加剂,如面团改良剂,对面筋蛋白结构和功能的关系进行深入了解。异源基因表达和蛋白质工程作为新的视角,将会对蛋白质结构功能的研究有重要的帮助[19]。当然,除了对小麦面筋蛋白的相关构象研究,宏观上,可以扩大研究小面面筋蛋白的应用领域。同时,也需要拓展小麦面筋蛋白改性方法技术。通过小麦面筋蛋白脱酰胺可获得良好功能性质的面筋蛋白,并且该方法相对成熟。因此,小麦面筋蛋白脱酰胺改性也可作为将来的研究重点,主要是争取在脱酰胺的试剂选取和方法运用上有突破研究。
[1]Wang C R,Zayas J F.Water retention and solubility of soy Proteins and corn germ proteins in a model system[J].Food Sci,1991,56:455.
[2]钟耕,陈宗道,闵燕萍,等.小麦面筋蛋白及其化学改性研究[J].粮食与饲料工业,2001(5):41-43.
[3]廖兰.湿热有机酸脱酰胺改性小麦面筋蛋白及作用机理的研究[D].广州:华南理工大学,2011.
[4]Osborne T B.The proteins of the wheat kernal-Carnegie 1nst [C].Washington,1907,84:119-120.
[5]李红梅.玉米蛋白脱酰胺改性的研究[J].粮食与饲料工业,2007(4):19-22.
[6]Robinson N E,Robinson A B.Prediction of protein deamidation rates from primary and three-dimensional structure [J].Biochemistry,2001,98(8):4367-4372.
[7]Liao L,Liu T X,Zhao M M,et al.Aggregation behavior of wheat gluten during carboxylic acid deamidation upon hydrothermal treatment[J].Journal of Cereal Science,2011(54):129-136.
[8]周非白,廖兰,赵谋明.超声处理对脱酰胺改性后的小麦面筋蛋白功能特性的影响[J].食品科学,2011,32(16):157-161.
[9]Liao L,Wang Q,Zhao M M.Functional,conformational and topographical changes of succinic acid deamidated wheat gluten upon freeze-and spray-drying:A comparative study[J].LWTFood Science and Technology,2012(50):177-184.
[10]张龙,史吉平,杜风光,等.小麦面筋蛋白化学改性研究进展[J].粮食加工,2006,31(6):56-58.
[11]Woodar J C.Preparation and Properties of Acid-solubilized Gluten Conformation[J].Nutrition,1973:103-569.
[12]孔祥珍,周惠明.小麦面筋蛋白脱酰胺改性的研究[J].食品科学,2003,24(12):47-49.
[13]胡庆玲,尹文颖,赵谋明,等.小麦面筋蛋白盐酸脱酰胺工艺优化及其酶解敏感性[J].食品与发酵工业,2013,39(4):7-11.
[14]仇超颖,廖兰,崔春,等.琥珀酸脱酰胺对小麦面筋蛋白酶解特性的影响[J].食品工业科技,2010,31(8):74-77.
[15]廖兰,赵谋明,王芹,等.柠檬酸对小麦面筋蛋白的脱酰胺作用[J].江南大学学报,2011,32(1):16-21.
[16]Qiu C Y,Sun W Z,Cui C,et al.Effect of citric acid deamidation on in vitro digestibility and antioxidant properties of wheat gluten[J].Food Chemistry,2013,141(3):2772-2778.
[17]孔祥珍,周惠明,冯蔷妹.小麦面筋蛋白酶法去酰胺改性的研究[J].食品工业科技,2004(8):70-72.
[18]Yie H Y,Shotaro Y.Effects of Enzymatic Deamidation by Protein-Glutaminase on Structure and Functional Properties of Wheat Gluten[J].Agricultural and Food Chemistry,2006,54:6034-6040.
[19]Lee S E,Chung H,Kim Y S.Effects of enzymatic modification of wheat protein on the formation of pyrazines and other volatile components in the Maillard reaction[J].Food Chemistry,2012(131):1248-1254.
[20]Nordqvist P,Lawther M.Adhesive properties of wheat gluten after enzymatic hydrolysis or heat treatment-A comparative study [J].Industrial Crops&Products,2012,38:139-145.
[21]王怡然,王金水,赵谋明,等.小麦面筋蛋白的组成、结构和特性[J].食品工业科技,2007,28(10):228-231.
[22]王亚平,安艳霞.小麦面筋蛋白组成、结构和功能特性[J].粮食与油脂,2011(1):1-4.
[23]彭海萍,王兰.可食性包装膜的研制[J].食品工业科技,2003,24(1):64-66.
[24]汤虎.超声波及琥珀酸化法改性小麦面筋蛋白的研究[D].武汉:华中农业大学,2008.
[25]邓敏,付时雨,詹怀宇.小麦谷朊蛋白的特性与应用研究综述[J].中国粮油学报,2009,24(12):146-151.
[26]Liao Lan,Luo Yangchao,Zhao Mouming,et al.Preparation and characterization of succinic acid deamidated wheat gluten microspheres for encapsulation offish oil[J].Colloidsand SurfacesB:Biointerfaces,2012,92:305-314.
[27]佟颖.小麦蛋白膜改良及成膜机理研究[D].沈阳:沈阳农业大学,2012.
Reasearch progress in the deamidation of wheat Gluten
LI Xiao-yan1,LI Gao-yang2,REN Guo-pu1,*
(1.Central South University of Forestry and Technology College of food science and Engineering,Changsha 410004,China;2.Hunan Provincial Research Institute of Agricultural Product Processing,Changsha 410125,China)
Deamidation is an important means of wheat gluten modification.The latest research situation both in China and abroad was reviewed in this paper.The meaning of deamidation and its main methods were also summarized.At last,the application and the development of wheat gluten were presented.
wheat gluten;deamidation;advance
TS201.1
A
1002-0306(2014)08-0390-04
10.13386/j.issn1002-0306.2014.08.081
2013-08-19 *通讯联系人
李小艳(1989-),女,在读硕士研究生,研究方向:食品科学与营养。
