卵白蛋白多肽的酶解制备及抗氧化活性研究
2014-03-17宋宏新薛海燕贺宝元
宋宏新,秦 婧,薛海燕,贺宝元
(1.陕西科技大学生命科学与工程学院,陕西西安710021;2.陕西科技大学资源与环境学院,陕西西安710021)
卵白蛋白多肽的酶解制备及抗氧化活性研究
宋宏新1,秦 婧1,薛海燕1,贺宝元2
(1.陕西科技大学生命科学与工程学院,陕西西安710021;2.陕西科技大学资源与环境学院,陕西西安710021)
以DPPH自由基清除率和水解度为指标,采用碱性蛋白酶酶解卵白蛋白制备抗氧化活性肽,考察底物质量分数、酶解时间、加酶量、温度等因素对制备的影响。正交实验结果表明,碱性蛋白酶的最佳水解条件为:底物质量分数4%、酶解时间6h、加酶量5500U/g,温度65℃,此条件下DPPH自由基清除率达到96.92%、水解度为57.14%。酶解时间对DPPH自由基清除率的影响最大,而底物质量分数对水解度的影响最大。
卵白蛋白,碱性蛋白酶,抗氧化活性
卵白蛋白是蛋清中的最主要的蛋白质,其含量占蛋清总蛋白质的54%,营养价值较高、加工与生物学性能良好,在免疫学研究和动物细胞培养及抗体制备中有重要作用[1-2]。卵白蛋白酶解后得到的多肽具有多种生理活性,如抗氧化肽、降压肽、抗菌肽、免疫肽等。抗氧化肽不仅具有多肽产品的营养作用,且具备抗氧化和清除自由基的功能,帮助机体消除多余的自由基、增强人体抗衰老、抗疾病能力[3-4]。Davalos等研究发现,卵白蛋白酶解物具有强抗氧化活性分离出具较强抗氧化性的多肽Tyr-Ala-Glu-Glu-Arg-Tyr-Pro-Ile-Leu[5]。周国仪等纯化鸡卵清蛋白多肽,得到了两组对DPPH自由基清除能力较强的组分,清除率分别为84.02%和81.17%,分子量分别集中在180u左右200u左右[6]。沈勇根等用胃蛋白酶水解卵白蛋白得到了抗氧化能力较强的3个肽分别是源于鸡蛋卵白蛋白第115~117氨基酸残基(Pro-Glu-Tyr),分子质量408.14u;第245~248氨基酸残基(Leu-Pro-Asp-Glu),分子质量473.19u;第148~150氨基酸残基(Trp-Val-Glu),分子质量433.18u[7]。可见来源于蛋清源的抗氧化肽,不但具有良好的抗氧化活性,且安全性极高,因而在保健食品以及生物医药领域的应用前景十分广阔。
卵白蛋白分子不耐酶解,由385个氨基酸残基组成,其中50%以上为疏水氨基酸,而碱性蛋白酶有水解疏水性氨基酸的专一性,主要裂解的疏水性氨基酸如:Leu、Ile、Val等。卵白蛋该酶水解位点相符合。故本研究采用碱性蛋白酶酶解卵白蛋白,对其酶解物的抗氧化活性进行研究。
1 材料与方法
1.1 材料与仪器
卵白蛋白A5253(纯度62%~88%) Sigma公司;碱性蛋白酶(酶活≥200000U/g) 北京奥博兴生物技术有限公司;二苯基苦基苯肼(DPPH,分析纯)Sigma公司;无水乙醇、氢氧化钠、盐酸等 均为分析纯。
752型紫外可见分光光度计 上海光谱仪器有限公司;HC-3081型高速冷冻离心机 安徽中科中佳仪器有限公司;酸度计 北京赛多利斯仪器系统有限公司;恒温水浴锅(HH-1) 常州国华电器有限公司。
1.2 实验方法
1.2.1 碱性蛋白酶水解方法 溶解卵白蛋白粉→用氢氧化钠调pH至10→将样品置于水浴锅里,待样品温度升至酶解温度时加酶→酶解一定时间→用盐酸调pH至5灭酶→离心→取上清液待测。
1.2.1.1 底物质量分数 固定时间5h、加酶量6500U/g、温度55℃,底物质量分数3%、4%、5%、6%,考察底物质量分数对DPPH自由基清除率和水解度的影响。
1.2.1.2 酶解时间 固定底物质量分数4%、加酶量6500U/g、温度55℃,分别酶解3、4、5、6h,考察酶解时间对DPPH自由基清除率和水解度的影响。
1.2.1.3 加酶量 固定底物质量分数4%、时间5h、温度55℃,加酶量4500、5500、6500、7500U/g,考察加酶量对DPPH自由基清除率和水解度的影响。
1.2.1.4 酶解温度 固定底物质量分数4%、时间5h、加酶量6500U/g,温度45、55、65℃,考察酶解对DPPH自由基清除率和水解度的影响。
1.2.2 检测方法
1.2.2.1 DPPH自由基清除率测定 抗氧化活性测定采用测定DPPH自由基清除率[8]。准确称取10mg DPPH溶于100mL无水乙醇得储备液,冰箱避光保存。用时稀释4倍得6.5×10-5mol/L DPPH·溶液,另将待测抗氧化剂配制成系列溶液。对照组:2.5mL的6.5×10-5mol/L DPPH乙醇溶液+0.5mL蒸馏水;样品:2.5mL的6.5×10-5mol/L DPPH乙醇溶液+0.5mL样液;空白组:2.5mL无水乙醇溶液+0.5mL样液。各组反应10min后1cm比色皿517nm下测定吸光值。重复测定3次,结果取平均值。然后按下式计算:
清除率(%)=[1-(Ai-Aj)/A0]×100
式中:A0为对照组吸光值;Ai为样液吸光值;Aj为未加DPPH的空白组吸光值。
1.2.2.2 指标的测定 水解度测定:水解度(%)=(氨基态氮/总氮)×100;
氨基氮测定:采用甲醛滴定法[9]。分别吸取10mL不同水解度的水解液于100mL烧杯中加蒸馏水60mL,开动磁力搅拌器,用0.050mol/L氢氧化钠标准溶液滴定至pH=8.20时停止搅拌,加入甲醛10mL(pH=9.20),用磁力搅拌器混匀,再用0.050mol/L NaOH滴定至pH=9.20,记下加入甲醛后消耗的0.050mol/L氢氧化钠体积(mL),同时做空白实验。
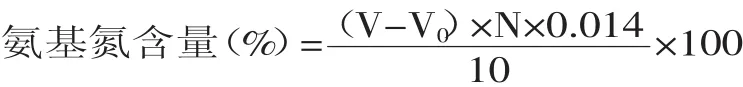
式中:V:样品耗用氢氧化钠标准溶液毫升数;V0:空白耗用氢氧化钠标准溶液毫升数;N:氢氧化钠标准溶液摩尔浓度。
总氮测定:采用微量凯氏定氮法[10]。
1.2.3 正交实验 以DPPH自由基清除率和水解度为指标,以底物质量分数、酶解时间、加酶量、温度为考察因素,取三个水平,进行L9(34)正交设计实验,确定碱性蛋白酶酶解卵白蛋白的最佳工艺条件,并对最优组合进行验证实验。

表1 因素水平表Table 1 Factors and levels of experiment
2 结果与讨论
2.1 各因素对DPPH自由基清除率和水解度的影响
2.1.1 底物质量分数对DPPH自由基清除率和水解度的影响 如图1所示,DPPH自由基清除率、水解度随着底物质量分数的增大而先升高后降低,在底物质量分数为4%时两者均达到最大分别为87.67%和72.45%。当底物质量分数在3%~4%,两者都迅速提高,这说明底物质量分数较低时,较低的底物量不足以与酶完全反应,故增大底物质量能够加快酶催化反应速率,所以增加底物质量分数二者都急剧增加;当底物质量分数继续增大超过4%时,二者都呈现降低的趋势,可能因酶的活性中心已被底物饱和,再增加底物质量分数,反应速度也不再增加,而且还有一定程度的抑制作用。底物质量分数初步定为4%。

图1 底物质量分数对DPPH自由基清除率和水解度的影响Fig.1 Effect of ovalbumin concentration on DPPH radical scavenging and degree of hydrolysis
2.1.2 酶解时间对DPPH自由基清除率、水解度的影响 如图2所示,DPPH自由基清除率随着酶解时间的延长而先增大后减小,在酶解3~5h时,DPPH清除率显著提高,并在5h达到最高为90.18%,后又下降。水解度则随着时间延长而一直上升,在6h达到最大为80.84%。在3~5h时,二者均提升显著是因为酶与底物充分结合反应迅速;而5~6h时,酶与底物依然结合充分故水解度依然上升,但DPPH清除率下降可能是因为已经形成的抗氧化肽已被部分氧化,从而引起产物结构的变化,致使DPPH清除率下降。综合考虑选择酶解时间5h。

图2 酶解时间对DPPH自由基清除率和水解度的影响Fig.2 Effect of contact time on DPPH radical scavenging and degree of hydrolysis
2.1.3 加酶量对DPPH自由基清除率、水解度的影响 加酶量对DPPH自由基清除率的影响如图3所示。由图3可见,DPPH自由基清除率随着加酶量的增加先上升后下降,在4500~6500U/g时,DPPH清除率显著提升,并在6500U/g达到最高为85.33%。水解度随着加酶量的增加呈上升趋势,在7500U/g达到最大为73.46%。在4500~6500U/g时,二者均提升显著是因为酶进行催化反应时首先要与底物形成一个中间物即酶-底物复合物,而这一步骤正是整个反应的限速步骤,当底物浓度大大超过酶浓度时,这种中间物的生成速度取决于酶的浓度,所以此时增加酶的量,中间物生成速度加快,从而整个反应的速度也加快;加酶量大于6500U/g后,水解度进一步提升,而DPPH清除率下降,虽然水解度提高使得总多肽含量增加但水解出的具有抗氧化活性的多肽反而减少,说明抗氧化活性与一定的肽结构和分子量有关;再者,也有研究报道[11],酶量过高时,由于酶本身的相互水解作用加强,也会阻碍酶对底物的水解。综合考虑加酶量初步定为6500U/g。

图3 加酶量对DPPH自由基清除率和水解度的影响Fig.3 Effect of enzyme content on DPPH radical scavenging and degree of hydrolysis
2.1.4 温度对DPPH自由基清除率、水解度的影响 众所周知,在蛋白酶酶底物过程中有一个最适的反应温度,在一定范围内升高温度,底物转变成产物的速度加快,酶解效率也相应提高,表现在水解度上则呈增加趋势[12]。如图4所示,DPPH自由基清除率开始随着温度的升高先升高后下降,在55℃达到最高为85.81%,后又下降。水解度则随着温度的升高而升高,在65℃达到最高为72.81%。由于温度升高,使得酶催化反应速度加快,在相同时间内的水解度提高,但DPPH清除率下降,可能是因为温度过高影响了已经生成的抗氧化肽的活性。综合考虑选择酶解温度55℃。

图4 温度对DPPH自由基清除率和水解度的影响Fig.4 Effect of temperature on DPPH radical scavenging and degree of hydrolysis
2.2 正交实验结果
根据根据实验结果,获得实验直观分析表见表2。

表2 正交实验结果Table 2 The results of orthogonal experiment
由表2可知,影响卵白蛋白酶解物DPPH清除率的各因素先后顺序为:B>D>A>C,即酶解时间>酶解温度>底物质量分数>加酶量,最优组合是A2B3C1D3,即底物质量分数4%、酶解时间6h、加酶量5500U/g,温度65℃。经过验证实验测得该条件下,DPPH自由基清除率达到96.92%、水解度为57.14%。
影响卵白蛋白酶解物水解度的因素先后顺序为:A>B>C>D,即底物质量分数>酶解时间>加酶量>酶解温度,最优组合是A3B1C3D3,即底物质量分数5%、酶解时间4h、加酶量7500U/g,温度65℃。该组合未出现在正交表中,经过验证实验测得DPPH自由基清除率为68%、水解度达到95.77%。
由于卵白蛋白酶解物水解度主要与底物质量分数有关,而DPPH自由基清除率则受酶解时间的影响最大,而以水解度为指标的制备工艺优化,并不能获得高自由基清除率的最佳条件,因此在工艺控制中应以抗氧化能力为衡量指标。故选定最佳组合为A2B3C1D3,即底物质量分数4%、酶解时间6h、加酶量5500U/g,温度65℃。
2.3 验证实验
采用底物质量分数4%、酶解时间6h、加酶量5500U/g,温度65℃的酶解条件进行验证实验,结果见下表3。

表3 验证实验结果Table 3 Results of the verification experiment
即最佳酶解工艺条件为:底物质量分数4%、酶解时间6h、加酶量5500U/g,温度65℃。在此条件下,DPPH自由基清除率达到96.92%、水解度为57.14%。
3 结论
3.1 碱性蛋白酶酶解卵白蛋白的抗氧化活性研究中,对DPPH自由基清除率的影响因素先后顺序为:酶解时间>酶解温度>底物质量分数>加酶量;对水解度的影响因素先后顺序为:底物质量分数>酶解时间>加酶量>酶解温度。
3.2 实验得出碱性蛋白酶水解卵白蛋白制备抗氧化活性肽的最佳工艺条件:底物质量分数4%、酶解时间6h、加酶量5500U/g,温度65℃,此时,DPPH自由基清除率达到96.92%、水解度为57.14%,可见碱性蛋白酶酶解卵白蛋白的酶解物具有较强的抗氧化活性。
[1]Masayuki Y,Nobuyuki,Masaaki H.Crystal structure of S-ovalbumin as a non-loop-interted thermostabilized serpin form [J].Journal of Biological Chemistry,2003,278(37):35524-35530.
[2]Mine Y,Noutomi T,Haga N.Emulsifying and structural properties of ovalbumin[J].Journal of Agricultural and Food Chemistry,1991,39(3):443-446.
[3]Decker EA,Crum AD.Inhibition of oxidative rancidity in salted ground pork by Camosine[J].J Food Sci,1991,56(5):1179-1183.
[4]芮铭安,王曹峰,方晶,等.还原型谷胱甘肽和胆宁片治疗非酒精脂肪肝的临床疗效比较[J].中国药科医学,2001,4(4):269-270.
[5]Davalos A,Miguel M,Bartolome B,et al.Antioxidant activity of peptides derived from egg white proteins by enzymatic hydrolysis [J].J Food Prot,2004,67(9):1939-1944.
[6]周国仪,成静,陈栋梁,等.鸡卵清蛋白多肽的纯化及抗氧化作用的研究[J].食品科学,2009,30(15):30-32.
[7]沈勇根,徐明生,尹忠平,等.卵白蛋白抗氧化肽分离与纯化[J].中国食品学报,2011,8(11):16-22.
[8]HEO S J,PARK E J,LEE K W,et al.Antioxidant activities of enzymaticextractsfrom brown seaweeds[J].Bioresource Technology,2005,96:1613-1623.
[9]宁正祥.食品成分分析手册[M].北京:中国轻工业出版社,1998:120-121.
[10]GB/T 5009.5-2010食品中蛋白质的测定[S].北京:中国标准出版社,2010.
[11]翟瑞文,李雁群,陈子林,等.玉米面筋的酶水解[J].食品工业,1997(3):7-8.
[12]王彩云,荆莹,石丹,等.酶解酪蛋白制备易于消化吸收肽的工艺研究[J].中国乳品工业,2012,40(3):18-21.
Study on preparation and antioxidant activity of peptides derived from ovalbumin
SONG Hong-xin1,QIN Jing1,XUE Hai-yan1,HE Bao-yuan2
(1.College of Life Science and Engineering,Shaanxi University of Science and Technology,Xi’an 710021,China;2.College of Resource and Environment,Shaanxi University of Science and Technology,Xi’an 710021,China)
In the experiment,ovalbumin was hydrolyzed by alkaline protease to obtain antioxidant peptide.Using DPPH radical scavenging activities and degree of hydrolysis as index,single factors including substrate concentration,enzymolysis time,enzyme concentration and enzymolysis temperature,were applied to research their influences on the preparation.Orthogonal experiment showed the most suitable condition of alkaline protease to hydrolyze ovalbumin was substrate concentration of 4%,enzymolysis time of 6h,alkaline protease of 5500U/g,enzymolysis temperature of 65℃ respectively.In this condition,DPPH radical scavenging rates reached 96.92%,and degree of hydrolysis was 57.14%.Enzymolysis time had the greatest influence on DPPH radical scavenging activities and substrate concentration had the greatest influence on degree of hydrolysis.
ovalbumin;alkaline protease;antioxidant activity
TS201.1
A
1002-0306(2014)08-0153-04
10.13386/j.issn1002-0306.2014.08.026
2013-08-17
宋宏新(1959-),男,硕士研究生,教授,研究方向:食品营养与安全。
国家自然科学基金项目(31301405);陕西省自然科学基础研究计划项目(2012JM2009);陕西省教育厅自然科学专项项目(2012JK0655)。
