唑来膦酸对去势大鼠骨折后骨痂和骨微结构的影响
2014-03-17陆永江
陆永江 刘 华
解放军第四七四医院骨科,新疆乌鲁木齐830013
唑来膦酸对去势大鼠骨折后骨痂和骨微结构的影响
陆永江 刘 华▲
解放军第四七四医院骨科,新疆乌鲁木齐830013
目的探讨唑来膦酸对去势大鼠骨折后骨痂和骨微结构的影响。方法将45只SD雌性大鼠分为骨质疏松组(30只)和正常对照组(15只),骨质疏松组雌性大鼠被切除双侧卵巢制作骨质疏松动物模型,正常对照组大鼠仅给予假手术;骨质疏松模型建模成功后,将骨质疏松组30只大鼠再次随机分为生理盐水组(15只)和唑来膦酸组(15只);对两组大鼠制作股骨骨折模型,并分别给予生理盐水和唑来膦酸进行干预;在药物干预4周后,比较生理盐水组和唑来膦酸组骨质疏松大鼠股骨骨痂和骨微结构情况。结果卵巢切除术后8周,正常对照组和骨质疏松组大鼠股骨的骨密度分别为(0.197±0.028)g/cm2和(0.128±0.037)g/cm2,差异有统计学意义(P<0.05);在药物干预4周后,两组骨质疏松大鼠股骨均有骨痂形成,而唑来膦酸组大鼠骨痂明显大于生理盐水组,且骨折线较为模糊;与生理盐水组大鼠比较,唑来膦酸组大鼠骨小梁间隙较小,排列也较为整齐致密,更接近正常对照组大鼠。结论唑来膦酸可促进骨质疏松大鼠骨折后骨痂形成,并提高其骨密度。
唑来膦酸;骨质疏松;股骨骨折;骨痂;骨微结构
由于社会老龄化的现象日趋严重,骨质疏松症的患病率明显升高,一项调查结果显示,全世界年龄超过50岁的人群中,约有一半的人患有该病或伴有不同程度的骨量降低[1]。而骨质疏松性骨折在临床上也较为常见,其主要病理表现为骨量减少、骨显微结构异常、骨脆性增加。因此,临床上有较多的患者在使用以双膦酸盐为代表的药物预防或治疗骨质疏松症,它可有效降低骨质疏松患者髋部及脊椎的病理性骨折的发生率,约有超过400万大于45岁的美国妇女在使用此类药物[2]。本研究通过切除雌性大鼠卵巢的方法建立骨质疏松动物模型,以探讨唑来膦酸对去势大鼠骨折后骨痂和骨微结构的影响。
1 材料与方法
1.1 实验动物
清洁级SD大鼠45只,由兰州军区乌鲁木齐总医院动物中心提供,体重250~300 g;实验大鼠饲养于兰州军区乌鲁木齐总医院动物实验室(室温保持于25~30℃,湿度保持在45%左右),饲养环境为完全清洁级,饲养颗粒和饮用水均经过严格消毒;定时进行通风、消毒及照明,并于每日更换垫料。
1.2 实验材料
克氏针(规格:1.2 mm,唐山先锋医疗器械有限公司);DR数字化摄影机(UD-150B-10型,日本东芝);双能X线吸收仪(法国Medi公司);切片机、载玻片、石蜡、染色剂等病理组织标本制作装置(由解放军474医院病理科提供);Olympus显微镜(AH-2型,日本奥林巴斯公司);医学图象分析系统(MIAS型,中国北航公司);唑来膦酸(艾瑞宁,规格:4 mg,国药准字H20041955,国药集团国瑞药业有限公司);水合氯醛(扬州市奥鑫助剂厂);生理盐水,由解放军第四十四医院(以下简称“我院”)制剂室提供。
1.3 分组及骨质疏松模型的建立
将上述45只雌性SD大鼠分为骨质疏松组(30只)和正常对照组(15只);按照3mL/kg的剂量使用水合氯醛对雌性SD大鼠进行腹腔麻醉,在无菌条件下进行手术操作,正常对照组大鼠仅给予假手术,骨质疏松组雌性大鼠被切除双侧卵巢;两组大鼠接受手术后可自由活动并进食,连续3 d给予青霉素(80万U,2次/d)预防感染;术后第8周,所有雌性SD大鼠行双能X线吸收仪检测,检测后采用MIAS医学图象分析系统进行图像分析,对比正常对照组和骨质疏松组大鼠骨密度;将骨质疏松组30只大鼠再次随机分为生理盐水组(15只)和唑来膦酸组(15只)。
1.4 骨折模型的建立
在骨质疏松模型建立成功1周后,以3 m L/kg的剂量使用水合氯醛对骨质疏松组大鼠腹腔麻醉,选择单侧股骨进行消毒,取大鼠股骨中段为手术切口,逐层分离股骨中段皮肤、皮下组织及深层筋膜,直至暴露出股骨骨膜并咬断股骨,随后用克氏针进行髓内固定,术毕逐层关闭手术切口,术后连续3 d给予青霉素(80万U,2次/d)预防感染。
1.5 药物干预
于骨质模型成功建立后,生理盐水组大鼠皮下注射生理盐水,10 mL/kg,每周1次,连续4周;给予唑来膦酸组大鼠唑来膦酸,5 mg/kg,皮下注射,每周1次,连续4周。两组大鼠可自由活动并进食,饲养环境室温控制于25~30℃,湿度保持在45%左右,每天定时照明、通风及消毒。
1.6 骨痂的对比方法
在药物干预4周后,使用水合氯醛对唑来膦酸和生理盐水组骨质疏松大鼠进行腹腔麻醉,并对大鼠断肢股骨进行X线片检查,观察并比较两组大鼠骨折线处骨痂生长及骨折线模糊情况。
1.7 骨微结构的对比方法
在药物干预4周后处死所有45大鼠,手术切取患侧股骨,剔除股骨周围肌肉和软组织,取出克氏针,切取股骨中段及骨痂组织,逐步对标本进行固定、脱钙、包埋、切片及HE染色;由我院病理科医师显微镜下观察骨微结构。
1.8 统计学方法
采用统计软件SPSS 17.0对实验数据进行分析,计量资料数据以均数±标准差(x±s)表示,采用t检验。计数资料以率表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 正常对照组与骨质疏松组大鼠骨密度比较
在造模过程中,正常对照组和唑来膦酸组各有1只大鼠死亡,其中正常对照组大鼠在麻醉过程中死亡,唑来膦酸组大鼠在制作骨折模型中出现死亡,其余大鼠均存活,未出现感染。于卵巢切除术后8周,采用双能X线吸收仪,比较正常对照组和骨质疏松组大鼠股骨的骨密度,分别为(0.197±0.028)g/cm2和(0.128± 0.037)g/cm2,骨质疏松组大鼠骨密度明显低于正常对照组,差异有统计学意义(P<0.05),。
2.2 骨痂的X线比较
在药物干预4周后,采用X线拍片的方法,比较唑来膦酸组和生理盐水组骨质疏松组大鼠股骨骨痂形成状况。由图1、2可以看出,两组骨质疏松大鼠均有骨痂形成,而唑来膦酸组大鼠骨痂明显大于生理盐水组,且骨折线较为模糊。
2.3 骨微结构的比较
在药物干预4周后,显微镜下比较各组大鼠股骨的骨微结构,正常对照组大鼠骨小梁形态结构规则,粗细较为一致,排列紧密并形成网状结构;而另两组骨质疏松大鼠骨小梁骨小梁排列相对疏松,且体积小数目少,可见骨小梁断裂缺损;与生理盐水组大鼠比较,唑来膦酸组大鼠骨小梁间隙较小,排列也较为整齐致密,更接近正常对照组大鼠。见图3~5。
3 讨论
骨折的愈合过程往往牵涉一系列的生物因子,主要包括有细胞、细胞外组织及众多细胞因子,该过程较为复杂。骨折愈合从组织学上可概括为血肿和炎症期、初始骨痂反应期、软骨形成期和骨形成改建期等四个阶段[3-4]。骨质疏松性骨折是临床诊疗过程中较为常见的一类疾病,好发于老年及女性,尤其是绝经后女性,这主要与雌性激素活性水平降低,导致骨量减少、骨微结构异常及骨密度降低有关,有较高的发病率和致残率。骨质疏松性骨折与其他类型的暴力性骨折有一定区别,骨质疏松患者的骨密度低于正常人,骨小梁明显变薄、缺损,甚至穿孔导致骨的微结构严重破坏,骨骼内髓腔面积进一步增大,骨皮质消耗变薄,因此骨质疏松患者在在骨折发生率高的同时,其发病后往往较其他暴力性骨折难以恢复,临床治疗效果不明显,病程较长[5-7]。使用何种办法促使骨质疏松性骨折骨痂尽快形成,骨微结构尽快修复,从而促进患者早日康复成为目前研究焦点之一。本组研究通过切除SD雌性大鼠卵巢制作骨质疏松动物模型,以探讨唑来膦酸对去势大鼠骨折后骨痂和骨微结构的影响,进一步为唑来膦酸应用于骨质疏松性骨折提供实验室依据。

图1 X线片示唑来膦酸组大鼠骨痂形成情况

图2 X线片示生理盐水组大鼠骨痂形成情况
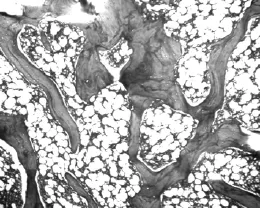
图3 正常对照组大鼠骨微结构(HE染色,50×)
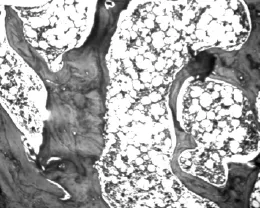
图4 唑来膦酸组大鼠骨微结构(HE染色,50×)
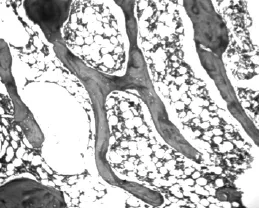
图5 生理盐水组大鼠骨微结构(HE染色,50×)
唑来膦酸属于最新一代双膦酸盐类药物,具有类似于焦磷酸盐的结构,它的P-C-P结构代替了后者的P-O-P基团,具有有效P-C-P基团的双膦酸盐类药物可以抵制由破骨细胞产生的焦磷酸酯酶的水解作用,并在一定程度上保持体内的稳定性[8]。相关研究显示,双膦酸盐类药物可以有效抑制骨吸收并明显增加骨量,是目前治疗骨质疏松较为重要的药物之一,并被应用于恶性肿瘤骨转移的治疗当中。双膦酸盐类药物主要作用为抑制骨吸收,机制可能为:①直接改变破骨细胞的形态学,从而抑制其功能;②与骨基质理化结合,直接干扰骨吸收;③直接抑制成骨细胞介导的细胞因子如IL-6、TNF的产生[9-12]。本组研究显示,卵巢切除后的雌性大鼠经一定时间喂养后,其骨密度明显低于正常大鼠,说明雌性激素可导致骨量不同程度降低;进一步通过股骨内置入克氏针制作骨质疏松模型,采用生理盐水与唑来膦酸对比的治疗方法,结果显示唑来膦酸组大鼠骨痂明显大于生理盐水组,骨折部位愈合较快;通过显微镜下观察,接受唑来膦酸干预的骨质疏松性骨折大鼠骨微结构更接近正常大鼠,说明唑来膦酸有助于骨质疏松性骨折大鼠的恢复。这可能与以下因素有关:①唑来膦酸能抑制骨吸收,还能增加骨密度,使丧失的骨组织恢复;②唑来膦酸能够增加小梁骨的再建,也能减小骨吸收陷窝深度;③改变了骨基质的活性,进而影响了基质对破骨细胞的激活;④影响成骨细胞系分化增殖,调节Ca2+细胞内移动,增强成骨细胞分化成熟[13-16]。
综上所述,唑来膦酸可促进骨质疏松大鼠骨折后骨痂形成,并提高其骨密度,但该药若广泛应用于临床治疗骨质疏松性骨折,尚需设计严谨科学的大规模、多中心、随机对照研究,为其进一步提供循证医学依据。
[1]MadureiraMM,CiconelliRM,PereiraRM.Qualityof lifemeasurements in patients with osteoporosis and fractures[J]. Clinics(Sao Paulo),2012,67(11):1315-1320.
[2]Poole KE,Compston JE.Bisphosphonates in the treatment of osteoporosis[J].BMJ,2012,344:e3211.
[3]许勇,李飞跃,王晋申,等.断骨膏外用对去势大鼠骨折后骨痂形成和改建的影响[J].上海交通大学学报:医学版,2011,3(5):551-560.
[4]ThomasT.Apotentialmediatorforprotectiveeffectsoffatmass on bone tissue[J].Joint Bone Spine,2003,70(1):18-21.
[5]Larsson S,ProcterP.Optimisingimplantanchorage(augmentation)during fixation of osteoporotic fractures:is there a role forbone-graftsubstitutes?[J].Injury,2011,42(Suppl2):72-76.
[6]金文杰,陶海荣,沈康平,等.雷洛昔芬对OVX大鼠骨质疏松性骨折愈合的影响[J].中国骨质疏松杂志,2013,19(5):494-499.
[7]黄公怡.骨质疏松性骨折及其临床特点[J].中华骨科杂志,2008,28(1):74-77.
[8]Vieira HP,Leite IA,Araújo Sampaio TM,et al.Bisphosphonates adherence for treatment of osteoporosis[J].Int Arch Med,2013,24(1):24.
[9]赵祥波,张喆骅,晏秀祥,等.双膦酸盐类药物研究及应用进展[J].中国骨质疏松杂志,2011,17(10):917-921.
[10]W right NC,Warriner AH,Saag KG.Study design considerations for a large simple trial of bisphosphonates[J]. Curr Opin Rheumatol,2013,25(4):517-523.
[11]Isla D,Afonso R,Bosch BJ,etal.Zoledronic Acid in lung cancerwith bonemetastases:a review[J].Expert Rev Anticancer Ther,2013,13(4):421-426.
[12]RossiniM,Orsolini G,Adami S,et al.Osteoporosis treatment:why ibandronicacid?[J].ExpertOpin Pharmacother,2013,14(10):1371-1381.
[13]Kim SY,Schneeweiss S,Katz JN,et al.Oral bisphosphonatesand risk of subtrochanteric or diaphyseal femur fractures in a population-based cohort[J].JBone Miner Res,2011,26(5):993-1001.
[14]W right NC,Warriner AH,Saag KG.Study design considerations for a large simple trial of bisphosphonates[J]. Curr Opin Rheumatol,2013,25(4):517-523.
[15]周耀东,陈宇杰,袁慧仪,等.与长期服用双膦酸盐相关的非典型股骨骨折的髓内固定治疗[J].中华创伤骨科杂志,2013,15(2):97-101.
[16]蔡尾玉,蒋煜文,徐红.唑来膦酸与阿仑膦酸钠治疗Ⅰ型骨质疏松症的临床对比研究[J].中国药房,2012,23(42):3995-3997.
Effects of Zoledronic Acid on callus and bone m icrostructure after fracture in osteoporosis rats
LU Yongjiang LIU Hua▲
Department of Orthopedics,the 474th Hospital of People's Liberation Army,Xinjiang Uygur Autonomous Region, Urumqi 830013,China
Ob jective To investigate the effects of Zoledronic Acid on callus and bone microstructure after fracture in osteoporosis rats.M ethods 45 SD female rats were divided into osteoporosis group(30 cases)and control group(15 cases),the female rats osteoporosis group were ovariectomized tomakemodel of osteoporosis,the rats of normal control were only given sham-operated;after themodel of osteoporosis wasmade successfully,the 30 rats of osteoporosis group were again random ly divided into saline group(15 cases)and Zoledronic Acid group(15 cases);all rats of osteoporosis group weremade femur fracturemodel,and been given saline and Zoledronic Acid to treatment;4 weeks after drug intervention,the callus and bonemicrostructure situation of rats were observed and compared.Results At 8 weeks after ovariectomy,the BMD of femur in SD rats of osteoporosis group and control group were(0.197±0.028)g/cm2and (0.128±0.037)g/cm2kespectively,the difference was significant(P<0.05);after 4 weeks of drug intervention,all rats of two groups had osteoporosis femur bone callus formation,and callus in rats of Zoledronic Acid group was significantly greater than that of the saline group,and the fracture linewasmore blurred;compared with the rats of saline group, the trabecular bone gap in rats of Zoledronic Acid group wasmore smaller,compact and tidy arrangementwas relatively closer to the normal control group.Conclusion Zoledronic Acid can promote the rat osteoporotic bone fracture callus formation and increase bone density.
Zoledronic Acid;Osteoporosis;Femoral fractures;Callus;Bonemicrostructure
R285.5
A
1673-7210(2014)02(c)-0011-04
2013-10-18本文编辑:卫轲)
▲通讯作者
