李氏膈食散体外抗肿瘤实验研究
2014-03-16夏方博李徐刘亚旻郭智沈胜楠潘瑞乐
夏方博 李徐 刘亚旻 郭智 沈胜楠 潘瑞乐▲
1.中国医学科学院北京协和医科大学药用植物研究所,北京100193;2.广东省深圳市宝安区李徐钦西医内科诊所,广东深圳518101
李氏膈食散体外抗肿瘤实验研究
夏方博1李徐2刘亚旻1郭智1沈胜楠1潘瑞乐1▲
1.中国医学科学院北京协和医科大学药用植物研究所,北京100193;2.广东省深圳市宝安区李徐钦西医内科诊所,广东深圳518101
目的研究李氏膈食散体外抗肿瘤作用。方法采用水提和醇提的方法提取李氏膈食散的复方中的水溶和醇溶性成分。MTT法测定水提物和醇提物对肝癌细胞(HpeG-2)、胃癌细胞(MKN-45)、食道癌细胞(EC-109)的抑制作用。结果两种提取物对二种肿瘤细胞株均有体外抗肿瘤作用,且以乙醇提取物效果更好。乙醇提取物对HpeG-2、MKN-45、EC-109二种肿瘤细胞株的半数抑制浓度分别为:622.89、173.41和210.17 μg/mL,最大抑制率在90%左右。结论李氏膈食散提取物在体外具有抑制HpeG-2、MKN-45、EC-109生长的作用。
李氏膈食散;消化系统;体外;抗肿瘤
癌症是严重威胁人类健康和社会发展的重大疾病之一,也是目前威胁我国居民健康的重大疾病。最近统计数据显示,我国癌症发病率呈逐年上升趋势,其中消化系统癌症如胃癌、结肠癌等癌症占全部癌症构成的10%以上,均为危害较大的常见肿瘤[1]。目前临床上常用的放化疗方法治疗肿瘤,在杀伤肿瘤细胞的同时,也造成机体骨髓抑制和免疫功能低下,毒副作用大。因此从天然的动物、植物及矿物中寻找高效低毒的抗肿瘤药物或活性成分是近年来国内外学者研究的热点。中医药是我国特有的传统医药宝库,在我国用于防病治病已有2000多年的历史,为抗癌药物的研发提供了十分丰富的资源。
李氏膈食散是根据祖辈行医经验并吸取历代各家治疗食管癌的理论精髓,形成的具有独特疗效的经验方。李氏膈食散由阿魏、蟾蜍、马宝、白花蛇舌草等中药根据中医理论配伍而成,临床应用已数十年,经观察对食道癌、胃癌等消化道癌症有显著疗效,能有效消除癌症肿块、减轻患者痛苦,并能促进食欲,延长癌症患者寿命。本研究从体外证明李氏膈食散水提取物和醇提取物对消化道肿瘤细胞如人肝癌细胞(HepG-2)、人胃癌细胞(MKN-45)以及人食道癌细胞(EC-109)的抑制作用,为李氏膈食散临床治疗消化道肿瘤提供现代研究证据。
1 仪器与试药
1.1 药物
李氏膈食散由广东省深圳市宝安区李徐钦西医内科诊所提供。
1.2 细胞系
人肝癌细胞(HepG-2)、人胃癌细胞(MKN-45)、人食道癌细胞(EC-109),均购自中国医学科学院基础医学研究所细胞资源中心。
1.3 试剂仪器
95%乙醇(分析纯,北京化工厂),DMSO(分析纯,北京化工厂),RPMI 1640培养基(Solarbio公司,中国),胰蛋白酶(Solarbio公司,中国),胎牛血清(Gibco公司,美国),磷酸盐缓冲液(Thermo公司,德国),噻唑蓝(MTT)试剂(Gibco公司,美国)。纯水仪(Millipore公司,美国),96孔细胞培养板(Thermo公司,德国),倒置显微镜(OLYMPUS公司,日本),二氧化碳培养箱(Thermo公司,德国),连续波长酶标仪(BIO-TEK,美国)。
2 方法与结果
2.1 李氏膈食散水提取物的制备
称取李氏膈食散生药粉末10 g,加10倍量水回流提取3次,每次30 min,过滤,滤液合并,真空干燥,得到李氏膈食散水提物,得率为16.8%。
2.2 李氏膈食散乙醇提取物的制备
称取李氏膈食散生药粉末10 g,加10倍量95%乙醇溶液回流提取3次,每次30 min,过滤,滤液合并,真空干燥,得到李氏膈食散乙醇提取物,得率为10.5%。
2.3 李氏膈食散水提物或醇提物抑制肿瘤细胞生长的测定
取对数生长期的肝癌细胞株(HepG-2)、胃癌细胞株(MKN-45)以及食道癌细胞株(EC-109)消化计数后接种于96孔培养板中,每孔8000~10 000个细胞,培养12 h,弃去培养液,加入不同浓度的含药培养基100 μL继续培养24 h,吸出培养液,每孔加入150 μL磷酸盐缓冲溶液加入100 μL 0.5 g/L的MTT溶液,继续培养4 h候弃去MTT溶液,每孔加入150 μL DMSO溶解,平板震荡仪震荡15 min,在酶标仪上用波长570 nm,参比波长为450 nm的条件测定各孔吸光度值(OD),计算抑制率:[抑制率(%)=(1-实验组OD值/对照组OD值)×100%],并求出各浓度半数抑制浓度(IC50)。
2.4 统计学方法
采用统计软件SPSS 17.0对实验数据进行分析,计量资料数据以均数±标准差(x±s)表示,采用单因素方差分析及t检验。计数资料以率表示,采用χ2检验。以P<0.05为差异有统计学意义。
2.5 结果
2.5.1 李氏膈食散水提物对三种肿瘤细胞的抑制作用李氏隔食散水提取物在浓度为15.62~1000.00 μg/mL范围内对HepG-2、MKN-45以及EC-109均有一定的抑制作用,相对而言,对HepG-2的抑制作用稍强,其IC50为143.59 μg/mL。而对胃癌细胞株(MKN-45)以及食道癌细胞株(EC-109)在此浓度范围内抑制率不超过50%。组间比较,各类肿瘤细胞株抑制率差异均有统计学意义(均P<0.05)。见表1~3。
表1 李氏膈食散水提物对肝癌细胞HepG-2的抑制作用±s,n=8)

表1 李氏膈食散水提物对肝癌细胞HepG-2的抑制作用±s,n=8)
注:“-”表示无数据;IC50:半数抑制浓度
组别浓度(μ g / m L)吸光度抑制率(%)I C50(μ g / m L)空白对照李氏膈食散李氏膈食散李氏膈食散李氏膈食散李氏膈食散李氏膈食散李氏膈食散李氏膈食散--1 4 3 . 5 9 7 . 8 1 1 5 . 6 2 3 1 . 2 5 6 2 . 5 0 1 2 5 . 0 0 2 5 0 . 0 0 5 0 0 . 0 0 1 0 0 0 . 0 0 1 . 2 4 ± 0 . 0 9 1 . 0 1 ± 0 . 0 8 0 . 8 4 ± 0 . 1 0 0 . 7 4 ± 0 . 0 8 0 . 6 8 ± 0 . 1 2 0 . 6 2 ± 0 . 1 2 0 . 5 6 ± 0 . 0 5 0 . 5 8 ± 0 . 0 7 0 . 5 9 ± 0 . 0 5 1 6 . 5 6 ± 3 . 8 1 3 0 . 2 0 ± 1 0 . 6 1 3 8 . 6 4 ± 7 . 7 0 4 4 . 1 2 ± 1 3 . 4 8 4 9 . 0 9 ± 1 1 . 0 5 5 4 . 0 4 ± 3 . 7 8 5 1 . 7 5 ± 7 . 8 1 5 1 . 2 7 ± 6 . 7 2
表2 李氏膈食散水提物对胃癌细胞MKN-45的抑制作用(s,n=4)

表2 李氏膈食散水提物对胃癌细胞MKN-45的抑制作用(s,n=4)
注:“-”表示无数据,由于最大抑制率未达到50%,IC50无法计算;IC50:半数抑制浓度
组别浓度(μ g / m L)吸光度抑制率(%)I C50(μ g / m L)空白对照李氏膈食散李氏膈食散李氏膈食散李氏膈食散李氏膈食散李氏膈食散李氏膈食散---1 5 . 6 2 3 1 . 2 5 6 2 . 5 0 1 2 5 . 0 0 2 5 0 . 0 0 5 0 0 . 0 0 1 0 0 0 . 0 0 1 . 0 8 ± 0 . 0 6 1 . 0 7 ± 0 . 0 6 1 . 0 7 ± 0 . 0 5 1 . 0 1 ± 0 . 0 4 1 . 0 3 ± 0 . 0 1 0 . 8 5 ± 0 . 0 4 0 . 7 7 ± 0 . 0 2 0 . 6 4 ± 0 . 0 2 7 . 2 5 ± 3 . 1 3 7 . 6 3 ± 2 . 4 0 1 3 . 3 8 ± 4 . 7 6 1 1 . 4 4 ± 2 . 4 9 2 6 . 8 2 ± 4 . 0 8 3 3 . 6 2 ± 3 . 3 8 4 4 . 8 1 ± 3 . 4 0
表3 李氏膈食散水提物对食道癌细胞EC-109的抑制作用±s,n=8)

表3 李氏膈食散水提物对食道癌细胞EC-109的抑制作用±s,n=8)
注:“-”表示无数据;IC50:半数抑制浓度
组别浓度(μ g / m l)吸光度抑制率(%)I C50(μ g / m L)空白对照李氏膈食散李氏膈食散李氏膈食散李氏膈食散李氏膈食散李氏膈食散李氏膈食散--5 9 5 . 4 2 1 5 . 6 2 3 1 . 2 5 6 2 . 5 0 1 2 5 . 0 0 2 5 0 . 0 0 5 0 0 . 0 0 1 0 0 0 . 0 0 1 . 5 0 ± 0 . 0 3 1 . 1 7 ± 0 . 0 5 1 . 1 9 ± 0 . 0 3 1 . 0 3 ± 0 . 0 4 0 . 9 9 ± 0 . 0 4 0 . 8 1 ± 0 . 0 2 0 . 7 5 ± 0 . 0 1 0 . 7 3 ± 0 . 0 2 2 1 . 1 5 ± 2 . 6 0 2 0 . 7 2 ± 2 . 9 4 3 1 . 0 3 ± 1 . 6 9 3 3 . 7 8 ± 2 . 8 7 4 5 . 6 4 ± 1 . 6 6 5 0 . 1 6 ± 1 . 4 1 5 1 . 5 4 ± 1 . 7 6
2.5.2 李氏膈食散醇提物对三种肿瘤细胞的抑制作用李氏膈食散醇提取物在浓度为23.44~1500 μg/mL范围内对HepG-2、MKN-45以及EC-109均有较好的的抑制作用,最高抑制率在90%左右,对HepG-2、MKN-45及EC-109二种细胞株的;IC50分别为:622.89、173.41和210.17 μg/mL。组间比较,各类肿瘤细胞株抑制率差异均有统计学意义(均P<0.05)。见表4~6。
表4 李氏膈食散乙醇提取物对肝癌细胞HepG-2的抑制作用(±s,n=8)
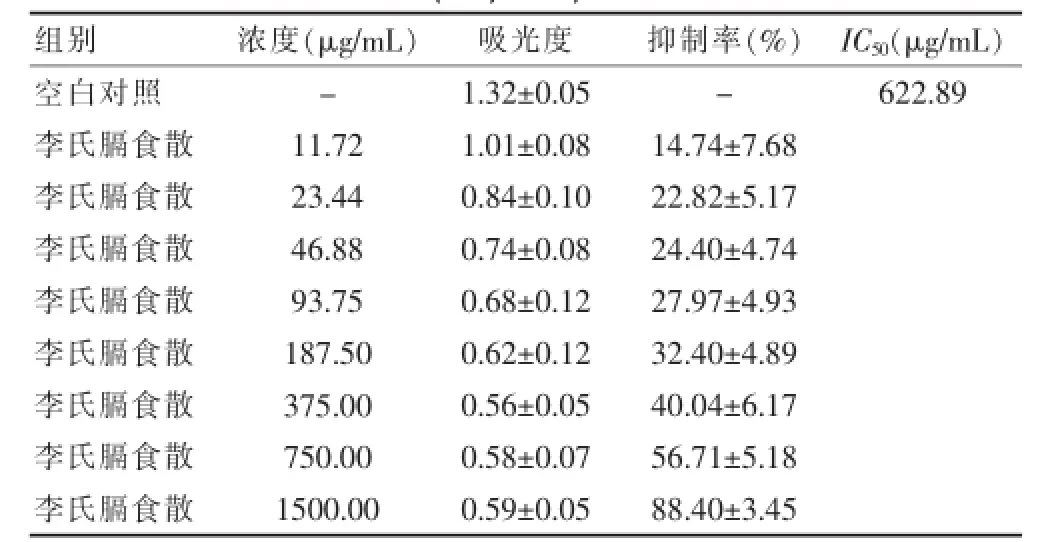
表4 李氏膈食散乙醇提取物对肝癌细胞HepG-2的抑制作用(±s,n=8)
注:“-”表示无数据;IC50:半数抑制浓度
组别浓度(μ g / m L)吸光度抑制率(%)I C50(μ g / m L)空白对照李氏膈食散李氏膈食散李氏膈食散李氏膈食散李氏膈食散李氏膈食散李氏膈食散李氏膈食散--6 2 2 . 8 9 1 1 . 7 2 2 3 . 4 4 4 6 . 8 8 9 3 . 7 5 1 8 7 . 5 0 3 7 5 . 0 0 7 5 0 . 0 0 1 5 0 0 . 0 0 1 . 3 2 ± 0 . 0 5 1 . 0 1 ± 0 . 0 8 0 . 8 4 ± 0 . 1 0 0 . 7 4 ± 0 . 0 8 0 . 6 8 ± 0 . 1 2 0 . 6 2 ± 0 . 1 2 0 . 5 6 ± 0 . 0 5 0 . 5 8 ± 0 . 0 7 0 . 5 9 ± 0 . 0 5 1 4 . 7 4 ± 7 . 6 8 2 2 . 8 2 ± 5 . 1 7 2 4 . 4 0 ± 4 . 7 4 2 7 . 9 7 ± 4 . 9 3 3 2 . 4 0 ± 4 . 8 9 4 0 . 0 4 ± 6 . 1 7 5 6 . 7 1 ± 5 . 1 8 8 8 . 4 0 ± 3 . 4 5
表5 李氏膈食散乙醇提取物对胃癌细胞MKN-45的抑制作用±s,n=8)

表5 李氏膈食散乙醇提取物对胃癌细胞MKN-45的抑制作用±s,n=8)
注:“-”表示无数据;IC50:半数抑制浓度
组别浓度(μ g / m L)吸光度抑制率(%)I C50(μ g / m L)空白对照李氏膈食散李氏膈食散李氏膈食散李氏膈食散李氏膈食散李氏膈食散李氏膈食散--1 7 3 . 4 1 2 3 . 4 4 4 6 . 8 8 9 3 . 7 5 1 8 7 . 0 5 3 7 5 . 0 0 7 5 0 . 0 0 1 5 0 0 . 0 0 1 . 1 5 ± 0 . 0 2 1 . 0 2 ± 0 . 0 6 0 . 9 9 ± 0 . 0 6 1 . 0 1 ± 0 . 0 7 0 . 2 7 ± 0 . 0 5 0 . 0 7 ± 0 . 0 1 0 . 1 7 ± 0 . 0 2 0 . 4 0 ± 0 . 0 3 1 1 . 0 9 ± 4 . 2 8 1 3 . 3 1 ± 6 . 0 6 1 1 . 6 6 ± 4 . 9 0 7 6 . 6 3 ± 4 . 2 6 9 3 . 9 8 ± 0 . 5 5 8 4 . 7 9 ± 1 . 4 6 6 4 . 7 8 ± 2 . 2 9
表6 李氏膈食散乙醇提取物对食道癌细胞EC-109的抑制作用s,n=4)
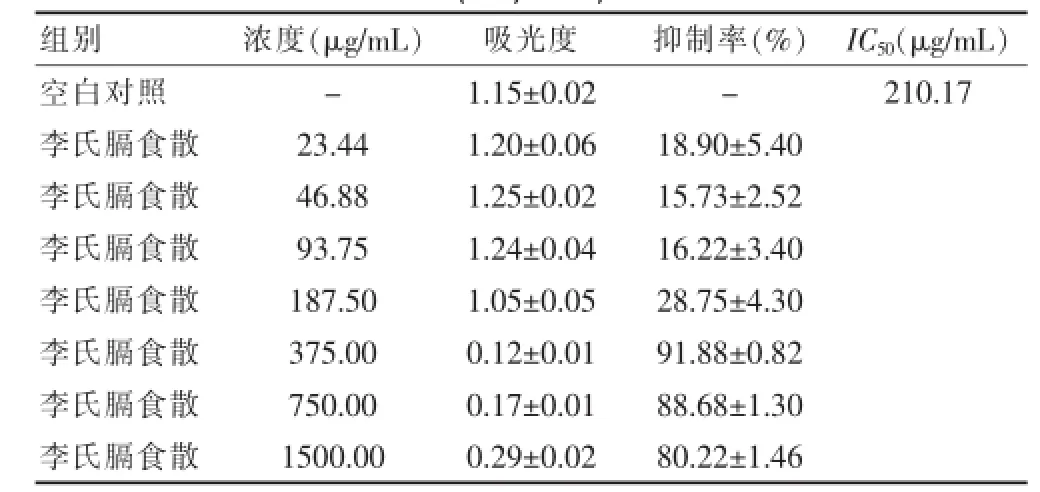
表6 李氏膈食散乙醇提取物对食道癌细胞EC-109的抑制作用s,n=4)
注:“-”表示无数据;IC50:半数抑制浓度
组别浓度(μ g / m L)吸光度抑制率(%)I C50(μ g / m L)空白对照李氏膈食散李氏膈食散李氏膈食散李氏膈食散李氏膈食散李氏膈食散李氏膈食散--2 1 0 . 1 7 2 3 . 4 4 4 6 . 8 8 9 3 . 7 5 1 8 7 . 5 0 3 7 5 . 0 0 7 5 0 . 0 0 1 5 0 0 . 0 0 1 . 1 5 ± 0 . 0 2 1 . 2 0 ± 0 . 0 6 1 . 2 5 ± 0 . 0 2 1 . 2 4 ± 0 . 0 4 1 . 0 5 ± 0 . 0 5 0 . 1 2 ± 0 . 0 1 0 . 1 7 ± 0 . 0 1 0 . 2 9 ± 0 . 0 2 1 8 . 9 0 ± 5 . 4 0 1 5 . 7 3 ± 2 . 5 2 1 6 . 2 2 ± 3 . 4 0 2 8 . 7 5 ± 4 . 3 0 9 1 . 8 8 ± 0 . 8 2 8 8 . 6 8 ± 1 . 3 0 8 0 . 2 2 ± 1 . 4 6
3 讨论
李氏膈食散临床使用的是散剂,即将药材粉碎,过筛,混匀,即用于胃癌、食道癌等消化道肿瘤患者的治疗,患者服用方法通常采用黄酒送服。由于体外细胞实验时药材粉末是不能进入细胞的,必须对药材进行提取。本文对李氏膈食散进行水提取和醇提取两种方法,并对两种提取物均进行了体外抗肿瘤活性研究。实验结果表明两种提取物对HpeG-2、MKN-45、EC-109二种消化系统肿瘤细胞株均有体外抗肿瘤效果,以乙醇提取物效果更好。乙醇提取物对3种肿瘤细胞株最大抑制率在90%左右。本文的研究结果初步表明李氏膈食散脂溶性成分可能具有更好的抗肿瘤活性,也间接证明临床采用黄酒服用是有一定的科学依据。
李氏膈食散复方主要由阿魏、蟾蜍、白花蛇舌草等传统中药配伍而成。阿魏是一味常用中药,早在《新修本草》中就有记载[2]。阿魏有特殊的臭气,味苦而辛,有理气消肿、活血消疲、祛痰和兴奋神经的功效[3-4]。赵贝等[5]通过整体、细胞、分子二个水平初步证明阿魏药酒有一定的抗肿瘤作用,主要是通过阻止肿瘤的浸润和转移,提高机体免疫能力。蟾蜍首载于《名医别录》,早在《神农本草经》就载有“虾蟆”的性味与主治。古今验方广泛应用蟾蜍、蟾酥拔毒消肿、定痛杀虫、强心利尿。现已有蟾酥镇痛膏、蟾酥注射液、华蟾素注射注和复方蟾皮胶囊等制剂应用于临床抗肿瘤、镇痛、利水消肿等[6]。现代研究表明蟾蜍膏对肺癌、肝癌、胃癌等多种癌痛缓解总有效率为92.65%[7];蟾酥注射液对食道癌、贲门癌手术切除后治疗1~2年生存率均高于单纯手术组[8];华蟾素治疗原发性肝癌总有效率为52.1%~56%,采用自身对照方法评价有效率为45%[9]。白花蛇舌草味甘、淡、性凉,归胃、大肠、小肠经,具清热解毒、消肿镇痛的功效,主治阑尾炎、气管炎、尿道感染、毒蛇咬伤、肿瘤、肠风下血等[10]。体外实验证明白花蛇舌草乙醇提取物对人低分化胃腺癌细胞(BGC)、人类口腔表皮样癌细胞(KB)、人肝癌细胞(SMMC)、人宫颈癌细胞(HELA)、人肺癌细胞(A549)有一定的抑制作用[11-12]。体内证明白花蛇舌草乙醇提取物对小鼠移植性S180实体瘤有一定抑制作用[13]。以白花蛇舌草为君药的医院制剂中肝合剂,在治疗中晚期原发性肝癌的临床疗效显示能显著提高Ⅲ期原发性肝癌患者的生活质量,延长生存时间[14]。李氏膈食散的主要药味无论临床还是实验研究均具有良好的抗肿瘤效果,表明李氏膈食散复方配伍具有理论和和实践应用的基础。
李氏膈食散复方既有动物药又有植物药,各味药的主要活性成分各不相同,蟾蜍抗肿瘤主要活性成分为蟾毒内酯类成分,属强心苷类物质,包括蟾毒灵(bufalin)、脂蟾蜍配基(resibufogenin)、华蟾酥毒基(cinobufagin,又称华蟾毒精)等[15];阿魏主要活性成分为挥发油、香豆素和苯丙素等[3],白花蛇舌草的主要活性成分有黄酮、二萜、有机酸及多糖等多种成分[16-17],这些不同活性成分从肿瘤不同靶点发挥作用,充分体现中药的多成分、多靶点作用特点,从整体调节机体功能达到去除疾病的目的。
[1]陈万青,郑荣寿,张思维,等.2003-2007年中国癌症发病分析[J].中国肿瘤,2012,21(3):161-170.
[2]谭秀芳,李晓瑾,杜翠玲,等.药用植物阿魏概况及研究进展[J].中国民族民间医药杂志,2006,10(1):123-127.
[3]韩红英,李国玉,王金辉.阿魏化学成分和药理作用的研究现状[J].农垦医学,2010,12(3):76-83.
[4]赵保胜,桂海水,朱寅荻,等.阿魏化学成分、药理作用及毒性研究进展[J].中国实验方剂学杂志,2011,9(17):88-91.
[5]赵贝,李鸿儒,杜钢军,等.阿魏药酒抗肿瘤作用的初步探讨[J].河南大学学报:医学版,2013,32(1):24-27.
[6]杨仓良.毒药本草[M].北京:中国中药出版社,1993:54-58,986-993.
[7]刘嘉湘.蟾酥膏用于恶性肿瘤的临床观察(附332例随机双盲治疗对照观察)[J].中医杂志,1988,29(3):30.
[8]闵锋,徐福松,宁克勤,等.蟾酥水溶液治疗110例食管贲门癌临床观察[J].南京中医学院学报,1987,(1):13.
[9]卫蓉,王福贵.华蟾素静脉滴注治疗晚期恶性肿瘤60例临床观察[J].实用中西医结合杂志,1996,9(7):403.
[10]浙江省卫生厅.浙江省炮制规范[M].杭州:浙江科学技术出版社,2005:234.
[11]于春艳,李薇,刘玉和,等.白花蛇舌草体外对人肝癌多药耐药细胞Bel7402抗肿瘤活性的研究[J].北华大学学报,2004,5(3):221-223.
[12]钱韵旭,赵浩如,高展.白花蛇舌草提取物体外抗肿瘤活性[J].江苏药学与临床研究,2004,12(4):36.
[13]李瑞,赵浩如,林以宁.白花蛇舌草水溶性提取物的抗肿瘤作用和对化疗损伤的保护作用的研究[J].中国药学:英文版,2002,11(2):54-58.
[14]姜初明,龚黎燕.中肝合剂治疗中晚期原发性肝癌58例[J].中国中西医结合杂志,2005,29(9):848.
[15]苏永华,尹西才,谢觉民,等.二种蟾毒单体对SMMC-7721、BEL-7402人肝癌细胞生长的抑制作用[J].第二军医大学学报,2004,24(4):393-395.
[16]覃骊兰,邓家刚.中药白花蛇舌草化学成分及有效成分药理活性的研究进展[J].内蒙古中医药,2008,(4):42-45.
[17]李涛,杨立,王志平,等.建立小鼠膀胱肿瘤原位模型的优化方法[J].中国实验动物学报,2013,21(4):30-34.
Studying on the antitumor effect of Chinese herbal prescription of"Li Shi Ge Shi San"in vitro
XIA Fangbo1LI Xu2LIU Yamin1GUO Zhi1SHEN Shengnan1PAN Ruile1▲1.Institute of Medicinal Plant Development,Peking Union Medical College,Chinese Academy of Medical Science, Beijing100193,China;2.Lixuqin Physicians of Clinic Office of Bao′an District in Shenzhen City,Guangdong Province,Shenzhen518101,China
Objective To study the antitumor effect of Chinese herbal prescription of Li Shi Ge Shi San in vitro. Methods The water soluble and alcohol soluble ingredients in this prescription were extracted by using the water and alcohol.MTT colorimetric method was used to investigate the inhibitory effects of water extract and ethanol extracts from Li Shi Ge Shi San on hepatoma carcinoma cell(HpeG-2),gastric carcinoma cell(MKN-45)and ephageal cancer cells(EC-109).Results Two extracts of prescription significantly inhibited the cell survival rate of three cancer cells, and the ethanol extract had better effects than the water extract on anticarcinogenic action.The half inhibitory concentrations of ethanol extract on HpeG-2,MKN-45 and EC-109 were 622.89,173.41 and 210.17 μg/mL respectively.The maximal inhibition rate of ethanol extracts reached about 90%.Conclusion The extract of Li Shi Ge Shi San can inhibit the growth of HpeG-2,MKN-45 and EC-109 in vitro.
Li Shi Ge Shi San;Digestive system;In vitro;Antitumor
R285.5
A
1673-7210(2014)02(b)-0021-04
2013-10-28本文编辑:卫轲)
国家十二五“重大新药创制”科技重大专项课题(编号2012 ZX 0930 1002-001)。
▲通讯作者
