不同季节竹叶提取物对致病性大肠杆菌抑菌效果的研究
2014-03-15金兰梅伍清林乔楠楠董宏亮宋二宝
金兰梅,伍清林,乔楠楠,杨 彪,董宏亮,宋二宝
(金陵科技学院动物科学与技术学院,江苏 南京 210038)
竹叶在我国有悠久的利用历史,是一味传统的清热解毒药。近几年的研究表明,竹叶中含有大量的黄酮类化合物和生物活性多糖及其他有效成分,如酚酸类化合物、蒽醌类化合物、萜类内酯、特种氨基酸和活性肽、锰、锌、硒等物质。竹叶黄酮具有抗衰老、抗应激、抗疲劳、调节血脂、阻断亚硝化反应、增强免疫能力、抗菌和抑菌等作用[1]。有关竹叶提取物的抑菌作用已有不少研究报道,刘晓蓉等[2]研究了淡竹叶提取物的抑菌性能,结果表明,提取物对金黄色葡萄球菌的最低抑菌浓度为6.2%, 对溶血性链球菌、绿脓杆菌和大肠杆菌的最低抑菌浓度都是12.5%; 耐热性好; 抑菌pH值范围在4~9之间; 具有良好的防腐保鲜效果。邓骛远等[3]采用滤纸片法,测定毛竹叶与慈竹叶的抑菌作用,得知毛竹叶对枯草芽孢杆菌的抑制作用强,慈竹叶对大肠杆菌的抑制作用强,慈竹叶的抑菌效力强于毛竹叶。袁国强等[4]利用有机溶剂为提取介质获得竹叶提取液,对食源性细菌的生长有较好的抑制作用。贾桂云等[5]应用金镶玉竹叶的乙醇冰醋酸提取物对大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌进行抑菌试验,最小抑菌浓度是3.8%,提取物的pH值影响抑菌效果,在酸性、中性条件下抑菌作用比碱性条件强。金兰梅等[6]应用竹叶水提物对引起畜禽疾病的主要致病菌大肠杆菌和金黄色葡萄球菌进行抑菌试验,抑菌圈在14~19 mm之间,MIC在1.56~6.25 mg·mL-1之间,MBC在3.125~12.5 mg·mL-1之间。竹叶水提物对金黄色葡萄球菌抑菌活性强于对大肠杆菌的抑菌活性。众多试验证明,竹叶提取物对细菌有明显的抑制作用。
近年来,在畜禽生产中和兽医临床上大量使用抗生素,动物性产品药物残留超标现象不断出现,且呈日趋严重的态势。一方面对消费者构成危害,威胁人民身体健康;另一方面对动物性产品的正常出口贸易造成极大障碍。所以国家对一些抗生素和生长促进剂在动物生产中禁止使用,而把寻找无(低)药残、无(低)污染、能替代抗生素的促生长物质的研究作为重点[7]。因此,本试验采集南京幕府山周围春夏秋冬四季的孝顺竹竹叶,用水提法提取有效成分,并从患乳房炎奶牛的乳汁中和患大肠杆菌的病猪体内分离出致病性强对抗生素耐药的大肠杆菌,对其进行抑菌试验,比较各季节竹叶的抑菌效果。为在兽医临床上防治细菌性疾病,充分利用当地资源和进一步研制抑菌中草药产品提供科学依据。
1 材料与方法
1.1 试验材料
1.1.1 样本来源 竹叶:采集金陵科技学院幕府校区校园内孝顺竹,分别在2012年12月(冬季)、2013年3月(春季)、6月(夏季)、9月(秋季)、每月均在15日14:00-16:00采集。分别选取竹冠上、中、下部健康和已完成展叶的叶片,然后将采集的叶片均匀混合,并用自来水冲洗干净,放在通风处阴干3 d,后放入60 ℃的恒温箱内烘干,粉碎干燥保存。
致病菌性大肠杆菌:猪源从于南京地区某规模化猪场的患大肠杆菌病死猪的内脏分离获得,牛源从某规模化奶牛场患乳房炎奶牛乳汁中分离获得。
1.1.2 培养基、试剂、药敏纸片 营养琼脂(NA)、麦康凯琼脂(MAC),购于国药集团化学试剂有限公司,批号分别为20120115、20120525;营养肉汤、伊红美蓝琼脂(EMB)、三塘铁琼脂(TSI),肠杆菌科细菌生化编码鉴定管GYZ-15e、靛基质试剂、头孢噻肟(CTX)等16种抗生素药敏纸片均购于杭州天和微生物试剂有限公司。质控菌大肠埃希氏菌ATCC259购自中国兽医药品监察所。
1.1.3 主要仪器 SW-CJ-2F双人双面净化工作台(苏州净化设备有限公司03091BA)、隔水式电热恒温培养箱(上海跃进医疗器械厂2080850)、电热恒温培养箱(南京实验仪器厂DNS-9052BS-III)、立式压力蒸汽灭菌箱(YXG-LS-75SIDI)、恒温摇床(KYCC-100)、H-4数显恒温水浴锅(江苏省金坛市荣华仪器制造有限公司生产A01002923)、XA-1 型粉碎机(江苏姜堰市分析仪器厂)、显微镜等及实验室常规仪器。
1.1.4 试验动物 普通级小白鼠,雌雄不限,体重在20~22 g之间,购于南京盛民科研实验动物场。
1.2 试验方法
1.2.1 致病性大肠杆菌准备 1) 大肠杆菌分离鉴定。猪源大肠杆菌分离:剖检病猪,无菌采集心脏、肝脏和脾等病变组织涂于MAC培养基上,37 ℃培养24 h。牛源大肠杆菌分离:无菌采集患乳房炎奶牛的乳汁涂于MAC培养基上,37 ℃培养24 h。
分别取MAC培养基上典型红色菌落,涂片,革兰氏染色,镜检,初步区分革兰氏阳性和阴性,然后做肠杆菌科细菌生化鉴定,并转接种于CTX和TSI培养基,观察反应结果,确认大肠杆菌。
2) 致病性试验。将生化反应已鉴定为大肠杆菌的菌株接种于普通肉汤, 37 ℃培养18 h。经细菌计数用生理盐水稀释成1.0×107CFU/mL的菌液,0.5 mL·只-1分别腹腔注射小白鼠,每株做3个重复。对照组小白鼠腹腔注射灭菌生理盐水0.5 mL·只-1。观察小白鼠的活动及发病死亡情况,对发病死亡小白鼠立即进行剖检,观察病变,取其寎料涂片、染色、镜检,并接种于MAC培养基分离培养。未发病的继续观察至1周。
3) 抗生素药敏试验与耐药菌株的筛选。采用WHO 推荐的Kirby-Bauer法,取头孢噻肟(CTX)等16种常用的抗生素药敏纸片对致病性强的大肠杆菌(猪源、牛源各10株)进行药敏试验。依据NCCLS有关标准,每次测定均以质控菌为对照,只有当质控菌株的抑菌圈直径在允许范围内测试菌株结果才有效。判定标准参照美国国家临床实验室标准化委员会(NCCLS)M100-S15[8]和文献[9],以敏感、中介、耐药3种形式对抑菌圈大小作出判定。
挑取对16种抗生素耐药达8种以上的菌株,将其接种于5 mL LB培养液中,于37 ℃培养24 h,再用LB溶液将细菌悬液稀释至1.0×107CFU/mL,4 ℃冰箱保存、备用。
1.2.2 竹叶有效成分提取 采用水提法,分别称取不同季节的干燥竹叶各50 g,加入10倍量水浸泡1.5 h,装入圆底烧瓶中,放在恒温电热套上煎煮,第一次煎以沸腾开始计算100 ℃煎煮50 min,用8层纱布过滤,滤渣再加100 mL水,第二次煎以70 ℃煎煮30 min。合并两次滤液,浓缩至50 mL,得浓缩的浓度为1 g·mL-1,调整pH值至7.0~7.2。分别装瓶,备用。
将竹叶的提取液加入无水乙醇至醇含量达到70%(乙醇/混合液=70%),4 ℃静置24 h,1 500 r·min-1离心5 min后纱布过滤,所剩溶液加蒸馏水定容至相当于生药1 g·mL-1。灌注封瓶后流通蒸汽消毒灭菌30 min,4 ℃冰箱保存,备用。
1.2.3 竹叶提取物对大肠杆菌药敏试验 采用琼脂打洞法进行药敏试验。将待检菌液吸取50 uL注入NA培养基中,用玻璃棒充分涂抹均匀,然后用外径为6 mm 的打孔器在培养基上等距离打孔,吸取融化的营养琼脂液补底。每孔加1 g·mL-1竹叶的提取液50 uL,在4 ℃冰箱内放置30 min 1 h,然后37 ℃恒温培养24 h,测量抑菌圈的直径。 每个样本做3个重复,以3次平均值为抑菌圈直径。抑菌圈直径≥20 mm为极敏,15~20 mm为高敏,10~15 mm为中敏,≤10 mm为低敏[6]。
1.2.4 最小抑菌浓度(MIC)和最小杀菌浓度(MBC)的测定 采用试管二倍稀释法[6],取灭菌试管11支,每管先加入无菌肉汤1 mL,然后第一管中加入灭菌的受试竹叶提取物1 mL,混匀后取出1 mL放入第2管中,依次类推。直到第9管取出1 mL弃去,配成含竹叶提取物分别为1∶2、1∶4、1∶8、1∶16等各种浓度的液体。第10管不加药物作为对照,以便观察培养基是否适合于细菌生长。第11管加受试竹叶提取物1 mL,混匀取出1 mL弃去,不接种细菌,以便观察受试中药是否受污染。
取0.05 mL菌液分别加入上述1~10管中,混匀后放入37 ℃培养箱中培养18~24 h,观察结果。若肉汤混浊,表示细菌生长;若肉汤完全清亮,表示无细菌生长。观察无菌生长管所含最低药物浓度即为最小抑菌浓度(MIC)。
吸取0.1 mL培养物,移种于不含药的普通营养琼脂上,涂抹均匀,置37 ℃培养24 h。观察有无细菌生长,以无细菌生长的药物最低浓度作为该药物的最小杀菌浓度(MBC)。
2 结果与分析
2.1 抗生素药敏试验与耐药菌株的筛选
选择致病性强的猪源和牛源的大肠杆菌各10株,应用头孢噻肟(CTX)、头孢呋辛(CXM)、头孢他啶(CAZ)、头孢吡肟(FEP)、链霉素(STR)、庆大霉素(CN)、强力霉素(DO)、阿米卡星(AK)、环丙沙星(CIP)、氟罗沙星(FO)、左氟沙星(LEV)、恩诺沙星(ENR)、洛美沙星(LOM)、四环素(TE)、氨苄西林(APM)、复方新诺明(SXT)等16种抗生素药敏纸片进行药敏试验。结果得知,20株大肠杆菌对抗生素均有不同程度的耐药,最高的为13耐,最低的为5耐。其中猪源9号菌株耐13种抗生素,2号、4号、7号菌株分别为9耐和11耐;牛源12号、14号、15号、20号菌株均为11耐(表1)。
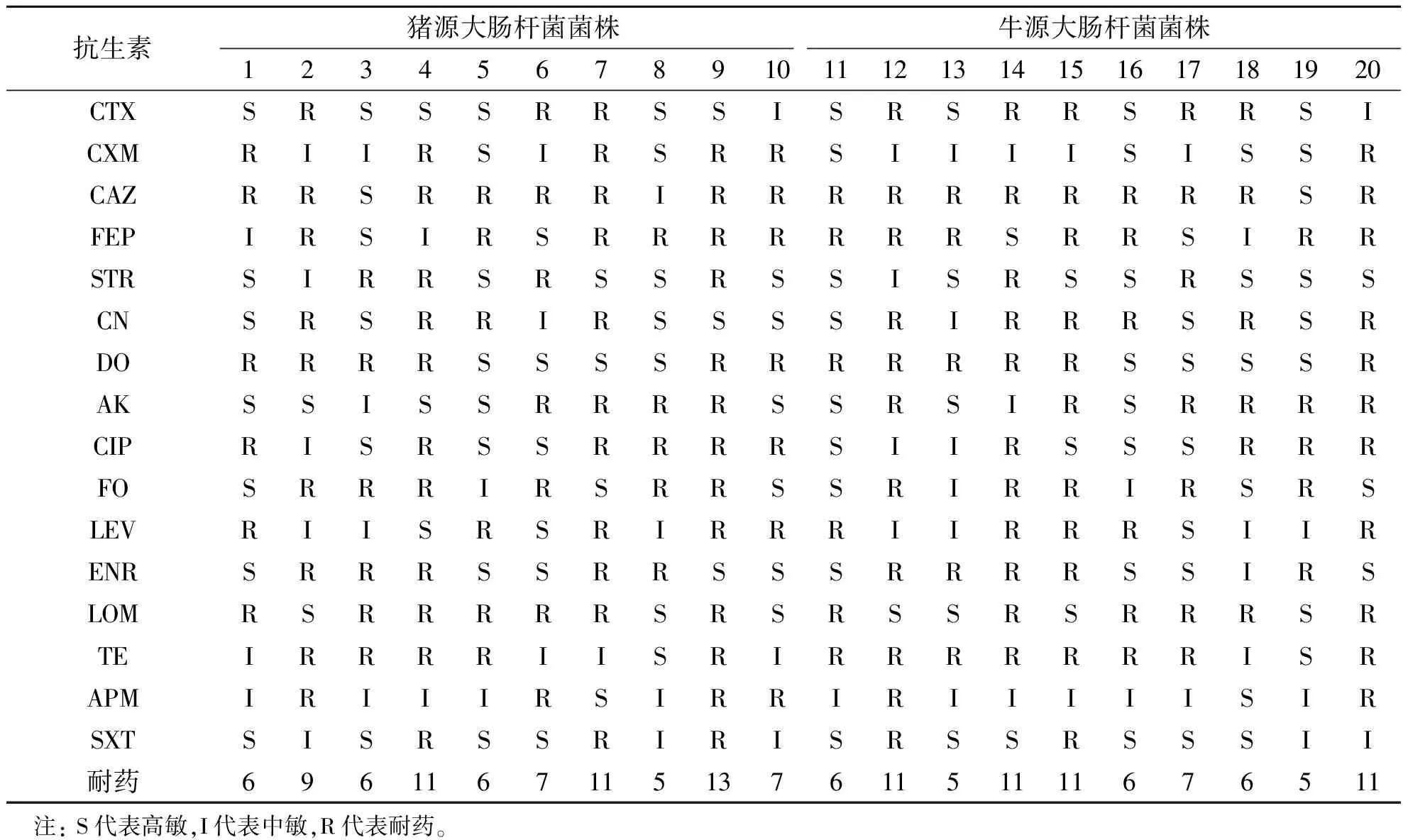
表1 抗生素对大肠杆菌药敏试验分析Table 1 The test results of antibiotic drug susceptibility to Escherichia coli
2.2 竹叶提取物药敏试验
选择对9种以上抗生素产生耐药性的菌株(2、4、7、9、12、12、14、15、20号菌株)进行竹叶提取物的药敏试验。
由表2可知,竹叶提取物对抗生素耐药的大肠杆菌有较明显的抑制作用。结合表1可以看出,大肠杆菌对抗生素产生耐药,对竹叶提取物依然敏感。不同季节采集的竹叶提取物对不同源不同株的大肠杆菌抑菌效果不同,对同源不同株的大肠杆菌抑菌效果也不同。冬季采集的竹叶提取物抑菌效果最佳,对受试菌株均在高敏以上,其中7、15和9号菌株对CTX 等16种抗生素表现11耐和13耐,对冬季竹叶提取液极敏;秋季抑菌效果相对较差,抑菌圈在低敏和中敏之间。一年四季抑菌效果比较是冬季>春季>夏季>秋季。说明不同季节采集的样品抑菌效果不同。
2.3 竹叶提取物最小抑菌浓度(MIC)
不同季节采集的竹叶提取物对8株大肠杆菌均有不同程度的抑制作用。其中春、夏季采集的竹叶提取物对猪源、牛源大肠杆菌的MIC均在3.125~6.250 mg·mL-1之间,秋季MIC在6.25~12.50 mg·mL-1之间,冬季的MIC在1.560~3.125 mg·mL-1之间。说明冬季竹叶提取物对大肠杆菌的抑制作用较好,秋季较差(表3)。
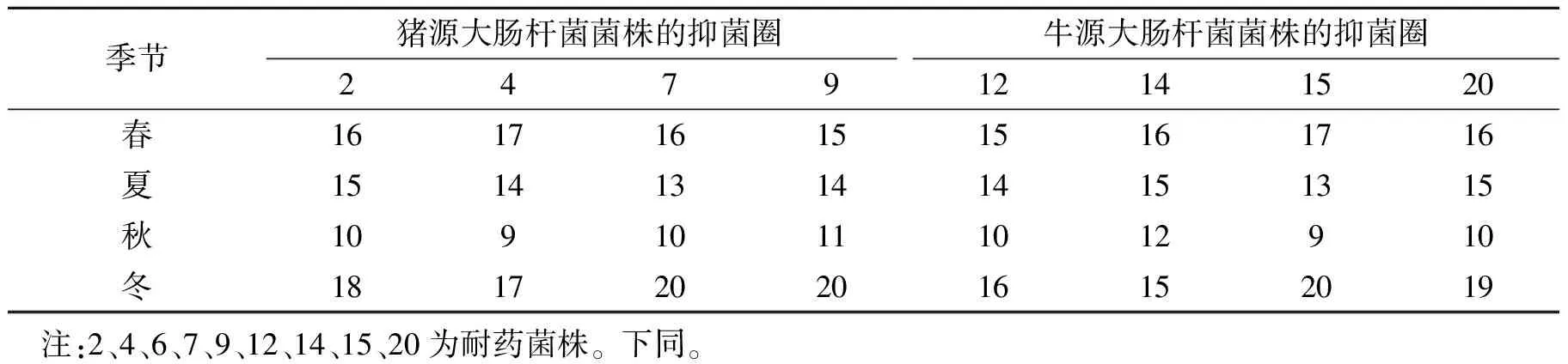
表2 不同季节竹叶提取物对大肠杆菌的药敏试验分析Table 2 The test results of the susceptibility of bamboo leaf extract in different seasons to Escherichia coli mm
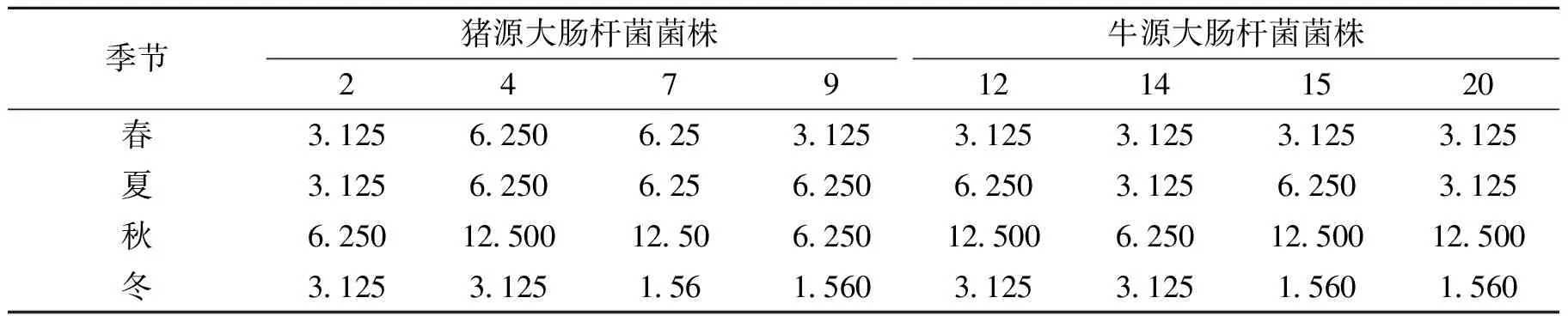
表3 不同季节竹叶提取物对大肠杆菌的最小抑菌浓度(MIC)Table 3 The minimum inhibitory concentration of bamboo leaf extract in different seasons to Escherichia coli mg·mL-1
2.4 竹叶提取物最小杀菌浓度(MBC)
由表5可知,不同季节采集的竹叶提取物对不同株的细菌均有不同程度的杀灭作用。春、夏季竹叶提取物对大肠杆菌的MBC均6.25~12.50 mg·mL-1之间,秋季MBC在12.5~25 mg·mL-1之间,冬季的在3.125~6.250 mg·mL-1之间。最小杀菌浓度均高于最小抑菌浓度的1个浓度梯度。说明不同季节采集的竹叶提取物抑菌效果较为稳定。
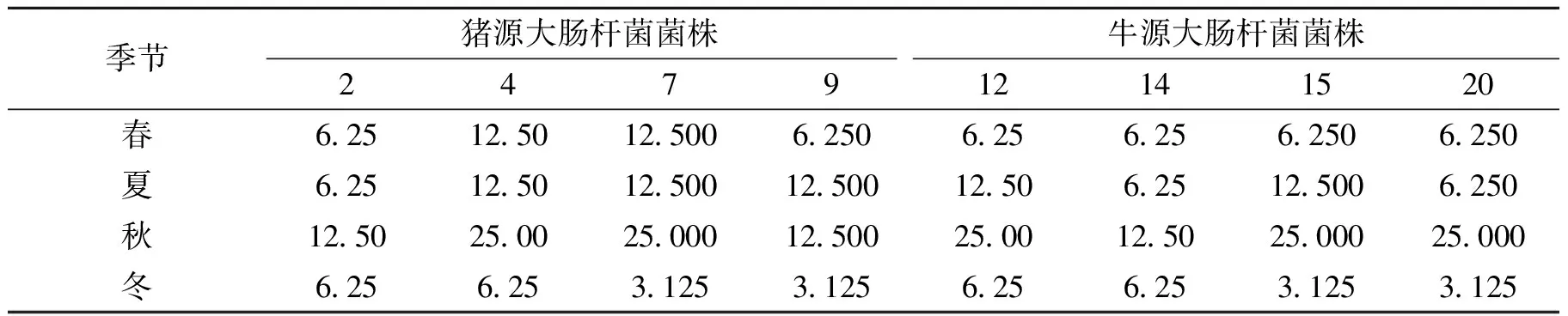
表4 不同季节竹叶提取物对大肠杆菌的最小杀菌浓度(MBC)Table 4 The minimum bactericidal concentration of bamboo leaf extract in different seasons to Escherichia coli mg·mL-1
3 结论与讨论
1) 本试验通过常规的细菌分离培养方法,从病猪心、肝等组织和患乳房炎奶牛的乳汁中分离得到大肠杆菌,通过抗生素药敏试验发现20株大肠杆菌对16种抗生素均有不同程度的耐药,最高的13耐,最低的5耐。采用中药传统的煎煮方法提取竹叶中的有效成分,然后应用竹叶提取物对抗生素耐药的大肠杆菌进行药敏试验。试验结果说明,大肠杆菌对抗生素产生耐药,对竹叶提取物依然敏感。试验同时证明,竹叶提取物药敏试验、最小抑菌浓度与最小杀菌浓度反应的结果是一致的,不同源的大肠杆菌菌株对不同季节采集的竹叶提取液有着不同程度的敏感性。
2) 据报道[10-12]竹叶中含有黄酮类化合物和生物活性成分,随竹种、季节的变化而变化。本次试验在研究竹叶抑菌效果的基础上比较不同季节其提取物抑菌效果的差异.由表2、表3、表4可知,不同季节采集的竹叶提取物对不同源的大肠杆菌抑菌效果不同,春季抑菌圈在15~17 mm之间,MIC在3.125~6.250 mg·mL-1之间,MBC在6.25~12.50 mg·mL-1之间;夏季抑菌圈在13~15 mm之间;MIC在3.125~6.250 mg·mL-1之间,MBC在6.25~12.50 mg·mL-1之间;秋季抑菌圈在9~12 mm之间;MIC在6.25~12.50 mg·mL-1之间,MBC在12.5~25.0 mg·mL-1;冬季抑菌圈在15~20 mm之间,MIC在1.560~3.125 mg·mL-1之间,MBC在3.125~6.250 mg·mL-1。本试验结果证实了抑菌作用强弱与竹叶中含黄酮类化合物和生物活性成分随竹种、季节的变化有关。本试验采用的竹种是孝顺竹,采用定点、定株、定时采样,不同季节抑菌效果强弱,顺序为冬季>春季>夏季>秋季。其他种类竹叶抑菌效果、季节的变化的强弱有待于进一步研究。
3) 竹子的化学组成中不含有毒物质,符合食品对原料和添加剂化学成分的严格要求,2002年国家卫生部已将 “淡竹叶”列入既是食品又是药品的保健食品原料名单[13]。因此开发竹叶作为畜禽饲料添加剂,既可以防治大肠杆菌病,又不会引起畜禽中毒,更重要的是减少细菌耐药性的产生,减少畜禽体内抗生素的残留,为人类提供绿色畜产品,保障人类身体健康。畜禽养殖户也可以利用当地的资源在适当时机采集竹叶煎煮后让其动物自由饮用,预防大肠杆菌病的发生。
[1] 杨英,李英华.竹叶黄酮提取物的抑菌活性研究[J].广州化工,2011,39(16):66-68
[2] 刘晓蓉.淡竹叶提取物抑菌防腐作用的研究[J].广东轻工职业技术学院学报,2008,7(2):20-23
[3] 邓骛远.宜宾竹叶水提液的抑菌作用研究[J].安徽农业科学,2012,40(26):13195-13196,13203
[4] 袁国强,李云峰,欧杰,等.竹叶提取物对食源性细菌抑制效应的研究[J].食品安全质量检测学报,2013(1):257-261
[5] 贾桂云,邹润英,郭飞燕.竹叶提取物抑菌效果研究[J].海南师范大学学报:自然科学版,2010,23(4):420-422
[6] 金兰梅,伍清林,陆小松,等.竹叶等植物提取物对畜禽致病菌抑菌效果的研究[J].金陵科技学院学报,2013,29(4):80-84
[7] 金兰梅,伍清林,马玉,等.四种植物对大肠杆菌抑菌试验研究[J].家畜生态学报,2012,33(6):72-77
[8] Kh an A,Dass C,Ramam urthy T,et al.Antibiotic Resistance,Virulence Gene,and Molecular Profiles of Shiga Toxin ProducingEscherichiacoliIsolates from Diverse Sources in Calcutta[J].J Cl in Microbiol,2002,40(6):2009-2015
[9] 伍清林,金兰梅,周正凯,等.动物园珍禽舍内大肠杆菌的分离鉴定与耐药性的试验[J].中国兽医杂志,2011,47(9):24-27
[10] 苏春花,刘国华,王福升,等.箬竹叶片活性成分含量的季节变化[J].应用生态学报,2011,22(9):2471-2476
[11] 吕兆林,任美玲,欧阳呓林,等.竹叶黄酮化合物季节变化规律[J].北京林业大学学报,2011,33(4):81-84
[12] 潘佳佳,叶生月,丁东栋,等.4 种竹子竹叶黄酮质量分数及抗氧化活性的季节变化[J].浙江农林大学学报,2014,31(2):280-284
[13] 黄占旺,邹双双,熊水波.毛竹叶提取物抑菌作用的初步研究[J].江西农业大学学报,2005,27(6):960-963
