评估颈内动脉颅内段血管狭窄三种影像学方法的对比分析
2014-03-15李星亮杨笑一张玉强王昕光李二生
李星亮, 杨笑一, 张玉强, 郭 宇, 王昕光, 李二生
脑血管疾病是危害人类健康的重要杀手之一。随着人口老龄化,饮食结构改变,高血压、高血脂及糖尿病等患病率的增加等因素影响,目前脑血管疾病的发病率逐年增高。在发达国家的白种人,颅外段血管狭窄较多,而在我国等发展中国家及亚洲人种颅内血管狭窄较多[1-3]。颅内外大动脉粥样硬化性狭窄或闭塞,是缺血性脑卒中发生的重要原因,约50%脑卒中发生于颈内动脉供血区[2]。本研究主要探讨64排CTA及MRA在诊断颈内动脉颅内段血管狭窄程度中的临床应用价值。
1 材料与方法
1.1 临床资料
随机选择2011年1月—2013年2月在我院临床拟诊为颈内动脉系统短暂性脑缺血发作(transient ischemic attack,TIA)或缺血性脑卒中并同期行64排CTA、MRA、DSA三种检查的60例患者,男36例,女24例,年龄35~88岁,平均(53±18)岁。临床表现为不同程度的偏瘫、偏盲、偏身感觉障碍、失语等颈内动脉供血区功能障碍症状。
1.2 方法
1.2.1 CTA 检查 采用 PHILIPSBrilliance 64排螺旋CT机。先常规以主动脉弓下缘为基准作头颈部定位扫描,然后采用Medrad CT型双筒高压注射器经肘静脉以 4.0 ~ 4.5 ml/s速率团注 60 ~ 80 ml(按体重1.2 ml/kg计算)非离子对比剂碘佛醇320,而后以相同速率注入30~40 ml生理盐水。扫描范围自主动脉弓下缘至颅顶,电压120 kV,管电流499 mAs,层厚 0.9 mm,层间隔 0.45 mm,转速 0.5 s/r,螺距0.89,准直64×0.625。使用智能阈值触发技术,兴趣区置于降主动脉,阈值为120 HU。扫描结束后将图像传到EBW4.5工作站进行图像后处理。图像重建方式主要采用曲面重建(CPR)、最大密度投影(MIP)和容积再现(VR)等技术,结合扫描原始图像综合分析。
1.2.2 MRA 检查 采用 PHILIPSAchieva 1.5T HP MRI扫描机。选用头部正交线圈,采用3D-TOF法行MRA成像。首先获得横断面原始图像,而后采用MIP和VR等方法行血管成像。
1.2.3 DSA 检查 采用 PHILIPSAllura Xper FD 血管造影机。选择对比剂为碘佛醇320,电压80 kV,电流 45 ~ 54 mA,注射速度为 4.0 ~ 4.5 ml/s。 若发现血管病变,调整方位及角度,目的是获得可以明确诊断血管病变方位的图像。
1.2.4 图像分析 CTA、MRA、DSA 图像分别由 2名经验丰富的影像学医师行各自单独回顾性阅片,有争议时2名医师经过商讨最后达成共识[4]。通过回顾性阅片,确定动脉有无狭窄,明确狭窄部位、程度及狭窄原因。本研究仅对颈内动脉颅内段血管病变进行分析、研究。颈内动脉颅内段在血管造影影像上分为5段,即C1段,又称后膝段或终段;C2段,又称交叉池段或床突上段;C3段,又称前膝段或虹吸弯;C4段,又称海绵窦段;C5段,又称颈动脉管段、岩骨段或神经节段。根据血管走行于不同的解剖部位,本研究按C1~C3段、C4段、C5段分为3组。颈内动脉颅内段狭窄分级标准采用北美症状性颈动脉内膜切除术 (North American Symptomatic Carotid Endarterectomy Trial,NASCET)分级法:正常0%;轻度狭窄 ≤ 29%;中度狭窄30% ~69%;重度狭窄 ≥70%;闭塞100%。狭窄率 =[1-(最狭窄处直径/狭窄远端正常直径)]×100%[5]。以DSA为“金标准”,分别计算CTA和MRA对颈内动脉颅内段C1~C3段、C4段、C5段血管病变狭窄程度评估的灵敏度、特异度、阳性预测值、阴性预测值、准确率等指标。
1.4 统计学处理
采用SPSS17.0软件进行统计学分析,进行CTA及MRA影像诊断标准效能的χ2检验及与DSA吻合度 Kappa(κ)检验,取双侧精确概率,P < 0.05 为差异有统计学意义。根据文献报道κ<0.4吻合度一般,0.4 ~ < 0.75 吻合度较好,≥ 0.75 吻合度良好[6]。
2 结果
2.1 三种方法检查结果比较
以DSA为 “金标准”,本研究60例患者共有360段。C1~C3段共有120段,正常53段,轻度狭窄50段,中度狭窄8段,重度狭窄5段,闭塞4段。C4段共有120段,正常64段,轻度狭窄35段,中度狭窄10段,重度狭窄7段,闭塞4段。C5段共有120段,正常67段,轻度狭窄34段,中度狭窄12段,重度狭窄3段,闭塞4段。CTA、MRA检查的诊断指标见表1。以DSA为 “金标准”,64排 CTA、MRA对颈内动脉颅内段血管病变狭窄程度评估有着较高的诊断准确率及吻合度,见图1。
2.2 CTA与MRA检查结果比较
从表1可见,CTA在评估颈内动脉颅内段血管狭窄程度准确率方面优于MRA,差异有统计学意义(P < 0.05), 尤其是对颈内动脉 C4、C5 段狭窄程度评估及狭窄原因,有着较高的诊断价值。

表1 CTA、MRA对颈内动脉颅内段的相关诊断指标
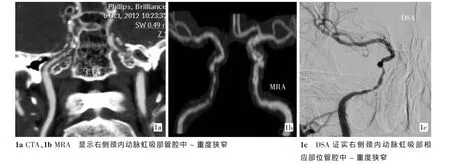
图1 64排CTA和MRA对颈内动脉颅内段血管病变狭窄程度的诊断准确率及与DSA的吻合度
3 讨论
颈内动脉颅内段血管管壁由于动脉粥样硬化、钙化、颅骨变异等原因可能会引起血管不同程度狭窄,甚至闭塞,可能影响狭窄动脉远端分支供血区的血供,严重者可导致供血区脑组织发生缺血性梗死。因此,尽早明确血管狭窄原因及管腔狭窄程度,积极采取相应的预防及治疗措施干预,在一定程度上将会改善供血区血供,对于降低脑血管病发生有着重要意义[2-3,7-8]。
临床上,颈内动脉颅内段血管病变主要采用的影像学检查方法有 CTA、MRA、CE MRA、DSA、脑灌注等[9-11]。DSA仍是目前公认的判断血管是否狭窄及狭窄程度的“金标准”,可以动态观察对比剂在血管内通过的过程,通过后处理技术获得清晰的图像,可准确判断血管狭窄程度,但因其是有创检查方法,对管壁及其周围结构判断不清楚,价格较为昂贵,耗时较长,而且有一定的风险,如操作过程中会引起血管痉挛、斑块脱落等危险,在临床应用具有一定的局限性。
CTA作为一种无创性的血管成像检查技术,特别是随着64排CT的曲面重建 (CPR)、MIP和VR等后处理技术在临床的广泛应用,使CTA临床应用价值进一步得到了提升[12]。利用64排CT数据具有多向同向性特点,可以从各个方向清晰显示动脉血管管壁内外结构,以及管壁的斑块、钙化及周围结构情况,因此可以很好地评价血管狭窄程度及狭窄原因[13-16]。本研究CTA诊断正确324处,误诊36处。误诊36处中C1~C3段15处,C4段12处,C5段9处。我们分析原因有:①管壁广泛钙化或周围骨骼可影响管腔狭窄程度的判断。②当管腔重度狭窄时,对比剂通过血管较少,原始图像及重建后图像管腔狭窄程度比实际夸大。
MRA作为一种无创性血管成像技术,已经广泛应用于临床,分为 MRA 及 CE-MRA[13]。 MRA 利用流动血液MR信号与周围静态组织MR信号的差异建立图像对比度,而无需注射对比剂。常用的方法是时间飞跃法(TOF)和相位对比法(PC),以前者最为常用。CE-MRA即高压注射器注入对比剂(钆制剂)成像。临床上评价颅内血管相对于CE-MRA来说较多选用MRA,原因为:①CE-MRA需要掌握准确扫描条件,才能避免血管“污染”,获得较为清晰的图像;②CE-MRA费用昂贵,耗时较长;③ 颅内段血管MRA也可以获得较为清晰的图像。因此本研究选用MRA。本研究MRA诊断正确311处,误诊49处。误诊49处中C1~C3段20处,C4段16处,C5段13处。分析原因有:① 血管流速快慢及流动方式如层流、涡流等可能会造成信号的缺失,狭窄程度被夸大。②在显示钙化斑块方面也存在一定局限性。③无法对血管周围结构进行精确判断。
现在,国内外对评价头颈部血管病变的影像学方法研究较多,但是仅对颈内动脉颅内段病变的影像学研究较少。因为颈内动脉颅内段特殊走行路径,周围骨性结构多,再加上血流方向、流速等不同,选择某一种检查技术尚难完整评价血管本身病变性质及其与周围结构关系,DSA虽有一定的局限性,但是目前仍被认为是诊断血管疾病的金标准。以DSA为“金标准”,采用CTA、MRA检查评价颈内动脉颅内段病变研究更少。本研究得出CTA对颈内动脉颅内段血管狭窄程度评估及狭窄原因诊断的准确率优于 MRA,与国内外文献报道一致[7,17]。
本研究发现64排CTA在判断颈内动脉颅内段狭窄程度及狭窄原因方面相对于MRA及DSA有着独特的优势。64排CTA不仅可以判断斑块的性质及管腔狭窄程度,而且对于管腔外结构也可以明确显示。血管狭窄有多种原因,多为斑块形成的粥样硬化性狭窄,但也可以是由于血管炎性狭窄、血管变异、周围骨质结构异常造成骨性管道狭窄或周围占位性病变压迫所造成。对于上述各种原因造成的血管狭窄原因判定,只有64排CTA可以通过一次注药后对原始数据进行多方位多种重建技术才能完整准确判断,而MRA需通过多方位分次扫描,耗时长,DSA对周围结构无法诊断,对管腔或管壁病变观察需多次注射对比剂、多方位投照才能得到比较满意结果。
综上所述,以DSA为标准,64排CTA及MRA对颈内动脉颅内段血管狭窄程度评估及狭窄原因诊断有着较高的准确率及吻合度。与MRA相比,64排CTA在诊断颈内动脉狭窄和狭窄原因方面更胜一筹,可作为首选检查方法,有着较高的临床应用价值。
[1] Wong GS, Huang YN, Gao S, et al.Intracranial stenosis in Chinese patients with acute stroke [J].Neurology, 1998, 50:812-813.
[2] 李凡东,易玉海.颈动脉狭窄的介入治疗 [J].介入放射学杂志,2007,16:785-788.
[3] 陈星宇,李慎茂.颈动脉支架治疗 [J].介入放射学杂志,2007, 16: 563-567.
[4] 牛秀兰,郝玉梅,王忠民.头颈部CTA在诊断脑血管性病变的诊断价值[J].疾病监测与控制, 2011, 05: 271-272.
[5] Barnett HJ,Taylor DW,Eliasziw M,et al.Benefit of carotid endarterectomy in patients with symptomatic moderate or severe stenosis.North American Symptomatic Carotid Endarterectomy Trial Collaborators[J].N Engl JMed, 1998, 339: 1415-1425.
[6] Salm LP,Schuijf JD,de Roos A,et al.Global and regional left ventricular function assessment with 16-detector row CT:comparison with echocardiography and cardiovascular magnetic resonance[J].Eur JEchocardiogr, 2006, 7: 308-314.
[7] 李明珠,徐 敏,奚克敏.64-SCTA、MRA、DSA诊断脑血管狭窄对比研究[J].中国医疗设备, 2009, 24: 138-140.
[8] 黄银平,高德宏,胡 琛,等.颅颈部颈内动脉狭窄的CE MRA 与 DSA 对比研究[J].广东医学,2009,30:606-608.
[9] 游梦星,虞希祥,林永胜,等.三维CT血管造影与平板DSA对颅内动脉瘤诊断价值的对比分析 [J].介入放射学杂志,2011, 20: 676-680.
[10]汪 璇,李明华,方 淳,等.颅颈部动脉狭窄的增强 MRA与 DSA 比较研究[J].介入放射学杂志,2005,14:468-471.
[11]王铭义,王 峰.脑灌注成像在颈动脉狭窄介入治疗中的应用[J].介入放射学杂志, 2011, 20: 915-919.
[12]陈洪亮,张君海,林 川,等.64层螺旋CT血管探针技术在颈部动脉狭窄评价中的应用 [J].实用医学影像杂志,2011,12: 275-277.
[13] Bleeker L, Marquering HA, van den Berg R, et al.Semiautomatic quantitative measurements of intracranial internal carotid artery stenosis and calcification using CT angiography[J].Neuroradiology, 2012, 54: 919-927.
[14] Héman LM, Jongen LM, van der Worp HB, et al.Incidental intracranial aneurysms in patients with internal carotid artery stenosis: a CT angiography study and a metaanalysis[J].Stroke,2009,40:1341-1346.
[15]陈文华,黄庆娟,李麟荪.多层螺旋CT血管造影的临床应用[J].实用放射学杂志, 2005, 21: 1216-1220.
[16]王 媛,贾建平,孙永馨.CT血管造影术在动脉粥样硬化性脑血管病中应用的研究进展 [J].中国脑血管病杂志,2013,10: 99-103.
[17] Anzidei M,Napoli A,Zaccagna F,et al.Diagnostic accuracy of colour Doppler ultrasonography,CT angiography and blood-poolenhanced Mr angiography in assessing carotid stenosis: a comparative study with DSA in 170 patients [J].Radiol Med,2012,117: 54-71.
