利用RIP-Chip筛选结合多聚胞嘧啶结合蛋白2的microRNAs
2014-03-15林细华彭小忠
韩 为,林细华,阴 彬,彭小忠
(中国医学科学院基础医学研究所北京协和医学院基础学院生物化学与分子生物学系医学分子生物学国家重点实验室,北京100005)
多聚胞嘧啶结合蛋白2(PCBP2)是对多聚胞嘧啶[Poly(C)]具有高度亲和性的RNA 结合蛋白,在胞核和胞质中穿梭表达[1]。通过对核心识别位点“ACCC”和“CCCU”的特异性结合[2],PCBP2 参与到靶mRNA的稳定性,选择性剪接和翻译调节[3]。近年来,有研究人员注意到microRNA(miRNA)也可以直接结合PCBP2 蛋白,通过“诱骗”机制干扰PCBP2 对靶mRNA的调控作用[4]。PCBP2 还可以与Dicer 酶相互作用,调节miRNA 生成[5]。本实验室在前期工作中发现PCBP2 在人神经胶质瘤细胞中高表达。本研究通过核糖核蛋白免疫沉淀-芯片技术(RIP-Chip)在人正常神经胶质细胞(HA)和神经胶质瘤细胞(T98G 和U87MG)中筛选与(PCBP2)相互作用的miRNA。
1 材料与方法
1.1 材料
HA 细胞和AM 培养基(ScienCell 公司),T98G和U87MG 细胞(美国模式培养物集存库ATCC),MEM/EBSS 和胎牛血清(Gibco 公司),β-actin 抗体(Sigma 公司),正常兔IgG、兔抗人PCBP2 抗体和RIP-Assay Kit for microRNA(MBL 公司),辣根过氧化物酶标记的羊抗兔二抗购自(北京中杉金桥生物技术有限公司),ECL Western blot 发光检测试剂、蛋白酶抑制剂、糖原和Protein A Agarose 琼脂糖(Roche 公司),RNA 酶抑制剂和DTT[宝生物工程(大连)有限公司]。
1.2 细胞培养
人正常星形胶质细胞HA 培养于含2%胎牛血清的AM 培养基中,人神经胶质瘤细胞T98G 和U87MG 培养于含10%胎牛血清的MEM 培养基中。所有细胞置于37 ℃、5% CO2的培养箱中培养,按1∶2细胞每2 ~3 d 传代1 次。
1.3 Western blot 检测
收集3 种细胞系或这3 种细胞的RIP 蛋白样品,98 ℃ 10 min 变性后- 20 ℃保存。样品经10% SDS-PAGE 凝胶电泳分离约2 h 后,半干转法转移至硝酸纤维素膜上,5%高蛋白脱脂奶粉封闭30 min。按相应比例封闭一抗,室温摇床孵育3 h,TBST 漂洗10 min ×3 次,与辣根过氧化物酶标记的二抗室温摇床孵育1.5 h,TBST 漂洗10 min ×3次,ECL 显色。
1.4 RIP 实验
收集2×107个细胞,应用MBL 公司的RIP-Assay Kit for microRNA 制备核糖核蛋白复合物,加入适量蛋白酶抑制剂、DTT 和RNA 酶抑制剂,被Protein A珠子预清除1 h 后,上清均分两部分,分别和过夜包被兔IgG 和PCBP2 抗体的Protein A 珠子4 ℃摇床孵育3 h。加入DTT 的漂洗液洗珠子4 次,取1/10 的珠子加适量上样缓冲液,98 ℃10 min 变性后作为RIP蛋白样品-20 ℃保存;剩余珠子按照试剂盒“两步法”,糖原辅助醇沉RNA 过夜,70%乙醇洗沉淀2 次,10 μL DEPC 水溶解RNA,-80 ℃保存。
1.5 芯片杂交
样品芯片杂交和数据分析均委托上海欧易生物医学科技有限公司完成,所用芯片为Affymetrix miRNA 3.0 芯片。RNA 利用NanoDrop ND-2100 (Thermo Scientific 公司)定量并经Agilent 2100 (Agilent Technologies 公司)检测RNA 完整性。RNA 质检合格后,样本的标记、芯片的杂交以及洗脱参照芯片标准流程。
1.6 数据分析
实验组为HA、T98G 和U87MG 细胞中PCBP2抗体RIP 的样品;对照组为这3 种细胞中兔IgG 的RIP 样品。差异miRNA 利用t 检验的P 值和倍数变化值进行筛选,筛选的标准为上调倍数变化值>4且P<0.05。
2 结果
2.1 检测PCBP2 蛋白在3 种细胞内的表达
应用MBL 公司的RIP 级PCBP2 抗体在HA、T98G 和U87MG 细胞中通过Western blot 检测PCBP2 蛋白的表达,β-actin 作为上样内参。结果显示,该抗体可以特异地与细胞内PCBP2 两种剪接形式结合,并且PCBP2在神经胶质瘤细胞中的总体表达水平高于正常星形胶质细胞,与实验室前期结果一致(图1)[6]。
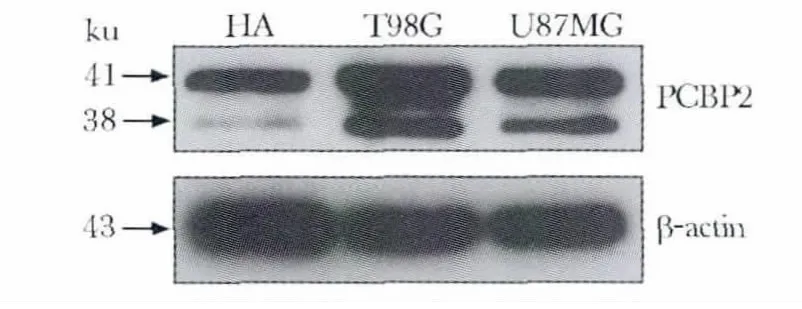
图1 PCBP2 蛋白在人星形胶质细胞(HA)和神经胶质瘤细胞系(T98G 和U87MG)中的表达水平Fig 1 Expression of PCBP2 protein levels in human astrocyte (HA)and glioma cell lines(T98G,U87MG)
2.2 检测PCBP2 抗体RIP 实验的质量
利用PCBP2 抗体在上述3 种细胞中进行RIP实验,正常兔IgG 作为实验的阴性对照,分别收集实验组和对照组的蛋白、RNA 样品进行质量检测。Western blot 结果显示:与兔IgG 相比,通过PCBP2抗体的RIP 实验可以高效稳定地富集到目的蛋白(图2A);利用NanoDrop ND-2100 对RNA 定量分析:HA(IgG)0.5 μg,HA(PCBP2)0.3 μg,U87MG(IgG)1 μg,U87MG(PCBP2)1 μg,T98G(IgG)1 μg,T98G(PCBP2)3 μg;利用Agilent 2100 检测PCBP2抗体RIP 下来的RNA 完整性:HA 细胞(28S/18S =2.5,RIN = 9.4),U87MG(28S/18S = 2.7,RIN =8.9),T98G 细胞(28S/18S = 2.7,RIN = 9.2)(图2B)。质检结果符合芯片要求。
2.3 RIP-Chip 分析和PCBP2 蛋白相互作用的miRNA
本研究中使用的是Affymetrix GeneChip miRNA 3.0 芯片,该芯片覆盖miRNA V17.0 数据库,可以检测153 个物种的miRNA,总探针数19913 条,其中包括人属的1789 条成熟miRNA、1693 条miRNA 前体(pre-miRNA/stem-loop)及2336 条核仁小分子RNA(snoRNA)和卡哈尔体小分子RNA(scaRNA)。3 种细胞的芯片检出率分别是HA(IgG 10.79%,PCBP2 17.98%)、U87MG (IgG 12.56%,PCBP2 17.24%)和T98G(IgG 11.63%,PCBP2 22.45%)。根据3 组芯片数据,最终筛选得到富集4 倍以上且P值<0.05 的miRNA 一共105 条,包括1 条snoRNA、1条前体miRNA 和103 条成熟miRNA(表1)。另外还发现其中有15 条miRNA 序列存在PCBP2 蛋白核心识别位点(表2)。

图2 RIP 样品的质量检测Fig 2 Quality control of RIP samples
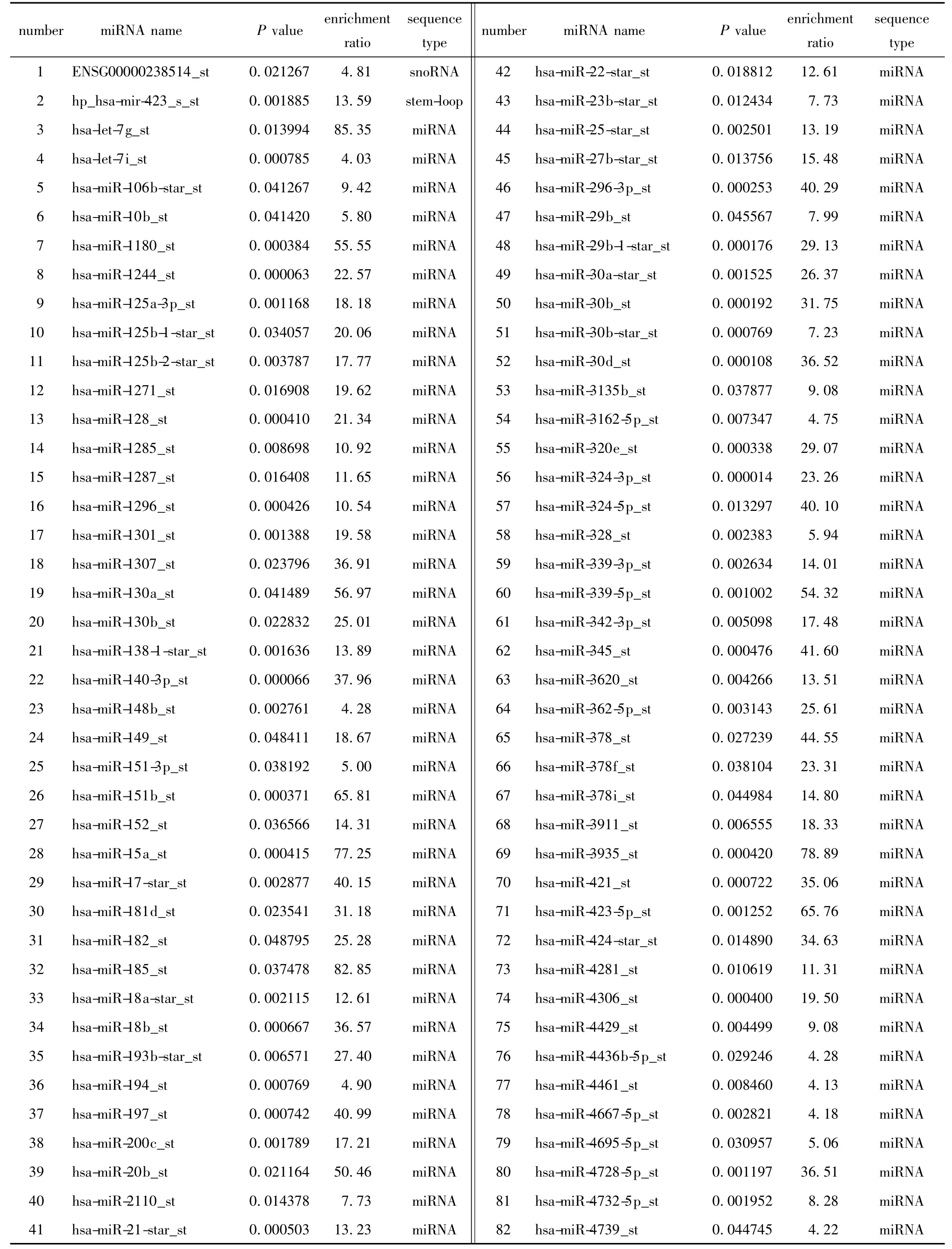
表1 利用PCBP2 抗体富集与PCBP2 结合的105 条microRNATable 1 The 105 miRNAs enriched in the PCBP2 associated miRNA population over rabbit IgG
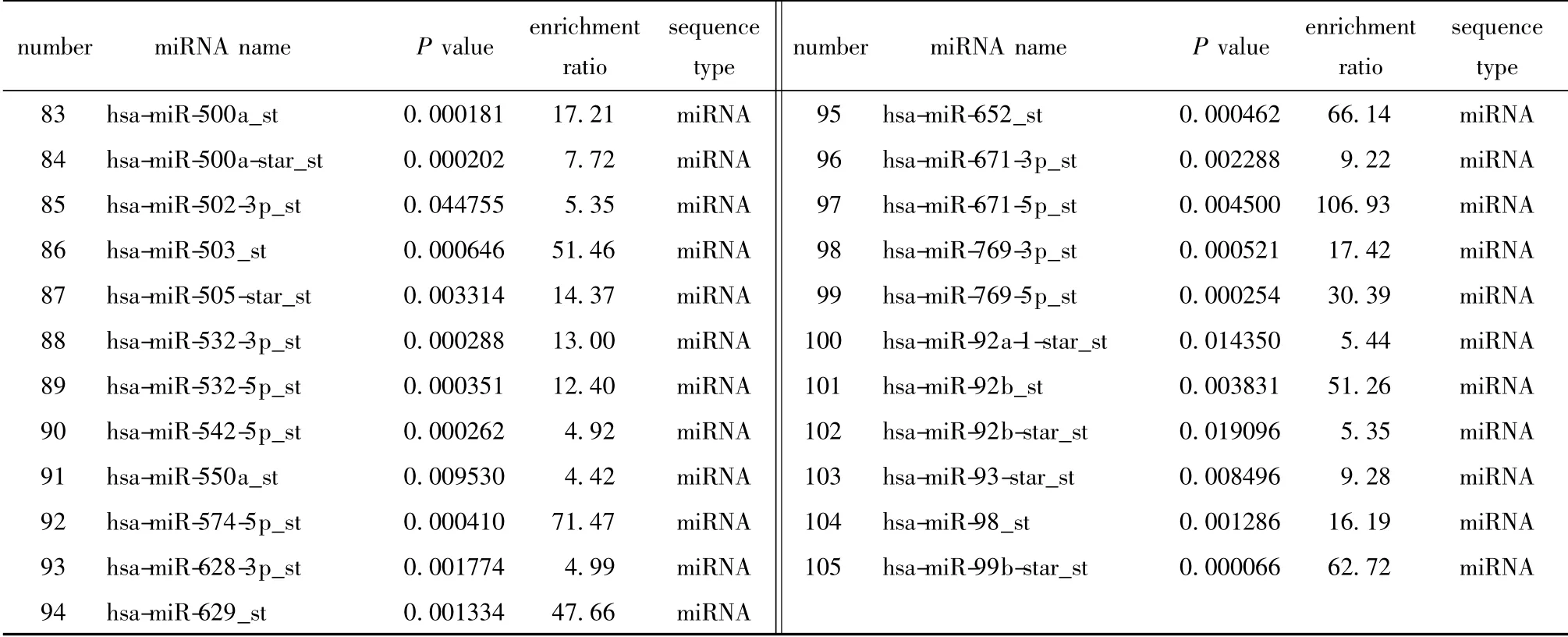
续表1

表2 包含PCBP2 核心识别位点的15 条microRNATable 2 15 microRNAs contained the core PCBP2 recognition sites
3 讨论
RIP 技术是研究细胞内RNA 与蛋白结合情况的技术,是了解转录后调控网络动态过程的有力工具[7]。RIP 技术下游结合芯片技术被称为RIPChip。随着芯片技术的发展,RIP 既可用来分析mRNA 也可以用来分析miRNA 和蛋白的相互作用,能帮助我们更高通量地了解癌症以及其他疾病整体水平的RNA 变化[8]。
本研究的目的蛋白PCBP2 是核内不均一核糖核蛋白家族重要成员,在实验室前期工作中通过RIP-Chip 鉴定了其在神经胶质瘤细胞中35 条mRNA 靶标,并且验证了靶基因FHL3 受PCBP2 负调控参与胶质瘤恶性进展[6]。当时采用的是基因表达谱芯片,本次研究利用RIP 试剂盒二步法分离miRNA,可以更高效地富集80 bp 以下的RNA,结合miRNA 表达芯片,可以高通量地分析PCBP2 在细胞内结合的成熟miRNA 和前体miRNA。
通过芯片分析结果,发现PCBP2 不但可以结合胞质中的miRNA,还可以在核内与某些snoRNA 相互作用。另外,本研究还首次发现PCBP2 可以结合前体和成熟的miR-423,说明miR-423 的生成过程可能依赖PCBP2 的调控。而以前文献报道过可以直接结合PCBP2 的miR-328[4]也在本实验的芯片结果中。除此之外,本研究还发现14 条存在PCBP2核心识别序列的miRNA,这也暗示PCBP2 与miRNA 之间的调节作用存在多样性:PCBP2 可以被“诱骗”直接结合某些miRNA 或者“诱骗”miRNA 与其结合进而调节该miRNA 的靶基因表达;更多的调节机制则可能是PCBP2 通过核糖核蛋白复合物或者共同的靶mRNA 与miRNA 相互作用。
[1]Leffers H,Dejgaard K,Celis JE.Characterisation of two major cellular poly(rC)-binding human proteins,each containing three K-homologous (KH)domains[J].Eur J Biochem,1995,230:447-453.
[2]Du Z,Lee JK,Fenn S,et al.X-ray crystallographic and NMR studies of protein-protein and protein-nucleic acid interactions involving the KH domains from human poly(C)-binding protein-2[J].RNA,2007,13:1043-1051.
[3]Makeyev AV,Liebhaber SA.The poly(C)-binding proteins:a multiplicity of functions and a search for mechanisms[J].RNA,2002,8:265-278.
[4]Eiring AM,Harb JG,Neviani P,et al.miR-328 functions as an RNA decoy to modulate hnRNP E2 regulation of mRNA translation in leukemic blasts[J].Cell,2010,140:652-665.
[5]Li Y,Lin L,Li Z,et al.Iron homeostasis regulates the activity of the microRNA pathway through poly(C)-binding protein 2[J].Cell Metab,2012,15:895-904.
[6]Han W,Xin Z,Zhao Z,et al.RNA-binding protein PCBP2 modulates glioma growth by regulating FHL3[J].J Clin Invest,2013,123:2103-2118.
[7]Jain R,Devine T,George AD,et al.RIP-Chip analysis:RNA-BindingProteinImmunoprecipitation-Microarray(Chip)Profiling[J].Methods Mol Biol,2011,703:247-263.
[8]Dahm GM,Gubin MM,Magee JD,et al.Method for the isolation and identification of mRNAs,microRNAs and protein components of ribonucleoprotein complexes from cell extracts using RIP-Chip[J].J Vis Exp,2012,67:3791-3851.
