华蟾素注射液抗肝癌细胞多药耐药性的蛋白质组学分析
2014-03-15王荣荣陆艳玲
韦 艳,卢 珩,王荣荣,陆艳玲,梁 钢
(1.武警广西总队医院药剂科,广西南宁530003;2.广西医科大学药学院药理教研室,广西南宁530021)
华蟾素为干蟾皮的水化萃取物,其主要活性成分为蟾毒内酯类化合物,包括蟾毒灵、脂蟾蜍配基、华蟾酥毒基等。华蟾素注射液(cinobutacini injection,CINO)临床上主要用于中、晚期肿瘤以及乙型肝炎等疾病,尤其在对肝癌的治疗中有显著的效果[1-2]。广西是肝癌高发地区,中药逆转肝癌多药耐药性(multidrug resistance,MDR)的研究已成为一个热点。有研究报道华蟾素降低P-糖蛋白表达而降低人乳腺细胞耐药[3],同时肝癌MDR 机制是多途径多通路的,本实验以华蟾素注射液逆转肝癌细胞潜在多药耐药相关蛋白质为主要研究内容,利用双向电泳及质谱分析技术,筛选华蟾素注射液作用于肝癌耐药细胞前后的表达差异蛋白,分析华蟾素逆转肝癌细胞多药耐药性的潜在分子机制,为临床联合用药以减少耐药的产生提供理论支持。
1 材料与方法
1.1 试剂
耐5-氟尿嘧啶细胞Bel-7402/FU(南京凯基生物科技发展有限公司);华蟾素注射液(安徽金蟾生化股份有限公司)。
1.2 细胞培养
用含10%胎牛血清的RPMI 1640 培养基培养,PBS 缓冲液清洗细胞,0.25%胰蛋白酶消化传代,置37 ℃、5 % CO2的培养箱中培养。倒置相差显微镜观察细胞增殖情况,取对数增殖期细胞用于实验。
1.3 MTT 法检测华蟾素注射液的细胞敏感性及耐药逆转作用
浓度为1 × 105个/mL 的耐5-氟尿嘧啶细胞的单细胞悬液种于同一96 孔板中,每孔100 μL,设5个平行孔,培养过夜,加入的华蟾素注射液浓度为:0.035、0.07、0.14、0.28、0.56、1.12 和2.24 μg/mL,设阴性及空白对照,最终体积200 μL。48 h 后,加入5 g/L MTT 20 μL,4 h 后弃培养液,加入150 μL DMSO。酶标仪选择波长492 nm 测吸光度值(A492),不同日重复4 次实验取均数。计算细胞抑制率(IR),IR(%)=(A492对照-A492试验)/(A492对照-A492空白)×100%,LOGIT 软件计算求得华蟾素注射液50 % 抑制浓度(IC50)。梯度浓度5-氟尿嘧啶(fluorouracil,5-FU)(26、52、104、208、416 和832 μg/mL)分别联合0.08、0.16 和0.32 μg/mL 华蟾素注射液进行耐药逆转实验,5 mg/L 维拉帕米(Verapamil,VRP)为阳性对照;同时设阴性和空白对照孔,按前述MTT 方法,CINO 逆转耐药倍数(reverse fold,RF)= 5-FU 的IC50/ (5-FU +CINO)共同作用下IC50。
1.4 2-DE 检测华蟾素注射液作用于耐药细胞后蛋白质的表达变化
实验分为Bel-7402/FU 组和Bel-7402/FU+ CINO 组(0.26 μg/mL CINO 培养48 h)。细胞用PBS清洗,加入蛋白裂解,提取总蛋白。蛋白质定量试剂盒进行定量。取样品蛋白进行固相pH 梯度胶条水化,设置IPGphor 仪器的运行参数,等电聚焦,程序结束后取出胶条进行平衡,将平衡好的胶条覆盖琼脂糖溶液后开始电泳。硝酸银染色,染色后的凝胶经ImageScanner 扫描仪扫描获得蛋白质点图谱,所得图谱用Image Master 2-DE Platinum 5.0 软件分析。分别将同种细胞3 次电泳所得的蛋白质点图谱在软件中创建平均胶,以其中一组的平均胶为参照胶与另一组的平均胶进行匹配。蛋白点灰度值差异达到2.5 倍以上认定为差异蛋白。将差异蛋白质点切下,交由广西大学生命科学院进行基质辅助激光解析电离化/飞行时间质谱(MALDI-TOF-MS)检测联合肽质量指纹谱分析,通过rNCBI 数据库获取蛋白质点的信息。
1.5 Western blot 法检测蛋白质在各组细胞中的表达差异
提取的蛋白样品进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳,分离胶浓度为7%,浓缩胶浓度为4%。采用湿法转膜,200 mA 恒流,转移2 h。5%BSA 封闭4 ℃过夜,与一抗、二抗杂交反应后,HRP-ECL 显影,扫描后应用quantity-one 软件分析。
1.6 统计学分析
采用SPSS 16.0 软件分析,计量数据以均值±标准差(±s)表示,多组间均数比较采用方差分析,进一步两两比较采用LSD-t 法。
2 结果
2.1 华蟾素注射液的细胞敏感性及耐药逆转作用
浓度为0.035、0.07、0.14、0.28、0.56、1.12和2.24 mg/L 的CINO 对细胞Bel-7402/FU 的抑制率(%)分别为:6.79 ± 0.05、10.58 ± 0.02、17.97 ±0.04、26.84 ±0.03、45.27 ±0.03、63.68 ±0.03 和77.91 ±0.05。CINO 对细胞的IC50为0.66 mg/L。5-FU对细胞的IC50及其分别联合0.08、0.16 和0.32 mg/L华蟾素注射液后对细胞的IC50见表1。
表1 CINO 对Bel-7402/FU 的逆转耐药性浓度依赖影响Table 2 The dose-dependent reversal effects of CINO on Bel-7402/FU(±s,n=4)

表1 CINO 对Bel-7402/FU 的逆转耐药性浓度依赖影响Table 2 The dose-dependent reversal effects of CINO on Bel-7402/FU(±s,n=4)
drug(mg/L)Bel-FU IC50(mg/L)RF 5-FU290.97 ±1.11-5-FU+0.08 CINO186.54 ±0.901.56* #5-FU+0.16 CINO133.52 ±0.632.18* #5-FU+0.32 CINO97.25 ±0.662.99* #5-FU+ VRP210.98 ±1.071.38
2.2 2-DE 凝胶图谱
经Image Master 2-DE Platinum 5.0 软件分析,Bel-7402/FU 组与Bel-7402/FU+ CINO 组两对凝胶进行两两匹配分析,寻找灰度值差异在2.5 倍以上的差异点,结果发现在CINO 作用Bel-7402/FU 细胞后,13 个蛋白表达量发生下调,分别编号为2、3、9、10、15、32、33、35、36、e1、e2、e3 和e4。有1 个蛋白点表达上调,编号为30。Bel-7402/FU 组和Bel-7402/FU+CINO 组双向凝胶电泳图谱见图1。
2.3 差异表达蛋白质的质谱检测结果
经肽质量指纹谱分析联合基质辅助激光解析电离化/飞行时间质谱检测对14 个差异表达的候选蛋白进行鉴定,成功鉴定了3 个差异表达蛋白(图2),通过搜索NCBInr 数据库,获取各蛋白质点信息(表2),其余因无法得到好的肽指纹图谱或者数据库搜索时匹配结果可信度过低而暂时未能鉴定。

图1 CINO 作用Bel-7402/FU 前后双向凝胶电泳图谱Fig 1 The two-dimensional electrophoregram of Bel-7402/FU treated withCINO

图2 差异表达蛋白FAK、CRT 和TMOD3Fig 2 The differential expression protein FAK,CRT and TMOD3

表2 各差异蛋白质点信息Table 2 Information of the differential expression protein
2.4 Western blot 检测
蛋白FAK、CRT 和TMOD3 的表达耐药细胞Bel-7402/FU 以及CINO 作用于耐药细胞中蛋白FAK、CRT 表达变化情况见图3。各组细胞样品蛋白中FAK /β-actin、CRT /β-actin 和TMOD3/β-actin比值见表3。
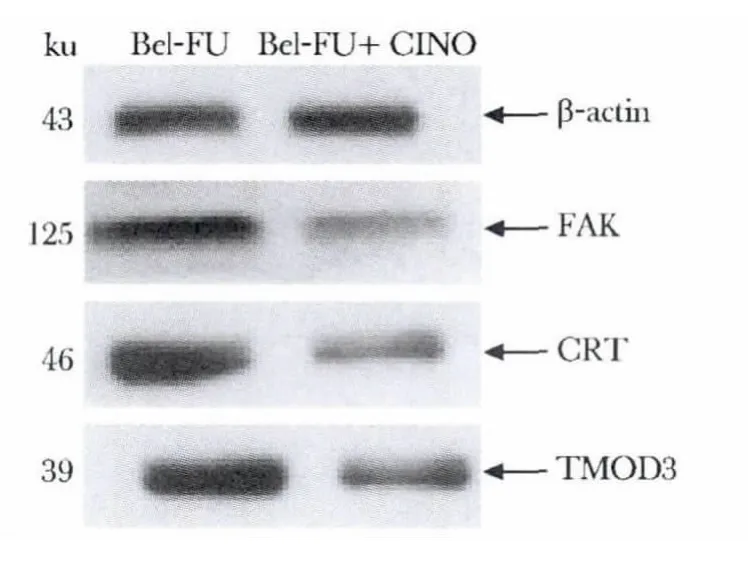
图3 Western blot 检测FAK、CRT 和TMOD3蛋白表达Fig 3 Western blot recults of FAK,CRT and TMOD3
表3 FAK、CRT 表达水平变化Table 3 The differential expression levels of FAK and CRT(±s,n=4)

表3 FAK、CRT 表达水平变化Table 3 The differential expression levels of FAK and CRT(±s,n=4)
*P<0.05 compared with Bel-7402/FU+ CINO.
ratioBel-7402/FUBel-7402/FU+ CINO FAK/β-actin1.15 ±0.06*0.65 ±0.03 CRT/β-actin1.24 ±0.03*0.59 ±0.04 TMOD3/β-actin1.31 ±0.04*0.78 ±0.09
3 讨论
从结果中可知,有13 个蛋白质点在耐药细胞中高表达,经华蟾素注射液作用后表达下调,经质谱鉴定了3 个蛋白质点,分别为:黏着斑激酶(focal adhesion kinase,FAK)、钙网蛋白(calreticulin,CRT)、原肌球调节蛋白3(tropomodulin 3,TMOD3)。在前期的研究中发现,多药耐药肿瘤细胞中的FAK、CRT、TMOD3 表达增加[4]。FAK 蛋白表达的增高预示肿瘤细胞间的黏附与群集作用增强[5],而细胞间黏附这一重要的结构基础是实体肿瘤在体内群集而产生耐药的原因之一,在肝癌病例中FAK 蛋白表达与其死亡风险及生存率有密切关系[6],经华蟾素注射液作用后其表达下调,可干预肿瘤耐药细胞的聚集及黏附从而促进其凋亡。CRT 具有多种生物学功能,包括调节钙平衡、协助蛋白质的加工折叠、参与抗原提呈、血管的发生及细胞的凋亡等[7]。近年许多体外及动物实验均证实,多种肿瘤中CRT 表达有特异性的增加,是一个潜在的肿瘤标志物[8]。CRT 表达的下调对华蟾素注射液对抗肿瘤细胞的多药耐药性机制研究有重要的意义。TMOD3 在维持细胞骨架结构和稳定性及促进细胞分化过程中有重要作用[9-10],但在肿瘤耐药中的作用并不清楚,华蟾素注射液是否通过下调TMOD3 表达、影响肿瘤细胞结构及增殖分化以逆转MDR 还有待进一步的探讨与研究。
从细胞毒性实验来分析,华蟾素注射液对多药耐药细胞具有显著的对抗作用,由于MDR 的机制是多途径、多通道的,华蟾素注射液通过下调FAK、CRT 和TMOD3 表达以逆转MDR 的机制是有限的,在下一步的研究中,将华蟾素注射液改变表达的其余蛋白进行鉴定,进一步丰富和完善其对抗肿瘤细胞MDR 机制理论。
[1]马英平,马玉平.华蟾素注射液治疗中晚期原发性肝癌临床疗效观察[J].辽宁中医药大学学报,2010,12:123-124.
[2]乔翠霞,刘群,凌昌全.华蟾素注射液经肝动脉血管给药治疗原发性肝癌10 例临床分析[J].中西医结合肝病杂志,2011,21:369-371.
[3]王玲,刘世坤,周于禄,等.华蟾素对人乳腺癌细胞阿霉素多药耐药性的逆转作用[J].中国药理学通报,2007,23:677-680.
[4]韦艳,张海英,梁钢.5-FU 诱导人肝细胞癌MDR 的比较蛋白质组学研究[J].基础医学与临床,2012,32:1016-1020.
[5]Van Nimwegen MJ,Huigsloot M,Camier A,et al.Focal adhesion kinase and protein kinase B cooperate to suppress doxorubicin induced apoptosis of breast tumor cells[J].Mol Pharmacol,2006,70:1330-1339.
[6]韩少山,刘青光,周振宇,等.FAK 在肝细胞癌中的表达及临床病理意义[J].西安交通大学学报,2013,34:81-84.
[7]Michalak MJ,Groenendyk J,Szabo EJ,et al.Calreticulin,a multi-process calcium-buffering chaperone of the endoplasmic reticulum[J].Biochem J,2009,417:651-666.
[8]Lee HH,Lim CA,Cheong YT,et al.Comparison of protein expression profiles of different stages of lymphnodes metastasis in breast cancer[J].Int J Biol Sci,2012,8:353-362.
[9]Almenar-Queralt A,Gregorio CC,Fowler VM.Tropomodulin assembles early in myofibrillogenesis in chick skeletal muscle:evidence that thin filaments rearrange to form striated myofibrils[J].J Cell Sci,1999,112:1111-1123.
[10]Gregorio CC,Fowler VM.Mechanisms of thin filament assembly in embryonic chick cardiac myocytes:Tropomodulin requires tropomyosin for assembly[J].J Cell Biol,1995,129:683-695.
