妇康洗剂质量标准研究
2014-03-15谈静方芳曾倩袁强华
谈静,方芳,曾倩,袁强华
·炮制制剂·
妇康洗剂质量标准研究
谈静1,方芳2,曾倩1,袁强华2
目的:建立妇康洗剂的质量标准。方法:采用TLC 法对处方中苦参、紫草、甘草、乌梅进行定性鉴别;采用HPLC法以乙腈-甲醇-0.1%磷酸溶液(三乙胺调pH至7.5)(12:5:83)为流动相;在检测波长220 nm 处测定氧化苦参碱和苦参碱的含量。结果:TLC鉴别分离度良好,专属性强。氧化苦参碱在0.1946~2.9190 μg,相关系数r为0.9999,线性关系良好;苦参碱在0.1134~1.7010 μg,相关系数为0.9999,线性关系良好。平均加样回收率分别为99.63%(RSD为2.19%)、99.12%(RSD为1.33%)。结论:该方法简便、准确,重复性好,可有效控制妇康洗剂的质量。
]妇康洗剂;薄层鉴别;高效液相色谱;氧化苦参碱;苦参碱;质量标准
妇康洗剂是由大菟丝子、乌梅、苦参、紫草、生甘草五种药味组成的中药复方制剂,来源于成都中医药大学附属医院临床经方,主要用于老年性阴道炎。为了控制产品质量,确保临床用药的有效性和安全性,我们建立了苦参、紫草、甘草三味药的薄层色谱鉴别法;同时采用高效液相色谱法对本品中苦参的有效成分苦参碱和氧化苦参碱进行了含量测定,建立的定性、定量方法,均简便、准确、专属性强,可有效地控制本品的质量。
1 仪器与试药
HP1100型高效液相色谱仪(美国惠普公司),惠普化学工作站,DAD检测器;BP211D电子分析天平(十万分之一,德国Satoriüs公司)。样品和试药均由成都中医药大学附属医院药剂科提供。对照药材、对照品由中国药品生物制品检定所提供。苦参碱对照品(批号:110805-200508);氧化苦参碱对照品(批号:110780-200506);熊果酸对照品(批号:110742-200516);左旋紫草素对照品(批号:110769-200506);紫草(新疆紫草)对照药材(批号:121430-200802);苦参对照药材(批号:121019-200705);甘草对照药材(批号:120904-200914);乌梅对照药材(批号:121208-200903);硅胶G(青岛海洋化工有限公司制造);乙腈、甲醇为色谱纯;水为重蒸馏水;其他试剂均为分析纯。
2 方法与结果
2.1 鉴别
2.1.1 苦参薄层鉴别[1~2]取本品10mL,加浓氨试液调pH值至10,加三氯甲烷振摇提取两次,每次20mL,分取三氯甲烷液,水浴浓缩至1mL,作为供试品溶液。另取苦参碱对照品,加甲醇制成每1mL含0.2mg的溶液,作为对照品溶液。再取苦参对照药材0.5 g,加浓氨试液1 mL、三氯甲烷25 mL,放置过夜,滤过,滤液蒸干,残渣加三氯甲烷1 mL使溶解,作为对照药材溶液。照薄层色谱法(2010年版《中国药典》一部附录ⅥB)试验,吸取供试品溶液、对照品溶液、对照药材溶液各10 µL,以条带状分别点于同一用2 %氢氧化钠溶液制备的硅胶G薄层板上,以三氯甲烷-甲醇(5:0.2)为展开剂,展开,取出,晾干,依次喷以碘化铋钾试液和亚硝酸钠乙醇试液。供试品溶液色谱中,在与对照品、对照药材色谱相应的位置上,显相同的橙色斑点。

图1 苦参TLC色谱图
2.1.2 紫草薄层鉴别 取本品5 mL,加石油醚(60~90℃)振摇提取两次,每次10 mL,分取石油醚液,挥至1mL,作为供试品溶液。另取左旋紫草素对照品,加石油醚(60~90℃)制成每1mL含0.5 mg的溶液,作为对照品溶液。再取紫草对照药材0.5 g,加石油醚(60~90℃)20 mL,超声20分钟,滤过,挥至1 mL,作为对照药材溶液。
照薄层色谱法(《中国药典》2010年版一部附录ⅥB)试验,吸取上述三种溶液各10 µL,分别点于同一硅胶G薄层板上,以环己烷-甲苯-乙酸乙酯-甲酸(5:5:0.5:0.1)为展开剂,展开,取出,晾干。供试品溶液色谱中,在与对照药材和对照品色谱相应的位置上,显相同的紫红色斑点。

图2 紫草TLC色谱图
2.1.3 甘草薄层鉴别 取本品20 mL,加水饱和正丁醇振摇提取三次,每次20 mL,合并正丁醇液,用正丁醇饱和的水溶液洗涤两次,每次10 mL,弃去水液,正丁醇液蒸干,加甲醇2 mL使残渣溶解,作为供试品溶液。另取甘草对照药材1g,加入40 mL乙醚,加热回流1小时,滤过,弃去乙醚液,药渣加30 mL甲醇,加热回流1小时,滤过,滤液蒸干,残渣加水40 mL使溶解,用正丁醇提取3次,每次20mL,合并正丁醇液,用水洗涤3次,弃去水液,正丁醇液蒸干,残渣加甲醇2 mL使溶解,作为对照药材溶液。照薄层色谱法(《中国药典》2010年版一部附录ⅥB)试验,吸取上述两种溶液各10 µL,以条带状分别点于同一用1%氢氧化钠溶液制备的硅胶G薄层板上,以乙酸乙酯-甲酸-冰醋酸-水(15:1:1:2)为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105℃加热至斑点显色清晰,置紫外光灯(365nm)下检视。供试品溶液色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点。

图3 甘草TLC色谱图
2.1.4 乌梅的薄层鉴别 取本品100 mL,浓缩至30 mL,加乙醇90 mL,滤过,滤液蒸干,残渣加水20 mL使溶解,加乙醚振摇提取两次,每次20 mL,合并乙醚液,蒸干,残渣加无水乙醇1 mL使溶解,作为供试品溶液。另取熊果酸对照品,加无水乙醇制成每1 mL含0.5 mg的溶液,作为对照品溶液。照薄层色谱法(2010年版《中国药典》一部附录ⅥB)试验,吸取供试品溶液、对照品溶液各20µL,分别点于同一硅胶G薄层板上,以环己烷-三氯甲烷-乙酸乙酯-甲酸(20:5:8:0.1)为展开剂,展开,取出,晾干,喷以10%硫酸乙 醇 溶 液 ,在105℃加热至斑点显色清晰,供试品溶液色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。

图4 乌梅TLC色谱图
2.2 含量测定[3~11]
2.2.1 色谱条件 色谱柱:Green pHlex C18(250 mm×4.6 mm,5 μm);以乙腈-甲醇-0.1%磷酸溶液(三乙胺调pH至7.5)(12:5:83)为流动相;流速:1 mL.min-1;检测波长为220 nm;柱温:30℃。理论板数按氧化苦参碱峰计算应不低于2000。
2.2.2 对照品溶液制备 精密称取干燥至恒重的苦参碱对照品22.68 mg和氧化苦参碱对照品38.92 mg,置50 mL量瓶中,加乙醇至刻度,摇匀,即得混合对照品溶液(苦参碱对照品浓度:0.4536mg.mL-1、氧化苦参碱对照品浓度:0.7784 mg.mL-1)。
2.2.3 供试品溶液制备 精密量取样品2 mL,置25 mL量瓶中,加乙醇23 mL,超声处理10 min,放至室温,加乙醇至刻度,摇匀,用微孔滤膜(0.45 µm)滤过,取续滤液,即得。
2.2.4 缺苦参的阴性供试品溶液制备 按处方比例称取除苦参外其余饮片,按制剂工艺制备阴性样品,在按“2.2.3”项下方法制备阴性供试品溶液。
2.2.5 线性范围考察 分别精密吸取“2.2.2”项下混合对照品溶液1,2,3,5,10,15 mL,置20 mL容量瓶中,加无水乙醇稀释至刻度,摇匀,即得。分别吸上述混合对照品溶液各5 μL,注入色谱仪,按上述色谱条件测定峰面积,以峰面积(Y)对进样量(X)进行线性回归,得氧化苦参碱回归方程:Y=839.89X+2.0896(r=0.9999), 表明氧化苦参碱在0.1946~2.9190 μg,与其峰面积呈良好的线性关系;苦参碱回归方程:Y=1153.5X+0.597(r=0.9999),表明苦参碱在0.1134~1.7010 μg,与其峰面积呈良好的线性关系。
2.2.6 专属性试验 精密吸取混合对照品溶液、供试品溶液和阴性供试品溶液各5 µL,注入色谱仪,按上述色谱条件测定,结果供试品中氧化苦参碱、苦参碱色谱峰与相邻色谱峰分离度大于1.5,阴性无干扰。见图4。

图5 氧化苦参碱和苦参碱HPLC色谱图
2.2.7 精密度试验 精密吸取氧化苦参碱和苦参碱混合对照品溶液(氧化苦参碱对照品浓度:0.3892 mg.mL-1,苦参碱对照品浓度:0.2268mg.mL-1)5 μL,按上述色谱条件,重复进样6次,测定峰面积,结果氧化苦参碱和苦参碱峰面积的RSD分别为0.60%和0.62%,表明精密度良好。
2.2.8 重复性试验 取同一批样品6份,按供试品溶液制备方法制备,分别进样5 μL,测定峰面积,计算氧化苦参碱和苦参碱的含量分别为0.5067,1.644 mg.mL-1,RSD分别为1.11%,1.18%。表明重现性良好。
2.2.9 稳定性试验 精密吸取供试品溶液5 μl,于0,2,4,8,12,18 h分别进样,记录峰面积,结果峰面积RSD分别为1.47%,0.61%。表明供试品在18 h内稳定。
2.2.10 加样回收试验 精密吸取已知含量的样品溶液(氧化苦参碱:0.5067 mg/mL,苦参碱:1.644 mg.mL-1)1mL,共6份,分别精密加入苦参碱和氧化苦参碱的混合对照品溶液(苦参碱对照品:1.588 mg.mL-1,氧化苦参碱对照品:0.5010 mg.mL-1)1mL,置25 mL容量瓶中,按供试品溶液制备方法制备,测定氧化苦参碱和苦参碱的含量,结果见表1、2。
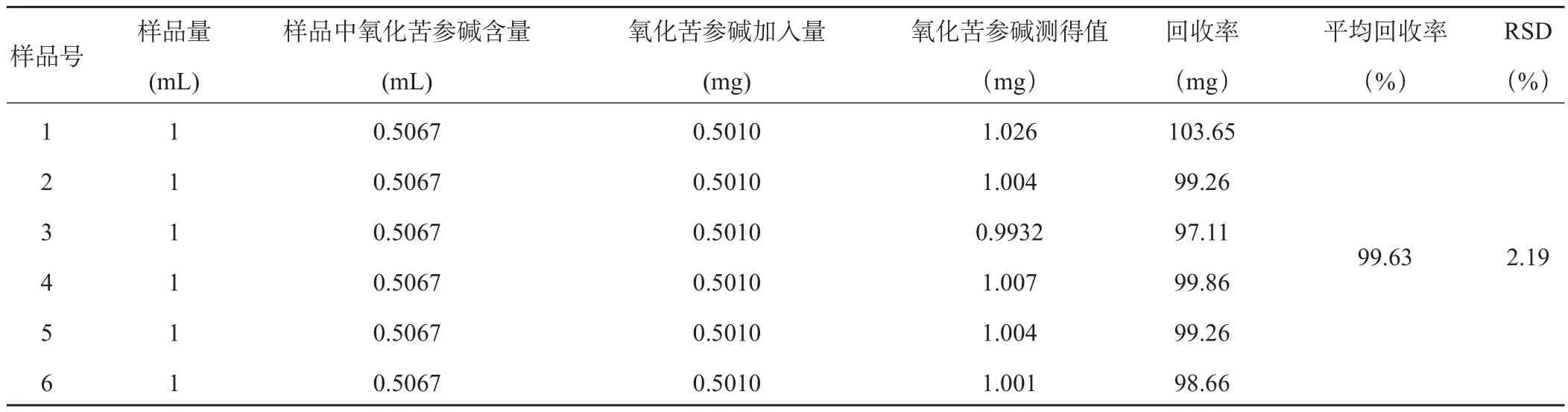
表1 氧化苦参碱加样回收试验结果

表2 苦参碱加样回收试验结果
结果表明,氧 化 苦 参 碱 和 苦 参 碱 的 平均回收率分别为99.63%、98.34%,回收率在95-105%之间,且RSD(%)均小于3.0%,表明本法加样回收率良好。
2.2.11 样品含量测定 精密量取三批中试样品各2 mL,每批3份,按供试品溶液的制备方法制备供试品溶液,精密吸取供试品溶液5 μL进样,按上述色谱条件测定,计算氧化苦参碱和苦参碱总含量,结果三批样品含氧化苦参碱和苦参碱的总量分别为2.026,
2.050,2.077 mg.mL-1,平均值为2.051 mg.mL-1。
3 讨论
3.1 在质量标准的建立过程中,按照《中国药典》2010年版一部附录ⅠV“洗剂”项下有关的各项规定,对本品三批样品的装量差异、相对密度、pH、微生物限度、重金属、砷盐等进行了检查,结果均符合规定。
3.2 建立薄层鉴别方法时,对苦参的薄层鉴别分别考察了展开系统Ⅰ:甲苯-丙酮-乙醇-浓氨(20:20:3:1)、展开系统Ⅱ:甲苯-乙酸乙酯-丙酮-浓氨(3:3:1:0.1)、展开系统Ⅲ:三氯甲烷-甲醇(5:0.2)、展开系统Ⅳ:三氯甲烷-甲醇-浓氨(5:0.6:0.3)10℃以下放置的下层溶液,展开系统Ⅰ和Ⅱ分离效果均较好,但系统Ⅰ的Rf值较大,Ⅱ的Rf值较小,展开系统Ⅳ样品的相溶性较差,展开时溶剂前沿不平。展开系统Ⅲ分离效果较好,Rf值适中,需注意温湿度的影响,否则边缘效应明显。此外乌梅的薄层鉴别,因制样取样量和点样量均较大,图谱的背景通道干扰较明显,因此乌梅的鉴别方法还有待改进。
3.3含量测定方法筛选时考察了色谱柱、流动相种类、比例、柱温:比较了依利特ODS C18(150×4.6 mm,5 μm)柱,Welchrom C18(250×4.6 mm,5 μm)柱,Diamonsil C18(250×4.6 mm,5 μm)柱,Green pHlex C18(250×4.6 mm,5 μm)柱,采用乙腈-0.1%磷酸溶液、乙腈-0.1%磷酸溶液(三乙胺调pH=7.5)、乙腈-甲醇-0.1%磷酸溶液(三乙胺调pH=7.5)等不同种类和比例的流动相进行试验,结果表明Green pHlex C18(250×4.6 mm,5 μm)柱用乙腈-甲醇-0.1%磷酸溶液(三乙胺调pH=7.5)分离效果较好。同时比较了乙腈-甲醇-0.1%磷酸溶液(三乙胺调pH=7.5)不同比例(10:7:83、11:7:83、12:6:82、12:5:83),比较了柱温30℃、25℃、20℃,比较流速0.9 mL.min-1、1.0 mL.min-1、1.1 mL.min-1,发现乙腈-甲醇-0.1%磷酸溶液(三乙胺调pH=7.5)(12:5:83),1.0 mL.min-1,柱温30℃分离效果最好,故采用此条件进行洗脱。
[1] 罗美兰,廖银根,王文,等.复方苦蛇黄洗剂质量标准[J].中国实验方剂学杂志,2013,19(13):131.
[2] 朱立范,刘力.参柏胶囊的定性定量方法研究[J].中国实验方剂学杂志,2010,16(4):70.
[3] 刘向荣,张瑛,夏才付.复方苦参泡腾片的质量标准研究[J].中国药业,2008,17(23):15.
[4] 王天勇,杨文远.反相高效液相色谱法同时测定苦豆子及其制剂中苦参碱和氧化苦参碱[J].分析测试技术与仪器,1996, 2(4):29.
[5] 张善玉,姜艳玲,申英爱.抗妇炎胶囊中苦参碱和氧化苦参碱的含量测定[J].国珍国医国药,2006,17(5):728.
[6] 李华荣,高逢喜.HPLC法测定妇舒能洗剂中氧化苦参碱的含量测定[J].中国药师,2009,12(5):620.
[7] 王小龙,叶晓娅.不同提取工艺对制霉洗剂中苦参碱与氧化苦参碱含量的影响[J].医药导报,2009,28(5):645.
[8] 田吉,何兵,杨曦.舒肤软膏中苦参碱的含量测定[J].泸州医院院学报,2009,32(5):484.
[9] 毕映燕,胡芳弟.高效液相色谱法同时测定复方当归栓中5种活性组分的含量[J].中国中药杂志,2010,35(18):2402.
[10] 毛丹,陈钶,王柯,等.HPLC法测定苦参软膏中苦参碱、槐定碱和氧化苦参碱[J].中成药,2011,33(9):1531.
[11] 史银基,刘砥威,石雪,等.HPLC测定阿娜尔妇洁液中苦参碱的含量[J].中国实验方剂学杂志,2012,18(14):119.
(责任编辑:胡慧玲)
The quality standards research of Fukang lotion
/TAN Jing1, FANG Fang2, ZENG Qian1, YUAN Qiang-hua2//(1.AffliatedHospital of Chengdu University of Traditional Chinese Medicine, Chengdu 610072, Sichuan;2.Chengdu University of Traditional Chinese Medicine, Chengdu 610075, Sichuan)
Objective:To establish the quality standards of Fukang lotion. Method:TLC was used to identify Kushen, Zicao, Gancao and Wumei in Fukang lotion. The content of oxymatrine and matrine were determined by HPLC with a mobile phase of acetonitrile-Methanol-0.1% phosphoric acid (12:5:83). And Triethylamine was used to maintain pH value at 7.5.The detection wave length was set at 220 nm. Result:The identifcation by TLC was distinct and highly specifc. The linear ranges of oxymatrine and matrine were in the ranges of 0.1946 μg ~2.9190 μg (r=0.9999) and 0.1134 μg ~1.7010 μg (r=0.9999). The sample recoveries were 99.63% (RSD=2.19%) and 99.12% (RSD=1.33%). Conclusion: The method is simple, accurate, reproducible and can control the quality of Fukang lotion effectively.
Fukang lotion;TLC;HPLC;oxymatrine;matrine;quality standard
R 284
A
1674-926X(2014)02-014-05
成都中医药大学附属医院基金项目(2009-D-YY-44)
1.成都中医药大学附属医院,四川 成都 610072;
2.成都中医药大学,四川 成都 610075
谈静(1980-),女,汉族,硕士,主管药师,研究方向为中药炮制及新制剂研究
Email:tj800410@163.com
2013-07-31
