锰-超氧化物歧化酶、过氧化氢酶在异丙肾上腺素所致大鼠心肌肥厚中的表达
2014-03-14朱玉林米立国郝连军杜建文王瑞芬
朱玉林,米立国,郝连军,杜建文,王瑞芬
(1.河北省邯郸市妇幼保健院麻醉科,河北 邯郸 056001;2.河北医科大学基础医学院人体解剖学教研室,河北 石家庄 050017;3.河北省血液中心检验科,河北 石家庄 050071;4.河北省承德市中心医院超声诊断科,河北 承德 067000;5.河北省沧州市中心医院儿科,河北 沧州 061000)
心肌肥厚(myocardial hypertrophy)是心脏对慢性压力或容量超负荷等因素所作出的一种代偿性反应[1-2]。大量研究[3]表明氧化应激可能是导致心肌肥厚的重要原因。在心肌肥厚的形成和发展过程中,活性氧族(reactive oxygen species,ROS)产生增多[4]。过多的ROS如不被机体及时清除,就会损害心肌细胞内的蛋白质和脂类等生物大分子引起细胞死亡[5]。锰-超氧化物歧化酶(manganese superoxide dismutases,Mn-SOD)主要负责清除线粒体内的超氧阴离子[6-7];过氧化氢酶(catalases,CAT)主要负责清除细胞内的过氧化氢[8-9]。CAT与Mn-SOD是维持心肌正常功能所必需的抗氧化酶。以前的研究只观察了Mn-SOD 和CAT在心肌肥厚模型中蛋白活性的改变,均未对这两个重要抗氧化酶系基因水平的表达变化进行观察。
1 材料与方法
1.1 实验动物和取材:健康雄性SD大鼠16只,体质量(300±10)g,随机分为对照组(Control组)和心肌肥厚模型组(Iso 组)。参照Borges等[10]的方法,Iso组大鼠通过背部皮下注射异丙肾上腺素(5mg·kg-1·d-1),连续注射7 d制备大鼠心肌肥厚模型;对照组大鼠背部皮下只注射等体积的生理盐水。两组大鼠均自由进食进水。末次给药24h后称量大鼠体质量(body weight,BW),6%水合氯醛(5mL/kg体质量)腹腔注射麻醉。分离右侧颈总动脉插入自制聚乙烯导管,稳定后记录右颈总收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP),计算平均动脉压(mean aterial pressure,MAP);收集大鼠血液,3 000r/min离心10min,分离血清,用于血清乳酸脱氢酶 (lactate dehydrogenase,LDH) 活性测定;开胸取心称量左心及全心质量、测量左心室壁厚度。此外,将一部分心脏标本放入液氮中用于总RNA的提取;另一部分放入固定液内固定,用于光镜和透射电镜观察。
1.2 主要试剂:LDH测定试剂盒为中生北控生物科技公司产品,TRIzol、RT试剂盒、Taq DNA聚合酶均为Invitrogen公司产品。
1.3 血压测量:麻醉后固定大鼠,分离右侧颈总动脉,插入和压力换能器相连的自制聚乙烯导管,稳定后记录右颈总动脉SBP、DBP,计算MAP=(SBP+DBP×2)/3。
1.4 LDH活性测定:LDH活性按照试剂盒的操作说明采用乳酸脱氢酶-乳酸(lactate dehydrogenase-lactate,LD-L)速率法测定。
1.5 测量心质量及左心室壁厚度:大鼠麻醉后开胸取心,用镊子轻压心体挤出内部残留血液并用冷生理盐水洗掉表面血液,滤纸拭干后迅速置于电子天平内称量全心质量(heart weight,HW),再迅速分离左心室称量质量(left ventricle of heart weight,LHW),计算心质量指数(HW /BW,LHW/BW)。打开左心室分离室间隔(interventricular septum,VST)与游离心室壁(left ventricular wall thickness,LVWT),用游标卡尺测量其厚度。
1.6 心肌的光镜和透射电镜观察: 按照光镜与透射电镜的要求进行样品制备,分别于光镜与透射电镜下观察心肌纤维形态变化,并进行图像分析。
1.7 Mn-SOD、CAT的mRNA测定:用TRIzol法提取心肌总RNA。以GAPDH为内参照,进行RT-PCR。分别以Mn-SOD、CAT和GAPDH的扩增产物的灰度值之比表示其mRNA的相对表达量。GAPDH引物,上游,5′GCTGAGTATGTCGTGGAGT 3′,下游,5′TCTTCTGAGTGGCAGTGAT 3′;Mn-SOD引物,上游,5′TGACCTGCCTTACGACTA 3′,下游,5′CGACCTTGCTCCTTATTG 3′;CAT引物,上游,5′TATTGCCGTCCGATTCTC 3′,下游,5′ATGCCCTGG-TCAGTCTTG3′。

2 结 果
2.1 血压:与对照组相比,Iso 组大鼠血压明显升高(P<0.01),见表1。
2.2 LDH活性:与对照组相比,Iso 组大鼠血清LDH活性明显升高(P<0.01),见表1。
2.3 HW /BW与LHW/BW的改变:与对照组相比,Iso 组大鼠的HW/BW与LHW/BW均明显增加(P<0.01),见表1。
2.4 VST与LVWT的改变:与对照组相比,Iso组大鼠的VST与LVWT均明显增加(P<0.01),见表1。
2.5 心肌组织的光镜观察:Iso组大鼠心肌组织的HE染色切片在光镜下可见大片纤维化区域,成纤维细胞多,偶可见单核细胞,局部区域毛细血管扩张,心肌细胞排列不连续,胞浆变宽,胞核变大,呈现明显的心肌肥厚纤维化表现(图1)。对照组大鼠的心肌纤维排列整齐,心肌细胞胞核清晰,无胶原纤维增生(图2)。
2.6 心肌组织的透射电镜观察:对照组大鼠心肌纤维明带、暗带结构清晰,肌节长度适中,肌纤维排列整齐,线粒体数量结构未见异常(图3)。心肌肥厚模型组大鼠线粒体数量较多,线粒体嵴增多密集,线粒体肿胀,个别线粒体出现空泡样变,心肌纤维内肌丝有溶解现象,心肌纤维间隙增宽、成纤维细胞明显,间隙内出现凋亡细胞(图4~6)。
2.7 Mn-SOD、CAT的 mRNA表达变化:与对照组相比,Iso组大鼠心肌组织内Mn-SOD、CAT的mRNA表达水平均明显增强(P<0.05),见表2。
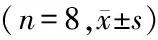

GroupsMAP(kPa)LDH (U/L)HW/BW(mg/g)LHW/BW(mg/g)LVWT(mm)VST(mm)Control10.21±0.81514.83±13.433.05±0.232.33±0.113.56±0.182.44±0.07Iso14.05±1.19∗876.66±9.52∗4.51±0.39∗3.26±0.25∗4.33±0.31∗3.11±0.19∗
*P<0.01vscontrol group byttest
MAP:mean arterial pressure;LDH:lactate dehydrogenase;HW/BW:heart weight/body weight;LHW/BW:left ventricle of heart weight/body weight;LVWT:left ventricular wall thickness;VST:interventricular septum;Iso:isoproterenol
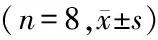

GroupsMn-SODCATControl0.625±0.0950.763±0.129Iso0.998±0.154∗1.051±0.143∗
*P<0.05vscontrol group byttest
Mn-SOD:manganese superoxide dismutases;CAT:catalases;Iso:isoproterenol
3 讨 论
心肌肥厚是多种心血管疾病所具有的共同病理过程,如不及时治疗会发展成心功能衰竭。因此,对心肌肥厚发病机制的探讨一直是心血管研究的重点之一。到目前为止,对于其发病机制的研究主要是通过动物模型来实现的。Iso是一种β受体激动剂,可增强心肌收缩力,加快心率,使心肌耗氧量明显增加,并能促进心肌细胞总蛋白和非收缩蛋白合成,使心肌细胞肥大,胶原纤维增生,导致心肌肥厚的形成[11-12]。本研究结果显示,在给大鼠注射7d Iso后,HE和电镜结果均提示大鼠出现心肌肥厚的病理改变;同时,Iso组大鼠的血压升高,HW/BW、LHW/BW、LVWT、VST等均明显增加,进一步证实心肌肥厚的发生;此外,血清内LDH活性明显升高,说明此时心肌细胞已严重受损,导致释放入血的LDH增多,活性升高。以上这些结果均表明使用Iso诱导的心肌肥厚模型是成立的。
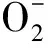
在心肌肥厚的发生发展过程中,心肌细胞消耗的能量明显增强。机体通过加强线粒体氧化磷酸化来增加三磷酸腺苷的合成,满足心肌过多的能量消耗。但在这个过程中从电子传递链泄漏的ROS也会随之增多。它们可以使生物膜内的多不饱和脂肪酸发生脂质过氧化反应,改变生物膜的结构和功能。此外,ROS还可损伤线粒体的结构和功能,使三磷酸腺苷合成减少,加重心肌能量缺乏,进一步促进心肌肥厚的发生发展。这可能是我们建立的大鼠心肌肥厚模型出现明显的心肌细胞受损、心肌肥厚纤维化等病理改变的直接原因。同时,Mn-SOD和CAT的mRNA表达水平在心肌肥厚模型组大鼠明显增强。推测:当心肌肥厚等病理改变发生后,心肌组织内ROS的产生量明显增多,此时机体通过上调Mn-SOD、CAT的基因表达水平,增加其生成量来清除过多的ROS,保护心肌细胞免遭损伤,防止心肌肥厚的进一步发展。本研究结果进一步证实了SOD和CAT 2个抗氧化酶在心血管疾病防治中的重要作用,这将为心肌肥厚防治方法的研究提供一定的理论参考。(本文图见封二)
[1] 宁晓然,王敬联,郑伟,等.强心汤对实验性心肌肥厚大鼠血管紧张素Ⅱ及心肌超微结构的影响[J].河北医科大学学报,2006,27(5):327-330.
[2] 吕广卫, 董士民.微小RNA与心肌肥大[J].临床荟萃,2013,28(6):716-718.
[3] MAULIK SK,KUMAR S.Oxidative stress and cardiac hypertrophy: a review[J].Toxicol Mech Methods,2012,22(5):359-366.
[4] LU Z,XU X,HU X,et al.PGC-1 alpha regulates expression of myocardial mitochondrial antioxidants and myocardial oxidative stress after chronic systolic overload[J].Antioxid Redox Signal,2010,13(7):1011-1022.
[5] LEE R,MARGARITIS M,CHANNON KM,et al.Evaluating oxidative stress in human cardiovascular disease: methodological aspects and considerations[J].Curr Med Chem,2012,19(16):2504-2520.
[6] KIM A,CHEN CH,URSELL P,et al.Genetic modifier of mitochondrial superoxide dismutase-deficient mice delays heart failure and prolongs survival[J].Mamm Genome,2010,21(11/12):534-542.
[7] LOCH T,VAKHRUSHEVA O,PIOTROWSKA I,et al.Different extent of cardiac malfunction and resistance to oxidative stress in heterozygous and homozygous manganese-dependent superoxide dismutase-mutant mice[J].Cardiovasc Res,2009,82(3):448-457.
[8] MOVAHED A,YU L,THANDAPILLY SJ,et al.Resveratrol protects adult cardiomyocytes against oxidative stress mediated cell injury[J].Arch Biochem Biophys,2012,527(2):74-80.
[9] DAI DF,JOHNSON SC,VILLARIN JJ,et al.Mitochondrial oxidative stress mediates angiotensin Ⅱ-induced cardiac hypertrophy and Galphaq overexpression-induced heart failure[J].Circ Res,2011,108(7):837-846.
[10] BORGES JC,SILVA JA JR,GOMES MA,et al.Tonin in rat heart with experimental hypertrophy[J].Am J Physiol Heart Circ Physiol,2003,284(6):H2263-2268.
[11] ZHENG M,HAN DQ,XIAO RP.Distinct beta-adrenergic receptor sub-type singa ling in the heart and their pathophysio logical relevance[J].Sheng Li Xue Bao,2004,56(1):1-15.
[12] OCARANZA MP,DAZ-ARAYA G,CHIONG M,et al.Isoproterenol and angiotensin I-converting enzyme in lung,left ventricle,and plasma during myocardial hypertrophy and fibrosis[J].J Cardiovasc Pharmacol,2002,40(2):246-254.
[13] MAKSIMENKO AV,VAVAEV AV.Antioxidant enzymes as potential targets in cardioprotection and treatment of cardiovascular diseases.Enzyme antioxidants: the next stage of pharmacological counterwork to the oxidative stress[J].Heart Int,2012,7(1):14-19.
[15] DAI DF,CHEN T,WANAGAT J,et al.Age-dependent cardiomyopathy in mitochondrial mutator mice is attenuated by overexpression of catalase targeted to mitochondria[J].Aging Cell,2010,9(4):536-544.
[16] QIN F,LENNON-EDWARDS S,LANCEL S,et al.Cardiac-specific overexpression of catalase identifies hydrogen peroxide-dependent and -independent phases of myocardial remodeling and prevents the progression to overt heart failure in G(alpha)q-overexpressing transgenic mice[J].Circ Heart Fail,2010,3(2):306-313.
[17] HUANG GQ,WANG JN,TANG JM,et al.The combined transduction of copper,zinc-superoxide dismutase and catalase mediated by cell-penetrating peptide,PEP-1,to protect myocardium from ischemia-reperfusion injury[J].J Transl Med,2011,9:73.
