厄贝沙坦对急性心肌梗死后血清脑钠肽、左心室收缩功能及心肌胶原容积分数的影响
2014-03-14杜文涛贾玮玲赵秀杰戚国庆
韩 巍,杜文涛,贾玮玲,赵秀杰,夏 岳,戚国庆
(1.河北医科大学第一医院心内三科,河北 石家庄 050031;2.河北工程大学附属医院心内二科,河北 邯郸 056002)
急性心肌梗死(acute myocardial infarction,AMI)发生后,神经内分泌系统的过度激活或长期活性增高会导致心室结构的重塑及左心收缩功能的衰竭。减轻或阻断神经内分泌系统在AMI后的负作用是目前治疗AMI和心力衰竭的重要方法之一。血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)受体拮抗剂(angiotensin Ⅱ receptor antagonist,ARBs)类药物可以通过上述机制达到治疗AMI的目的。本研究通过动物实验探讨ARBs类药物在干预脑钠肽(brain natriuretic peptide,BNP)、改善左心室内压力及左心室重塑方面的作用,旨在为AMI的诊治提供新的理论依据。
1 材料与方法
1.1 材料与仪器:成年健康雄性Wistar大鼠30只,体质量240~270g(河北省实验动物中心提供);小动物人工呼吸机(河北医科大学实验室提供);电生理记录仪(河北医科大学实验室提供,美国Power lab生产);大鼠BNP试剂购自于美国Rapidbio公司;酶标仪(河北医科大学第一医院检验科提供,型号为TECAN);HEC显微镜微机图像分析系统(河北医科大学解剖学教研室提供,江苏捷达软件公司研制);厄贝沙坦(Irb,杭州赛诺菲-安万特制药公司生产)。
1.2 方法
1.2.1 模型制备与分组处理:称体质量后的大鼠以2%戊巴比妥钠溶液(30mg/kg)腹腔注射麻醉后置于自制手术台上,仰卧位,四肢接心电图机,通过肢体导联监测心电图,同时连接小动物人工呼吸机行辅助呼吸。20只大鼠通过结扎左冠状动脉主干建立AMI模型,10只大鼠开胸但不结扎冠状动脉列为假手术组(A组)。模型制备过程,在左心房与右心室流出道之间,约距主动脉根部2mm处用5.0丝线穿过左冠状动脉主干进行结扎,左心室前壁变苍白或发绀,并出现心室壁运动减弱。同时体表心电图Ⅱ导联ST段抬高≥0.2mV或T波高耸形成单峰融合波,提示结扎成功。持续半小时以上判断AMI形成。将20只AMI大鼠随机分为AMI组(B组)和AMI+Irb组(C组)。术后待大鼠清醒后再次称体质量,编号,按组分笼饲养。以上手术均在无菌条件下,由一人操作完成,术后肌内注射青霉素钠2×105U/d,连续5d抗感染。
1.2.2 给药:C组大鼠术后开始给药,厄贝沙坦按10mg/kg溶于生理盐水1mL,于术后立即灌胃;A组和B组均通过胃管给予等量1mL生理盐水。以后C组厄贝沙坦按50mg/kg溶于水2mL,每日上午灌胃;A组和B组均喂等容量生理盐水。
1.3 标本获取及指标测定:术后14d抽取大鼠尾静脉血1mL,置于离心管中,以3 000r/min离心10min后,用吸管将上层血清转移至试管中,标明组别和鼠号,采用双抗夹心ELISA法测定BNP值。再次称体质量后以10%水合氯醛麻醉大鼠,固定在手术台上,分离右侧颈内动脉,结扎远心端,用动脉夹夹闭近心端,使动脉充盈。将动脉剪一小口,选择1mm导管作为测压导管(以肝素做抗凝预处理),外端与电生理记录仪上的压力感受器相连。将导管轻轻送入左心室,用生理仪的计算机分析系统计算左心室收缩压(left ventricular systolic pressure,LVSP)和心室内压最大变化速率(the maximum value of its first derivative Doppler-derived,dP/dtmax)。最后断头处死大鼠,迅速取出大鼠心脏,沿房室交界处剪去左右心房及大血管,去除右心室游离壁,称取余下的左心室质量(left ventricular mass,LVM),在梗死区域的直径最大处垂直于心脏长轴将左心室一分为二,心尖部分以石蜡包埋,切取4μm厚的截面标本行苏木精-伊红(HE)染色和Masson染色制成病理切片,应用HEC显微镜微机图像分析系统测定瘢痕弧长以及心内、外膜的周长,同一测量者对同一标本,每次3遍测量值之间的变异系数为0.8%;不同次数测量均值之间的变异系数为1.0%;不同测量者测量均值之间的变异系数为1.2%。计算得到梗死面积=(瘢痕内周弧长+外周弧长)/(左心室内周弧长+外周弧长)×100%。每张切片应用MOTIC6.0数码医学图像分析系统测定在远离梗死区随机取5个视野,以视野中所有胶原面积之和除以心肌纤维和结缔组织面积总和,得到胶原容积分数(collagen volume fraction,CVF),血管旁胶原面积不计入内。

2 结 果
B组和C组的BNP、CVF、LVM均高于A组,但C组低于B组(P<0.01);B组和C组LVSP、dP/dtmax均低于A组,但C组高于B组(P<0.01)。见表1。
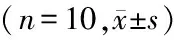

GroupsBNP(ng/L)LVSP(mmHg)dP/dtmax(mmHg/min)CVF(%)LVM(mg)A215.23±1.31132.53±3.438 611.00±223.910.015±0.002449.50±27.37B284.41±1.89∗103.60±3.19∗5 599.89±160.47∗0.076±0.004∗676.80±34.93∗C257.54±1.25∗#107.45±2.96∗#6 512.86±198.47∗#0.038±0.003∗#614.10±27.77∗#F5 326.47241.148620.355981.724150.872P0.0000.0000.0000.0000.000
*P<0.01vsA group #P<0.01vsB group byANOVA
BNP:brain natriuretic peptide;LVSP:left ventricular systolic pressure;dP/dtmax:the maximum value of its first derivative Doppler-derived ;CVF:collagen volume fraction;LVM:left ventricular mass
3 讨 论
随着人民生活水平的提高,高血压、高血脂及冠心病等疾病的发病率明显增高,特别是AMI,作为内科常见急危重症,病死率极高,严重影响人类健康。心脏内分泌系统的过度激活在AMI后可以导致心室重塑和心功能恶化,并最终进展为心力衰竭。
BNP是由心肌细胞合成的具有生物学活性的重要心脏神经内分泌激素,是一种含有32个氨基酸的多肽。当左心室功能不全时,由于心肌扩张而快速合成释放入血,具有利钠利尿、抗醛固酮、舒张血管、降低血压的作用,同时还能抑制交感神经系统(sympathetic nervous system,SNS)及肾素-血管紧张素-醛固酮系统(renin-angiotensin aldosterone system,RAAS)活性,有助于调节心脏功能。BNP已经成为临床上检测心力衰竭的一种敏感而又特异的定量方法[1]。但是应用BNP治疗心力衰竭是否有效仍然没有明确的结论[2-4]。近年来有学者[5-6]认为BNP可以作为急性冠状动脉综合征危险分层的指标。Arakawa等[7]研究发现,BNP水平和肌酸激酶峰浓度在AMI后呈正相关性升高,提示AMI后BNP浓度与心肌梗死的面积有关。高水平的BNP存在较大的心肌梗死面积[8]。
心肌细胞外间质(extracellular matrix,ECM)在维持心脏结构和功能方面起着重要的作用。胶原是ECM中最丰富的结构成分,也是心脏协调收缩和舒张的功能单元[9]。AMI后发生心室重构,其中基质胶原网络的代谢异常[10],贯穿于AMI后的心室肥大和心力衰竭的发展过程中。动物研究[11]证实,心肌胶原沉积含量影响左心室重构,心脏越大,胶原沉积越多。本研究结果证实AMI后2周AMI大鼠的左心室非梗死区胶原容积分数明显增高,说明此时的心肌开始或者已经发生了重塑。
ARBs是一类作用于肾素-血管紧张素系统的药物,通过阻断血管紧张素Ⅱ1型受体可直接引起血管舒张、血管升压素分泌减少、醛固酮合成及分泌减少。目前广泛应用于高血压、冠心病及心力衰竭等多种心血管系统疾病的防治。本研究结果显示AMI后经过厄贝沙坦治疗的大鼠,与未经治疗的心肌梗死大鼠比较血清BNP水平明显降低,说明厄贝沙坦能够抑制AMI后神经内分泌系统的激活,使血清BNP升高程度有所改善。同时厄贝沙坦还能提高AMI后大鼠的LVSP及dP/dtmax,降低左心室非梗死区CVF和LVM,最终改善心室重塑及左心室泵功能。
总之,AMI后SNS、RAAS及心脏内分泌系统过度激活,促使心脏结构异变和心脏功能恶化,体现在BNP水平升高,而且升高的程度可以反映AMI的病情轻重。厄贝沙坦能够降低AMI后BNP水平,改善心室重塑程度及左心室内压力。因此,早期应用厄贝沙坦对AMI的治疗及预后大有裨益。
[1] MCMURRAY JJ,ADAMOPOULOS S,ANKER SD,et al.ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2012:the Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology.Developed in collaboration with the Heart Failure Association (HFA) of the ESC[J].Eur J Heart Fail,2012,14(8):803-869.
[2] TOPOL EJ.Nesiritide-not verified[J].N Engl J Med,2005,353(2):113-116.
[3] O′CONNOR CM,STARLING RC,HERNANDEZ AF,et al.Effect of nesiritide in patients with acute decompensated heart failure[J].N Engl J Med,2011,365(1):32-43.
[4] PLEISTER AP,BALIGA RR,HAAS GJ,et al.Acute study of clinical effectiveness of nesiritide in decompensated heart failure:nesiritide redux[J].Curr Heart Fail Rep,2011,8(3):226-232.
[5] NIKOLAOU NI,KYRIAKIDES ZS,TSAGLIS EP,et al.Early brain natriuretic peptide increase reflects acute myocardial ischemia in patients with ongoing chest pain[J].Int J Cardiol,2005,101(2):223-229.
[6] BROCH K,EEK C,WERGELAND R,et al.NT-proBNP predicts myocardial recovery after non-ST-elevation acute coronary syndrome[J].Scand Cardiovasc J,2012,46(2):65-71.
[7] ARAKAWA N,NAKAMURA M,AOKI H,et al.Relationship between plasma level of brain natriuretic peptide and myocardial infarct size[J].Cardiology,1994,85(5):334-340.
[8] HEESCHEN C,HAMM CW,MITROVIC V,et al.N-terminal pro-B-type natriuretic peptide levels for dynamic risk stratification of patients with acute coronary syndromes[J].Circulation,2004,110(20):3206-3212.
[9] SPINALE FG,COKER ML,BOND BR,et al.Myocardiol matrix degradation and metalloproteinase activation in the failing heart:a potential therapeutic target[J].Cardiovas Res,2000,46(2):225-238.
[10] DETEN A,HÖLZL A,LEICHT M,et al.Changes in extracellular matrix and in transforming growth factor beta isoforms after coronary artery ligation in rats [J].J Mol Cell Cardiol,2001,33(6):1191-1207.
[11] JUGDUTT BI,JOLJART MJ,KHAN MI.Rate of collagen deposition during healing and ventricular remodeling after myocardial infarction in rat and dog models[J].Circulation,1996,94(1):94-101.
