LIF诱导小鼠胚胎后肾间充质细胞分化形成肾上皮细胞
2014-03-14唐国华屈丽华
唐国华 ,屈丽华
(1.南华大学生命科学研究中心,湖南衡阳421001;2.南华大学医学院组织学与胚胎学教研室)
肾脏是人体重要的器官,不仅能分泌尿液、排泄代谢废物,还具有调节血压、体液平衡,以及骨骼密度的功能。全球有10%的慢性肾脏疾病患者进展为慢性肾功能不全、尿毒症,是导致人类死亡的主要原因之一[1-2]。国内外学者们一直致力于研究肾脏发育的分子机制,并试图利用干细胞移植,修复肾脏损伤,重建终末期肾病患者肾脏的功能。
胚胎后肾间充质细胞是一种多潜能干细胞,研究表明它能分化形成肾上皮细胞[3-4]。因此,利用后肾间充质细胞移植治疗很可能成为改善急性肾小管坏死预后的重要方法[4-5]。白血病抑制因子(leukemia inhibitory factor,LIF)是一类细胞因子,最早发现于小鼠KrebsⅡ腹水瘤细胞条件培养液中,能诱导白血病细胞株M1细胞向正常细胞分化[6]。已有研究报道LIF能诱导神经前体细胞分化为星形胶质细胞、少突神经胶质细胞及感觉神经元[7-8];JAKSTAT信号介导的LIF受体激活是形成上皮小管所必需[9-10],提示LIF在细胞分化过程中具有重要作用。本文分离并鉴定后肾间充质细胞,利用体外细胞培养技术,在培养液中加入细胞因子LIF进行诱导,用免疫荧光染色和RT-PCR检测后肾间充质细胞分化形成肾上皮细胞过程中的形态学和基因表达变化,旨在阐明后肾间充质细胞分化形成上皮细胞过程中的生物学特性变化,理解肾脏发生和发育过程,为肾脏组织工程学研究奠定理论基础。
1 材料与方法
1.1 材料
Balb/c小鼠(湖南斯莱克景达实验动物有限公司);兔多克隆抗体Pax2(1:250,Abcam),laminin α5(1:250,Abcam),anti-rabbit FITC(1:250,Santa Cruz);DMEM-LG培养基(Gibco);胎牛血清FBS(Gibco);胰酶(Amersco);转化生长因子(transforming growth factor alpha,TGF-α)(10 ng/mL,Boehringer Mannheim),成纤维细胞生长因子(fibroblast growth factor,FGF 2)(50 ng/mL,Boehringer Mannheim)和白血病抑制因子LIF(10 units/mL,Chemicon);RNeasy Mini Kit(Qiagen);SupercriptⅡRNase H-Reverse Transcriptase(Invitrogen);引物(Invitrogen);VECTASHIELD Fluorescent Mounting Media(Vector Laboratories)。
1.2 方法
1.2.1 后肾间充质细胞的分离和培养 取孕11.5天Balb/c雌鼠(以发现阴栓当日为受孕0.5天),断颈处死,在解剖显微镜下剥离胎盘,获取E11.5小鼠胚胎。未分化的后肾间充质细胞位于胚胎后肢的后1/3处,即输尿管的背侧,输尿管芽向背部延伸处[11]。在小鼠前肢下方横向剪断,沿胚胎神经管纵向剪开,截断尾部;根据后肾位置及其形状分离得到胚胎后肾间充质组织,去除输尿管芽 (图1);将解剖分离后组织置于4℃预冷的DMEM清洗备用。

图1 分离后肾间充质组织解剖示意图 A:沿虚线,即从胚胎前肢的下方横向剪断;B:沿神经管纵向剪开,并截去尾部,使输尿管暴露于视野下;C:未分化的后肾间充质细胞(MM)位于胚胎后肢的后1/3处,即输尿管芽向背部延伸处
1.2.2 后肾间充质细胞的培养和分化诱导 将解剖分离的后肾组织在胶原酶溶液中(DMEM+10%FBS+0.2%胶原酶 +50 IU/mL DNase)37℃孵育15 min;残存后肾组织以0.25%胰酶/0.02%EDTA(1:1)室温消化至组织块消失;加入含10%FBS的DMEM,1 000 r/min离心5 min;弃上清,含10%FBS的DMEM重悬细胞,细胞浓度调整至5×104/cm2,放入37℃、含5%CO2、饱和湿度的培养箱中培养。分别加入生长刺激因子 TGF-α(10 ng/mL)、FGF 2(50 ng/mL)和LIF(10 units/mL),以诱导后肾间充质细胞分化形成肾上皮细胞[3,12-14]。
1.2.3 后肾间充质细胞的鉴定 将解剖分离好的后肾间充质组织或者涂有后肾间充质细胞的玻片放在4%多聚甲醛固定20 min;PBST(0.2%的Triton X-100)处理10 min,增加膜的通透性;含1%BSA的PBS封闭15 min;加入一抗Pax2(1:250,Abcam)或laminin α5(1:250,Abcam)4℃孵育过夜;PBS洗 3次,每次5 min;加入荧光素标记的二抗anti-rabbit FITC(1:250,Santa Cruz)室温下避光孵育1 h;PBS洗3次,每次5min;防荧光淬灭封片剂(VECTASHIELD)固定,荧光显微镜下观察。
1.2.4 RT-PCR分析 RNeasy Mini Kit试剂盒提取分离好的小鼠后肾间充质细胞RNA(见试剂盒抽提方法);分光光度计(Nanodrop)检测RNA的浓度和质量;SupercriptⅡRNase H-Reverse Transcriptase合成cDNA(500ngRNA每个反应)。引物序列如下:


2 结 果
2.1 小鼠后肾间充质组织的分离和鉴定
利用后肾间充质细胞标记基因Pax-2抗体,对解剖分离得到的后肾组织进行染色,免疫组化分析表明小鼠后肾间充质组织定位正确(图2)。
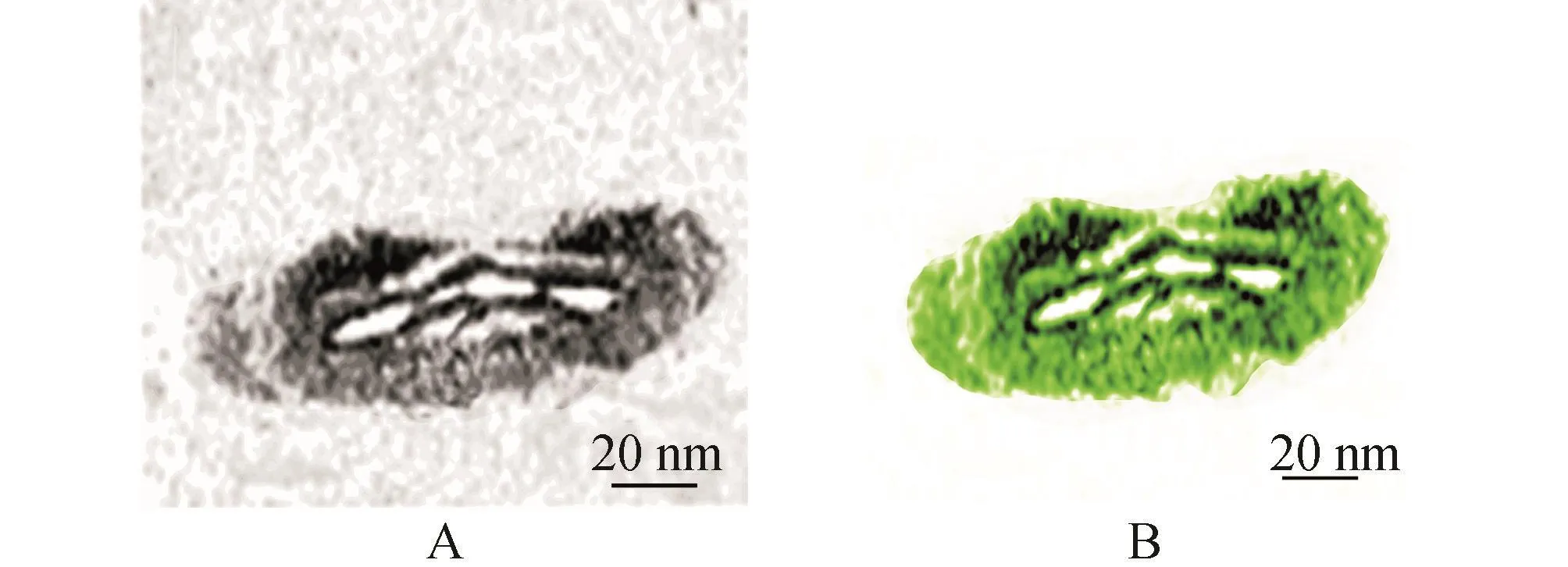
图2 Pax2抗体鉴定后肾间充质组织 A:普通光学显微镜观察;B:荧光显微镜剥离E12.5胚胎中的后肾间充质组织,兔多克隆抗体Pax2染色,表达阳性
2.2 后肾间充质细胞的分化诱导
分离的后肾间充质组织经胶原酶和胰酶消化形成单一、悬浮的后肾间充质细胞。用免疫荧光染色检测上皮细胞基底膜极性蛋白laminin α5的表达情况。结果显示:FGF2/TGF-α培养48 h,基底膜极性蛋白laminin α5不表达,细胞无极性且排列紊乱,表明细胞还未被诱导分化为上皮细胞(图3A,3D)。加入LIF培养48 h,laminin α5蛋白开始表达,细胞成簇,具有顶端膜等上皮细胞的特点,细胞由原来的无规则排列增殖形成“S”或“C”型小体样的链状结构 (图3B,3E)。LIF诱导1周后,细胞簇进一步发育形成具有连续基底膜包围的肾小管或者肾小球结构(图3C,3F)。
RT-PCR结果显示:加入FGF2、TGF-a培养48 h后,Wt1、Pax2和Wnt4等与细胞聚集形成相关的蛋白在后肾间充质细胞中有表达,早期的上皮胶原蛋白CollagenⅣ在这个时期也有表达,而特异性上皮细胞标记蛋白E-cadherin,laminin α5以及足细胞标记蛋白podocalyxin不表达;加入LIF诱导培养48 h后,细胞粘性蛋白 E-cadherin以及基质蛋白lamininα5开始表达,而足细胞的标志蛋白podocalyxin则在诱导1周后,才有表达,标志着肾小球开始形成(图4)。
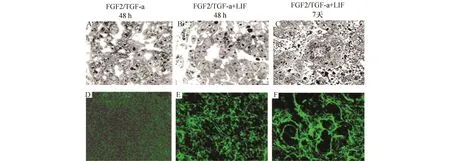
图3 LIF诱导后肾间充质细胞分化为上皮细胞的生物形态学变化 A-C:普通光学显微镜观察;D-F:荧光显微镜.A,D:FGF2/TGF-a处理培养后肾间充质细胞48 h,细胞呈不规则排列,laminin α5不表达;B,E:FGF2/TGF-a/LIF处理培养后肾间充质细胞48 h,细胞呈链状排列,伴随着基质膜蛋白laminin α5的表达;C,F:由基质膜蛋白laminin α5包围,细胞开始形成管状和早期的肾小球结构
3 讨 论
后肾间充质细胞是肾脏的多能干细胞,经过间充质-上皮细胞的分化过程,形成极性细胞,最终能分化为肾单位[3,15-16]。肾单位是肾脏的结构和功能单位。因此,利用后肾间充质细胞治疗肾脏疾病成为国际研究焦点。

图4 RT-PCR检测后肾间充质细胞分化形成上皮细胞过程中的基因表达变化
肾脏发育过程中,肾单位上皮细胞的形成是受各种不同细胞之间信号相互作用。该相互作用包括输尿管芽、后肾间充质细胞和肾基质三者之间的网络调控[16-21]。本实验分离了上皮始祖细胞(即后肾间充质细胞),直接采用上皮细胞发育所需的生长因子处理,使得复杂的调控网络简单化。转化生长因子(TGF-a)和成纤维细胞生长因子(FGF)是保持细胞正常生长和增殖,并保证细胞分化为上皮细胞所必需的刺激因子。若无上述刺激因子,后肾间充质细胞会出现凋亡现象[22];加入FGF2/TGF-a处理,后肾间充质细胞至少能存活1周以上,但并不能诱导分化形成上皮细胞[3,23]。而白血病抑制因子(LIF)是后肾间充质细胞分化为肾上皮细胞所必需的因子[12,14]。本实验中生长刺激因子作用对象为单一的上皮始祖细胞,排除了输尿管芽或者肾基质对后肾间充质作用的干扰,研究了转录调控子(Pax-2,WT-1),细胞基质蛋白 (E-cadherin,lamininα5,CollagenⅣ),糖蛋白(Podocalyxinn),信号分子(Wnt4)与肾上皮细胞各个发育阶段之间的直接关系,解决了细胞示踪技术不成熟这一难题。
本实验利用LIF诱导单一后肾间充质细胞的模型,对后肾间充质分化为上皮细胞的生物学特性进行了研究。laminin α5免疫荧光染色结果显示,无LIF处理,后肾间充质细胞不能分化形成上皮细胞;加入LIF刺激,无规则排列的细胞增殖聚集 (图3A,3D),形成“S”或“C”型小体样的链状结构 (图3B,3E),进一步发育形成连续基底膜包围的肾小管或者肾小球结构 (图3C,3F)。本实验还发现,在TGF-a和 FGF诱导下,后肾间充质细胞高表达Pax2、WT-1、Wnt4和CollagenⅣ,使得后肾间充质细胞区别于其他间质细胞[24-26]。CollagenⅣ的高表达标志着后肾间充质细胞已经在向上皮细胞转化[24]。但是E-cadherin,lamininα5,podocalyxin等细胞极性标记分子只有在加入刺激因子LIF后才开始表达,细胞极性标记分子的表达标志着肾小球的形成(图4)[27-29]。综上所述,本课题组成功分离了后肾间充质细胞,证实了LIF能诱导小鼠后肾间充质细胞分化为肾小囊和肾小管上皮细胞,LIF诱导细胞分化过程中伴随细胞极性标记分子基因的高表达,本研究为阐明肾脏发生发育的分子机制及慢性肾脏疾病的细胞治疗法提供了理论依据。
[1]Hadaya K,de Rham C,Bandelier C,et al.Natural killer cell receptor repertoire and their ligands,and the risk of CMV infection after kidney transplantation[J].Am J Transplant,2008,8(12):2674-2683.
[2]Coresh J,Levey AS,Levin A,et al.A stable definition of chronic kidney disease improves knowledge and patient care[J].BMJ,2013,347(11):5553.
[3]Karavanova ID,Dove LF,Resau JH,et al.Conditioned medium from a rat ureteric bud cell line in combination with bFGF induces complete differentiation of isolated metanephric mesenchyme[J].Development,1996,122(12):4159-4167.
[4]Villanueva S,Ewertz E,Carrion F,et al.Mesenchymal stem cell injection ameliorates chronic renal failure in a rat model[J].Clin Sci(Lond),2011,121(11):489-499.
[5]Yokote S,Yokoo T.Organogenesis for kidney regeneration[J].Curr Opin Organ Transplant,2013,18(2):186-190.
[6]Metcalf D,Hilton D,Nicola N.Clonal analysis of the actions of the murine leukemia inhibitory factor on leukemic and normal murine hemopoietic cells[M].Leukemia,1988,2(4):216.
[7]Bonni A,Sun Y,Nadal-Vicens M,et al.Regulation of gliogenesis in the central nervous system by the JAKSTAT signaling pathway[J].Science,1997,278(5337):477-483.
[8]Murphy M,Reid K,Hilton DJ,et al.Generation of sensory neurons is stimulated by leukemia inhibitory factor[J].PNAS,1991,88(8):3498-3501.
[9]Boccaccio C,Andò M,Tamagnone L,et al.Induction of epithelial tubules by growth factor HGF depends on the STAT pathway[J].Nature,1998,391(6664):285-288.
[10]Sierra-Honigmann MRo,Nath AK,Murakami C,et al.Biological action of leptin as an angiogenic factor[J].Science,1998,281(5383):1683-1686.
[11]Challen GA,Martinez G,Davis MJ,et al.Identifying the molecular phenotype of renal progenitor cells[J].J Am Soc Nephrol,2004,15(9):2344-2357.
[12]Barasch J,Yang J,Ware CB,et al.Mesenchymal to epithelial conversion in rat metanephros is induced by LIF[J].Cell,1999,99(4):377-386.
[13]Oliver JA,Barasch J,Yang J,et al.Metanephric mesenchyme contains embryonic renal stem cells[J].Am J Physiol Renal Physiol,2002,283(4):799-809.
[14]Plisov SY,Yoshino K,Dove LF,et al.TGF beta 2,LIF and FGF2 cooperate to induce nephrogenesis[J].Development,2001,128(7):1045-1057.
[15]Yang J,Blum A,Novak T,et al.An epithelial precursor is regulated by the ureteric bud and by the renal stroma[J].Dev Biol,2002,246(2):296-310.
[16]Chai OH,Song CH,Park SK,et al.Molecular regulation of kidney development[J].Anat Cell Biol,2013,46(1):19-31.
[17]Barasch J,Qiao J,McWilliams G,et al.Ureteric bud cells secrete multiple factors,including bFGF,which rescue renal progenitors from apoptosis[J].Am J Physiol Renal Physiol,1997,273(5):757-767.
[18]Grobstein C.Inductive interaction in the development of the mouse metanephros[J].J Exp Zool,1955,130(2):319-339.
[19]Schuchardt A,D'Agati V,Larsson-Blomberg L,et al.Defects in the kidney and enteric nervous system of mice lacking the tyrosine kinase receptor Ret[J].Nature,1994,273(5):380-383.
[20]Barasch J,Yang J,Qiao J,et al.Tissue inhibitor of metalloproteinase-2 stimulates mesenchymal growth and regulates epithelial branching during morphogenesis of the rat metanephros[J].J Clin Inves,1999,103(9):1299-1307.
[21]Barasch J.Genes and proteins involved in mesenchymal to epithelial transition[J].Curr Opin Nephrol Hypertens,2001,10(3):429.
[22]Koseki C,Herzlinger D,al-Awqati Q.Apoptosis in metanephric development[J].J Cell Biol,1992,119(5):1327-1333.
[23]Barasch J,Pressler L,Connor J,et al.A ureteric bud cell line induces nephrogenesis in two steps by two distinct signals[J].Am J Physiol Renal Physiol,1996,271(1):50-61.
[24]Dudley AT,Godin RE,Robertson EJ.Interaction between FGF and BMP signaling pathways regulates development of metanephric mesenchyme[J].Genes Dev,1999,13(12):1601-1613.
[25]Zhou TB.Signaling pathways of PAX2 and its role in renal interstitial fibrosis and glomerulosclerosis[J].J Recept Signal Transduct Res,2012,32(6):298-303.
[26]Hou XM,Chen X,Wang YL.The role of Pax2 in regulation of kidney development and kidney disease[J].Yi Chuan,2011,33(9):931-938.
[27]Mori K,Yang J,Barasch J.Ureteric bud controls multiple steps in the conversion of mesenchyme to epithelia[J].Semin Cell Dev Biol,2003,14(4):209-216.
[28]Miner JH,Li C.Defective glomerulogenesis in the absence of laminin α5 demonstrates a developmental role for the kidney glomerular basement membrane[J].Dev Biol,2000,217(2):278-289.
[29]Piepenhagen PA,Nelson WJ.Biogenesis of polarized epithelial cells during kidney development in situ:roles of E-cadherin-mediated cell-cell adhesion and membrane cytoskeleton organization[J].Mol Biology Cell,1998,9(11):3161-3177.
