重组抗人表皮生长因子受体(EGFR)嵌合单克隆抗体CH225非还原电泳纯度分析
2014-03-13付换成卢秋丽刘浩张文秋赵云
付换成卢秋丽刘浩张文秋赵云
重组抗人表皮生长因子受体(EGFR)嵌合单克隆抗体CH225非还原电泳纯度分析
付换成①卢秋丽①刘浩②张文秋③赵云①
目的:分析CH225在非还原电泳时抗体条带主条带以外在高分子量和低分子量产生杂条带的原因。方法:在不同的供试品缓冲液和不同电泳条件下进行SDS-PAGE电泳比较。结果:上样前100 ℃煮样1 min与加碘乙酰胺结果相同。结论:高分子量和低分子量杂条带可以用电泳上样前100 ℃煮样1 min消除即可。
非还原SDS-PAGE; 重组单抗; EGFR; 重组抗人表皮生长因子受体
药品生产过程中,重组蛋白类药物的质量检测和控制十分重要,SDS-PAGE(聚丙烯酰胺凝胶电泳)是蛋白类药物的纯度分析的常用手段[1-2]。CH225(重组抗人表皮生长因子受体(EGFR)嵌合单克隆抗体)是四川恒星生物制药有限公司采用基因工程技术,利用NS/0细胞表达的人源化抗体,属于IgG1亚型,已用于转移性结直肠癌、头颈癌等多种癌症的治疗,并且现有研究表明可能适用于鼻咽癌、肺癌等其他癌症的治疗[3-4]。在CH225的临床前研发,质量检测的过程中发现,除抗体主条带以外,还存在一些分子量大小不同的杂条带,特别在非还原性实验中,情况尤为明显。本文采用不同温度和不同试剂的条件下对样品进行预处理,比较最佳的SDS-PAGE结果,为CH225批量生产的质量检测和控制提供参考和依据。
1 材料与方法
1.1 药品 参比品(批号C201105002):四川恒星生物制药有限公司于2011年5月第2批生产的CH225注射液;对照品(批号C201107006):四川恒星生物制药有限公司于2011年7月第6批生产的CH225注射液;爱比妥(Erbitux):通用名西妥昔单抗(cetuximab),默克公司生产。
1.2 主要试剂和仪器 SDS-PAGE电泳装置和扫描仪为Bio-Rad公司产品;水为超纯水,其余试剂均为分析纯。
1.3 缓冲液的配制 还原型SDS-PAGE供试品缓冲液(2×):0.12 mol/L Tris-HCl,20%甘油,0.1%溴酚蓝,4% SDS,200 mmol/L DTT;非还原型SDS-PAGE供试品缓冲液(2×):0.12 mol/L Tris-HCl,20%甘油,0.1%溴酚蓝,4% SDS;天然供试品缓冲液(2×):0.12 mol/L Tris-HCl,20%甘油,0.1%溴酚蓝;加碘乙酰胺的非还原SDS-PAGE供试品缓冲液(2×):向上述非还原SDS-PAGE供试品缓冲液中加入新鲜配制的1 mol/L碘乙酰胺母液,至终浓度为200 mmol/L。
1.4 实验过程
1.4.1 70 ℃与100 ℃水浴非还原SDS-PAGE分析C201105002(参比品)、稀释至2 mg/mL与2×非还原SDS-PAGE供试品缓冲液等体积混合,70 ℃分别水浴1、3、5 min后,立即转入冰浴。另取相同样品加入与2×非还原SDS-PAGE供试品缓冲液等体积混合,100 ℃分别水浴1、3、5 min,立即转入冰浴。再取相同样品加入2×非还原SDS-PAGE供试品缓冲液等体积混合,不经水浴。分离胶浓度8.0%,10 μL/孔上样,100 V电压开始电泳,待指示剂前沿进入分离胶后,电压改为150 V。电泳结束后,凝胶用考马斯亮蓝R250染色[5]。
1.4.2 普通非还原SDS-PAGE与天然SDS-PAGE分析 C201105002(参比品)和Erbitux样品均稀释至2 mg/mL与2×非还原SDS-PAGE供试品缓冲液等体积混合,分别70 ℃水浴3 min、100 ℃水浴1 min后,立即转入冰浴。分离胶浓度8.0%,10 μL/孔上样,100 V开始电泳,待指示剂前沿进入分离胶后,电压改为150 V。另取相同样品加入天然供试品缓冲液后不进行加热变性处理,直接进行SDS-PAGE电泳。再取相同样品加入2×非还原SDS-PAGE供试品缓冲液等体积混合,不经水浴进行电泳。电泳结束后,凝胶用考马斯亮蓝R250染色[5]。
1.4.3 添加碘乙酰胺的非还原SDS-PAGE分析C201105002(参比品)、C201107006和Erbitux样品均稀释至2 mg/mL,分别加入2×非还原SDS-PAGE供试品缓冲液或加碘乙酰胺的2×非还原SDS-PAGE供试品缓冲液,混匀后,70 ℃水浴3 min。分离胶浓度8.0%,上样量10 μL,采用室温条件下150 V恒压电泳。电泳结束后,SDS-PAGE凝胶用考马斯亮蓝R250染色[1]。
2 结果
2.1 70 ℃与100 ℃不同时间水浴非还原SDS-PAGE分析 70 ℃分别处理1、2、3 min的样品电泳结果的相对分子量小的次带依次减少,70 ℃ 3 min相对分子量小的次带已基本不可见;100 ℃ 1、2、3 min时相对分子量小的次带有增加趋势,100 ℃ 1 min时相对分子质量小的次带已基本消失;未经水浴的条带出现多个杂的相对分子低的次带。表明对样品进行70 ℃ 3min或者100 ℃ 1 min的水浴处理对减少相对分子小的次带有较好的效果,见图1。
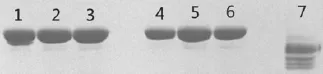
图1 70 ℃与100 ℃不同时间水浴非还原SDS-PAGE
2.2 普通非还原SDS-PAGE与天然SDS-PAGE分析 未经水浴的样品中相对分子量大和相对分子量小的杂条带比较明显;对样品进行过预处理的电泳结果条带单一;而对样品未经预处理的天然SDS-PAGE电泳结果出现弥散状条带,见图2。
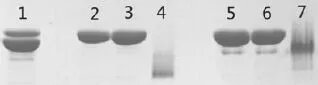
图2 普通非还原SDS-PAGE与天然SDS-PAGE
2.3 添加碘乙酰胺的非还原SDS-PAGE分析 爱比妥、C201107006、参比品在添加碘乙酰胺的情况下都比其没有添加碘乙酰胺的相对分子量小的次带要少得多;添加碘乙酰胺的样品和未添加碘乙酰胺但经过100 ℃ 1 min水浴的样品的相对分子量小的次带都明显减少;在70 ℃ 3min煮样后再添加碘乙酰胺对减少相对分子量小的次带基本没有效果,见图3。

图3 添加碘乙酰胺与未添加碘乙酰胺的非还原SDS-PAGE
3 讨论
由以上实验,可推测,电泳中低分子量条带可能由这些原因导致:在基因表达过程中,抗体分子内存在自由巯基,这些自由疏基因为无法形成完整的二硫键,轻链和重链之间只能由非共价键的作用力连接[6-7];在电泳时样品的加热变性处理或未经处理的过程中(如图2),轻链和重链之间的非共价键断裂,因此而导致产生了一些游离的抗体分子亚基,从而出现了低相对分子质量条带[8];另外,在电泳时样品的加热变性处理的条件下,抗体分子的自由巯基还可能会引发二硫键重排,导致部分链间二硫键断裂,增加低相对分子质量条带出现的几率[9-10]。
高分子量聚体带产生的可能原因是,在加热变性处理的过程中,抗体分子间的自由巯基通过缩合形成分子间二硫键,从而将单体的抗体分子连接成分子聚体,出现聚体带[7-9]。碘乙酰胺可以保证蛋白质样品完全变性并保持还原状态,可以对蛋白质分子中的自由巯基进行封闭,以阻止二硫键重排的反应以及自由巯基重新形成二硫键,从而抑制电泳次带的产生[8,11-12]。封闭自由巯基后的非还原SDS-PAGE结果显示,如图3中所示,高相对分子量的聚体带基本消失,低相对分子量带显著减少,证明非还原SDS-PAGE结果中出现的次带是在电泳样品变性处理过程中因有自由巯基的存在而产生的。
综上实验结果,鉴于100 ℃煮样1 min情况下,加不加碘乙酰胺对次带形成影响不大,因此以后CH225项目质量检测的SDS-PAGE实验采用100 ℃煮样1 min,不加碘乙酰胺的预处理方案。
[1]程立均,魏敬双,张世雄,等.重组单抗药物的非还原电泳纯度分析[J].中国生物制品学杂志,2010,23(1):83-86.
[2] Chan A T C,Hsu M M,Goh B C,et al.Multicenter,phase Ⅱ study of cetuximab in combination with carboplatin in patients with recurrent or metastatic nasopharyngeal carcinoma[J].Journal of clinical oncology,2005,23(15):3568-3576.
[3] Borghaei H,Aggarwal C.Rational use of cetuximab in the treatment of advanced non-small cell lung cancer[J].Onco Targets and Therapy,2009(2):251.
[4]郭尧君.蛋白质电泳实验技术[M].北京:科学出版社,2005:1-5.
[5] Liu H,Gaza-Bulseco G,Chumsae C,et al.Characterization of lower molecular weight artifact bands of recombinant monoclonal IgG1 antibodies on non-reducing SDS-PAGE[J].Biotechnol Lett,2007,29 (11):1611-1622.
[6] Zhang W,Czupryn M J.Free sulfhydryl in recombinant monoclonal antibodies[J].Biotechnol Progress,2002,18(3):509-513.
[7] Taylor F R,Prentice H L,Garber E A,et al.Suppression of sodium dodecyl sulfate-polyacrylamide gel electrophoresis sample preparation artifacts for analysis of IgG4 half-antibody[J].Anal Biochem,2006,353(2):204-208.
[8] Liu H,Gaza-Bulseco G,Chumsae C,et al.Characterization of lower molecular weight artifact bands of recombinant monoclonal IgG1 antibodies on non-reducing SDS-PAGE[J].Biotechnol Lett,2007,29 (11):1611-1622.
[9] Liu H,May K.Disulfide bond structures of IgG molecules:structural variations,chemical modifications and possible impacts to stability and biological function[C].MAbs.Landes Bioscience,2012,4(1):17.
[10] Zhang L,Chou C P,Moo-Young M.Disulfide bond formation and its impact on the biological activity and stability of recombinant therapeutic proteins produced by Escherichia coli expression system[J].Biotechnology Advances,2011,29(6):923-929.
[11] Zhu Z C,Chen Y,Ackerman M S,et al.Investigation of monoclonal antibody fragmentation artifacts in non-reducing SDS-PAGE[J]. Journal of Pharmaceutical and Biomedical Analysis,2013,33(83):89-95.
Analysis of the Recombinant Monoclonal EGFR Antibody (CH225) on non-reducing SDS-PAGE
/FU Huan-cheng,LU Qiu-li,LIU Hao,et al.//Medical Innovation of China,2014,11(15):028-030
Objective:To analyze the non-Reduced SDS-PAGE purity of monoclonal antibody CH225 and the reason of the appearance of bands with a lower or a higher molecular weight.Method:The EGFR samples were treated with various loading buffers and various conditions for SDS-PAGE.Result:The result of incubation of 100℃ for 1 min appeared the same to the result with iodoacetamide added.Conclusion:The appearance of the bands with a lower or a higher molecular weight may be eliminated by incubation of 100 ℃ for 1 min for SDS-PAGE.
Non-Reduced SDS-PAGE; Recombinant monoclonal antibody; EGFR; Recombinant EGFR antibody
10.3969/j.issn.1674-4985.2014.15.010
2014-03-03)(本文编辑:欧丽)
①四川大学生命科学学院 四川 成都 610064
②四川恒星生物制药有限公司
③四川大学华西药学院
赵云
First-author’s address:College of Life Science in Sichuan University,Chengdu 610064,China
