叶绿酸铁对硝酸盐胁迫下黄瓜幼苗渗透调节物质及抗氧化酶活性的影响
2014-03-13,2*,2,3,2,2
,2*,2,3,2,2
(1山东农业大学园艺科学与工程学院,山东泰安 271018;2作物生物学国家重点实验室,山东泰安271018;3农业部黄淮海设施农业工程科学观测实验站,山东泰安 271018)
叶绿酸铁对硝酸盐胁迫下黄瓜幼苗渗透调节物质及抗氧化酶活性的影响
张 蒙1王秀峰1,2*魏 珉1,2,3杨凤娟1,2史庆华1,2李 岩1
(1山东农业大学园艺科学与工程学院,山东泰安 271018;2作物生物学国家重点实验室,山东泰安271018;3农业部黄淮海设施农业工程科学观测实验站,山东泰安 271018)
采用营养液栽培,研究硝酸盐胁迫下喷施10 mg·L-1叶绿酸铁溶液对黄瓜幼苗生长、脯氨酸、可溶性糖、丙二醛含量及抗氧化酶活性的影响。结果表明:硝酸盐胁迫下叶面喷施叶绿酸铁可以缓解硝酸盐对黄瓜幼苗生长的抑制,减少叶片中脯氨酸、可溶性糖、丙二醛含量,提高超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)及抗坏血酸过氧化物酶(APX)活性。喷施叶绿酸铁可以在一定程度上减少硝酸盐胁迫下叶片中活性氧的积累,抑制膜脂过氧化,从而缓解硝酸盐胁迫对黄瓜幼苗的伤害。
叶绿酸铁; 硝酸盐胁迫; 渗透调节物质; 抗氧化酶
近年来,我国设施栽培生产发展迅速,但设施内特有的小气候特点,如地温高、蒸发旺盛、无雨水冲淋,以及施肥量过大且偏施化肥等不当的栽培管理,导致温室土壤次生盐渍化加重,限制了我国设施农业的生产(童有为和陈淡飞,1991;张真和和李建伟,2000)。黄瓜是我国设施栽培中的一种主栽蔬菜,对盐胁迫较为敏感,尤其是发芽期和幼苗期,因此提高黄瓜苗期的耐盐性对于培育壮苗、提高黄瓜产量具有重要意义。
叶绿酸(chlorophyllin)是叶绿素水解脱除疏水性植醇侧链而生成的一种绿色衍生物。Kamat等(2000)在大鼠肝细胞线粒体体外试验中发现叶绿酸能有效抑制活性氧(ROS,reactive oxygen species)导致的膜的脂质过氧化,从而保护线粒体免遭氧化损伤。蒋慧等(2011)研究表明,盐胁迫下营养液供应叶绿酸铁在绿豆叶片氧化损伤的保护、提高活性氧清除酶的活性以及提高脯氨酸含量等方面均有明显作用。
本试验以黄瓜(Cucumis sativus L.)品种津优1号为试材,研究叶面喷施叶绿酸铁对硝酸盐胁迫下黄瓜幼苗生长、渗透调节物质含量及抗氧化酶活性的影响,探讨叶绿酸铁能否提高黄瓜幼苗的耐盐性,成为缓解硝酸盐胁迫的新途径。
1 材料与方法
1.1试验材料
试验于2012年9~12月在山东农业大学玻璃温室内进行,供试黄瓜品种为津优1号。选取饱满、整齐一致的种子,按常规方法浸种催芽,挑选发芽整齐的种子,播于装有沙子的育苗盘中。子叶展平后,浇灌营养液,待幼苗长至二叶一心时,选取生长一致的健壮幼苗移栽到含10 L全营养液的塑料盆中,每盆8株,用充氧机充气。 营养液中大量元素参照山崎配方,微量元素参照常规配方,调节营养液pH值为6.5±0.1。
1.2试验处理
待幼苗长至三叶一心时开始处理,试验中所采用的叶绿酸铁溶液浓度由预备试验筛选得出。试验共设3个处理。对照(CK):常规营养液;硝酸盐胁迫处理(T1):缓解硝酸盐处理(T2):胁迫的同时,叶面喷施10 mg·L-1叶绿酸铁溶液。硝酸盐由和KNO3各50% 组成,分2次加入营养液中,中间间隔12 h,使浓度达到140 mmol·L-1。硝酸盐胁迫处理开始后,每天17:00 对T2处理的幼苗叶面喷施10 mg·L-1叶绿酸铁溶液,其他处理喷施等量蒸馏水,每处理3次重复,处理期间每3 d更换1次营养液。
1.3项目测定与方法
处理后5、10 d每处理随机取10株幼苗,分别测定各项指标。3次重复,取平均值。
可溶性糖含量根据向曙光(1989)的方法测定,脯氨酸含量采用Bates等(1999)的方法测定,MDA 含量采用Herth和Packe(r1986)的方法测定,超氧化物歧化酶(SOD)活性采用Stewart和Bewley(1980)的方法测定,过氧化氢酶(CAT)和过氧化物酶(POD)活性采用Cakmak和Marschner(1992)的方法测定,抗坏血酸过氧化物酶(APX)活性采用Nakano和Asada(1981)的方法测定。
1.4数据统计分析
采用Excel 2003和DPS 7.55软件对试验数据进行差异显著性分析。
2 结果与分析
2.1外源叶绿酸铁对硝酸盐胁迫下黄瓜幼苗生长的影响
由表1可以看出,处理5 d后,硝酸盐胁迫处理(T1)的黄瓜植株株高、叶面积及地上部干、鲜质量均显著低于对照;而喷施叶绿酸铁处理(T2)的各生长指标较T1明显升高,但T2处理除单株地上部干质量与对照差异不显著外,其他指标显著低于对照。处理10 d后,各处理的黄瓜植株株高、叶面积及地上部干、鲜质量均比处理5 d时有明显的增加,各处理间的差异趋势与处理5 d时一致,T1处理的黄瓜植株株高、叶面积及地上部干、鲜质量仍显著低于对照,T2处理的各生长指标除单株地上部干质量外,均显著高于T1处理,表明叶绿酸铁缓解了硝酸盐胁迫对黄瓜幼苗生长的抑制。

表1外源叶绿酸铁对硝酸盐胁迫下黄瓜幼苗生长的影响
2.2外源叶绿酸铁对硝酸盐胁迫下黄瓜幼苗可溶性糖含量的影响
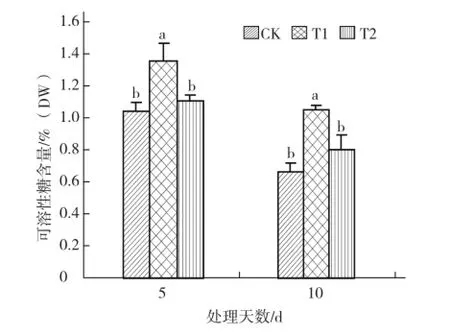
图1外源叶绿酸铁对硝酸盐胁迫下黄瓜幼苗可溶性糖含量的影响
由图1 可以看出,处理5 d后,硝酸盐胁迫处理(T1)的可溶性糖含量显著高于对照,而喷施叶绿酸铁处理(T2)的可溶性糖含量较T1显著降低,但比对照稍有增加。处理10 d后,各处理的可溶性糖含量均比处理5 d时降低,各处理间的差异趋势与处理5 d时一致。表明叶绿酸铁缓解硝酸盐胁迫的效果明显。
2.3外源叶绿酸铁对硝酸盐胁迫下黄瓜幼苗脯氨酸含量的影响
由图2可以看出,处理5 d后,硝酸盐胁迫处理(T1)的脯氨酸含量高出对照1倍之多,而喷施叶绿酸铁处理(T2)的脯氨酸含量比T1显著减少,表现出明显缓解硝酸盐胁迫的效果。处理10 d后,各处理的脯氨酸含量比处理5 d时有所降低,但对照降低的量较小,T1和T2降低的量明显。处理10 d时,由T1和T2脯氨酸含量的显著差异,仍能看出喷施叶绿酸铁对硝酸盐胁迫的缓解效果。
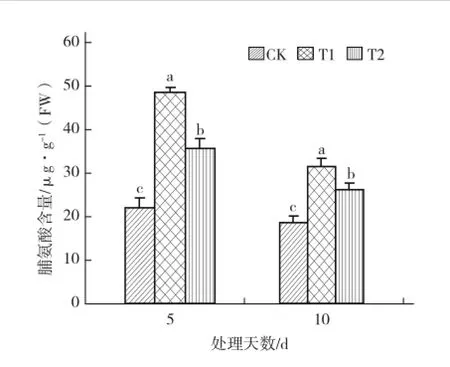
图2外源叶绿酸铁对硝酸盐胁迫下黄瓜幼苗脯氨酸含量的影响
2.4外源叶绿酸铁对硝酸盐胁迫下黄瓜幼苗丙二醛含量的影响
由图3可以看出,处理5 d后,硝酸盐胁迫处理(T1)的丙二醛(MDA)含量显著高于对照,而喷施叶绿酸铁处理(T2)的丙二醛含量较T1显著降低,但仍高于对照。处理10 d后,各处理间表现出与处理5 d时一致的差异趋势,T1和T2处理的丙二醛含量比处理5 d时有所增加,对照则无明显变化。处理期间,T2的丙二醛含量始终显著低于T1,可以看出喷施叶绿酸铁能降低膜脂过氧化,缓解硝酸盐胁迫对黄瓜幼苗细胞的伤害。

图3外源叶绿酸铁对硝酸盐胁迫下黄瓜幼苗丙二醛含量的影响
2.5外源叶绿酸铁对硝酸盐胁迫下黄瓜幼苗抗氧化酶活性的影响
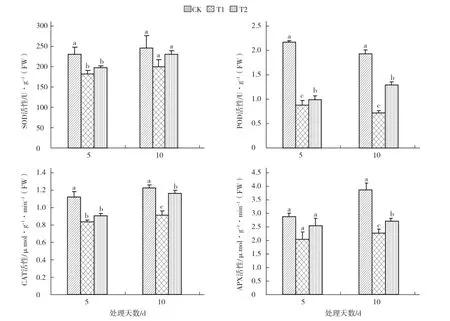
图4外源叶绿酸铁对硝酸盐胁迫下黄瓜幼苗抗氧化酶活性的影响
由图4可以看出,处理5 d后,4种抗氧化酶SOD、POD、CAT和APX活性均呈现出一致的差异趋势,硝酸盐胁迫处理(T1)的黄瓜叶片中各抗氧化酶活性均明显低于对照,POD活性较对照降低幅度最大,而喷施叶绿酸铁处理(T2)的各抗氧化酶活性均高于T1,但仍低于对照。处理10 d后,各处理黄瓜叶片的SOD、CAT和APX活性较处理5 d时升高,但对照与T1的POD活性降低,T1处理的各抗氧化酶活性仍明显低于对照,其中POD和APX活性降低幅度较大,T2处理的各抗氧化酶活性均明显高于T1,除SOD活性与T1差异不显著外,POD、CAT、APX活性均与T1差异显著。说明在硝酸盐胁迫下,喷施叶绿酸铁能使黄瓜叶片中的抗氧化酶活性仍保持在较高水平,有效缓解硝酸盐胁迫诱导产生的氧化胁迫。
3 结论与讨论
当植物遭受盐胁迫时,为调节细胞内渗透势、维持水分平衡,细胞内会积累一些物质,如脯氨酸、可溶性糖、可溶性蛋白、甜菜碱、多胺等(李玉全 等,2002)。140 mmol·L-1硝酸盐胁迫后,黄瓜叶片及根系的可溶性糖含量显著增加(李小刚,2011),黄瓜幼苗叶片中脯氨酸含量增加(王秀红,2011)。王玉祥和张博(2009)研究指出,苜蓿体内的可溶性糖含量随着NaCl浓度的增加而增加。顾大形和陈双林(2011)研究发现:随着NaCl浓度的增加,四季竹叶片中脯氨酸含量不断提高。前人研究表明,植物体内脯氨酸和可溶性糖含量与其所受到的胁迫程度成正比。本试验中,黄瓜幼苗经140 mmol ·L-1硝酸盐胁迫处理后,叶片中脯氨酸及可溶性糖的含量显著提高,但喷施叶绿酸铁溶液后,作为渗透调节物质的脯氨酸和可溶性糖含量显著降低,则表明叶绿酸铁缓解了高浓度的硝酸盐对黄瓜幼苗造成的胁迫伤害。
研究发现,盐胁迫引起植株体内活性氧的大量积累,并造成细胞膜脂的过氧化损伤,细胞膜稳定性降低,透性增加(於丙军和刘友良,2003)。膜脂过氧化会使植株体内产生大量MDA,其含量在一定程度上可以反映细胞膜的受伤害程度。研究表明,硝酸盐胁迫使黄瓜幼苗叶片MDA含量、电解质渗漏率显著升高,膜脂过氧化程度加重(高清海等,2008;王秀红 等,2010),NaCl胁迫也会使黄瓜幼苗叶片和根系MDA含量、电解质渗漏率显著增加(徐玉伟 等,2010)。本试验在140 mmol·L-1硝酸盐胁迫下,黄瓜幼苗叶片中MDA含量显著增加,喷施10 mg·L-1的叶绿酸铁可以显著降低硝酸盐胁迫下黄瓜幼苗叶片中MDA含量,有效缓解膜脂过氧化的损伤。
在正常情况下,植物依靠自身的自由基清除系统保持细胞内的活性氧平衡,但在逆境胁迫下,活性氧平衡受到破坏,活性氧大量积累,此时,SOD、POD、CAT和APX等通过酶促作用清除体内产生的过量活性氧自由基。黄瓜植株受140 mmol·L-1硝酸盐胁迫后,黄瓜幼苗叶片SOD、POD活性升高,CAT和APX活性降低(杨凤娟,2006)。王秀红等(2010)研究表明,140 mmol·L-1硝酸盐胁迫处理后,黄瓜幼苗叶片SOD活性升高,POD、CAT和APX活性降低,焦娟等(2009)研究表明,140 mmol·L-1硝酸盐胁迫处理7 d后,各抗氧化酶活性均低于对照。但也有研究表明,NaCl胁迫处理后黄瓜叶片中抗氧化酶活性提高,随着处理时间的增加,酶活性有下降趋势但仍高于未受胁迫处理的叶片中的酶活性(韩冰 等,2010)。非生物胁迫对抗氧化酶的影响较复杂,这可能与试验材料种类、处理方式和时期、取样时期和部位等都有一定关系。本试验中,经140 mmol·L-1硝酸盐胁迫处理后,黄瓜叶片中SOD、POD、CAT和APX的活性均受到明显抑制,但喷施10 mg·L-1的叶绿酸铁可以明显提高硝酸盐胁迫后黄瓜叶片中SOD、POD、CAT和APX的活性,减少活性氧自由基的产生,从而提高了黄瓜幼苗对高浓度硝酸盐的耐性。
本试验结果表明,叶面喷施10 mg·L-1的叶绿酸铁可以减轻140 mmol·L-1硝酸盐胁迫对黄瓜幼苗的渗透伤害,提高黄瓜幼苗抗氧化酶活性,降低膜脂过氧化程度,在一定程度上缓解硝酸盐胁迫对黄瓜幼苗生长的抑制作用,但其作用机理还需进一步研究。
高青海,王秀峰,史庆华,杨凤娟.魏珉.2008.镧对硝酸盐胁迫下黄瓜幼苗生长及叶片抗氧化酶活性的影响.应用生态学报,19(5):976-980.
顾大形,陈双林.2011.四季竹对不同浓度NaCl胁迫的生理响应.西北植物学报,31(6):1209-1215.
韩冰,孙锦,郭世荣,金春燕.2010.钙对盐胁迫下黄瓜幼苗抗氧化系统的影响.园艺学报,37(12):1937-1943.
蒋慧,任勇,王一凡,童敏,陈黎明,张列峰.2011.叶绿酸铁对盐胁迫下绿豆幼苗生长和氧化损伤的影响.江苏农业科学,39(5):96 -99.
焦娟,王秀峰,杨凤娟,孙家正,魏珉,史庆华,王秀红.2009.外源一氧化氮对硝酸盐胁迫下黄瓜幼苗生长及抗氧化酶活性的影响.应用生态学报,20(12):3009-3014.
李玉全,张海艳,沈法富.2002.作物耐盐性的分子生物学研究进展.山东科学 ,15(2):8-15.
童有为,陈淡飞.1991.温室土壤次生盐渍化的形成和治理途径研究.园艺学报,18(2):159-162.
王秀红,王秀峰,杨凤娟,魏珉,史庆华,焦娟,刘全兴.2010.外源精胺对胁迫下黄瓜幼苗抗氧化酶活性及光合作用的影响.植物营养与肥料学报,16(4):1020-1026.
王玉祥,张博.2009.盐胁迫对苜蓿同工酶活性和可溶性糖的影响.新疆农业科学,6(3):589-591.
向曙光.1989.应用苯酚法测定植物组织中的碳水化合物.植物生理学通讯,25(2):42-44.
徐玉伟,郭世荣,程玉静,熊银锋,黄海桃.2010.Ca(NO3)2对盐胁迫下黄瓜幼苗生长及膜脂过氧化的影响.中国蔬菜,(4):14-18.
於丙军,刘友良.2003.盐胁迫对一年生盐生野大豆幼苗活性氧代谢的影响.西北植物学报,23(1):18-22.
张真和,李建伟.2000.我国设施蔬菜产业的发展态势及可持续发展对策探讨.沈阳农业大学学报,31(1 ):4-8.
Bates L S,Corpas F J,Carreras A,Sandalio L M,Valderrama R,Palma J M,Lupianez J A,del Rio L A.1999.Localization of nitric-oxide synthase in plant peroxisomes.The Journal of Biological Chemistry,274:36729-36733.
Cakmak I,Marschner H.1992.Magnesium deficiency and high light intensity enhance activities of superoxide dismutase,ascorbate peroxidase,and glutathione reductase in bean leaves.Plant Physiology,98:1222-1227.
Herth R L,Packer L.1986.Photoperoxidation in isolated chloroplasts: I.kinetics and stoichiometry of fatty acid peroxidation.Arch Biochem Biophys,125:189-198.
Kamat J P,Boloor K K,Devasagayam T P A.2000.Chlorophyllin as an effective antioxidant against membrane damage in vitro and ex vivo .Biochim Biophys Acta,1487(2 /3 ):113-127.
Nakano Y,Asada K.1981.Hydrogen peroxide scanvenged by ascorbate-specific peroxidase in spinach chloroplast.Plant and Cell Physiology,22:867-880.
Stewart R C,Bewley J D.1980.Lipid peroxidation associated with accelerated aging of soybean axes.Physiologia Plantarum,65: 245-248.
Effect of Chlorophyllin-iron on Osmoregulation Substance and Activities of Antioxidant Enzymes of Cucumber Seedling under Nitrate Stress
ZHANG Meng1,WANG Xiu-feng1,2*,WEI Min1,2,3,YANG Feng-juan1,2,LI Yan1
(1College of Horticulture Science and Engineering,Shandong Agricultural University,Tai’an 271018,Shandong,China;2State Key Laboratory of Crop biology,Tai’an 271018,Shandong,China;3Scientific Observing and Experimental Station of Environment Controlled Agricultural Engineering in Huang-Huai-Hai Region,Ministry of Agriculture, Tai’an 271018,Shandong,China)
A solution culture experiment was conducted to study the effect of exogenous spraying 10 mg·L-1chlorophyllin-iron solution at cucumber (Cucumis sativus L.)seedling leaves on the plant growth,contents of proline,soluble sugar,MDA and activity of peroxidase under nitrate stress. The results showed that exogenous spraying chlorophyllin-iron solution at leaves could relieve the inhibition of nitrate on cucumber seedling growth,decrease the contents of proline,soluble sugar,MDA,and increase the activities of SOD,POD,CAT and APX. Eexogenous spraying chlorophyllin-iron could to certain extent reduce the accumulation of active oxygen in leaves under nitrate stress, restrain lipid peroxidation,and therefore relieve the damage of nitrate stress on cucumber seedlings.
Chlorophyllin-iron;Nitrate stress;Osmoregulation substance;Antioxidant enzyme
张蒙,女,硕士研究生,专业方向:设施蔬菜与无土栽培,E-mail: zhangmeng19881208@126.com
*通讯作者(Corresponding author):王秀峰,男,教授,博士生导师,专业方向:设施园艺与无土栽培,E-mail:xfwang@sdau.edu.cn
2013-11-02;接受日期:2013-12-15
国家现代农业产业技术体系建设专项(CARS-25)
