常用血液净化方式对维持性血液透析患者残余肾功能的影响
2014-03-13
(南华大学附属第二医院肾内科,湖南衡阳421000)
残余肾功能(residual renal function,RRF)是指肾脏组织受损后,健存肾组织的滤过和内分泌功能,包括清除毒素、维持水电解质和酸碱平衡以及多种内分泌等多种生理功能[1],当RRF下降后,一系列的代谢紊乱、内分泌失调、体液失衡、营养不良、感染及心血管事件的发生率均增高。在慢性肾衰竭患者中RRF有着十分重要的意义,但令人遗憾的是进入透析的患者,特别是进入血液透析的患者,在多种因素共同作用下,随着时间推移,RRF都不可避免的下降。本研究回顾性分析采用3种常用血液净化方式进行维持性血液透析(maintenance hemodialysis,MHD)患者的临床资料,观察其治疗6个月后患者残余肾功能(RRF)的变化,现报道如下。
1 资料与方法
1.1 一般资料
回顾性选择2012年1月~2013年6月本院血液净化室维持性血液透析的尿毒症患者54例,男性38例,女性16例,平均46.7±16.4岁(18~76岁);其中慢性肾小球肾炎34例,高血压肾病9例,糖尿病肾病8例,梗阻性肾病2例,多囊肾1例。按照治疗方法分为低通量血液透析(1ow flux hemodialysis,LFHD)治疗组(LFHD组)、血液透析联合血液透析滤过(hemodialysis and hemodiafiltration,HD+HDF)治疗组(HD+HDF组)和血液透析联合血液灌流(hemodialysis and hemoperfusion,HD+HP)治疗组(HD+HP组),每组18例;3组患者年龄、性别、体质指数差异均无统计学意义(P>0.05),具有可比性。入选标准:(1)规律血透且透析时间均超过6个月;(2)均采用百特公司醋酸纤维膜透析器,血液透析滤过(hemodiafiltration,HDF)采用聚砜膜透析器;(3)透析过程中及透析间期无血压过高和或低血压现象发生;(4)无大量蛋白尿;(5)无肾毒性药物,避免食高蛋白及高脂饮食;(6)无感染、心力衰竭。
1.2 血液净化方式
LFHD组使用东丽TR-8000透析机,每周行血液透析3次,每次透析时间4 h。HD+HDF组每周行LFHD两次和HDF 1次;HDF选用日本东丽公司生产的TS-1.6UL透析器,在血液透析基础上,应用on-line容量控制超滤血滤机,每周进行1次血液透析滤过,时间4 h,前置换,置换液总量24 L。HD+HP组灌流器为丽珠医用生物材料厂生产的HA-130型树脂灌流器。每周行HD3次,每次4 h,每周1次血液透析开始时,在百特公司醋酸纤维膜透析器串联HA130血液灌流器,治疗2 h后撤去HA130血液灌流器,继续血液透析治疗至4 h。治疗时间2 h,2 h后取下灌流器继续治疗。3组患者均使用碳酸氢盐透析液,普通肝素抗凝,血流速250 mL/min,透析液流速500 mL/min,透析机均为东丽TR-8000透析机。
1.3 观察指标
血、尿标本于开始透析时、治疗6个月后分次采集;血尿肌酐、尿素于透析后及下次透析前检测;β2-微球蛋白(β2-microglobulin,β2-MG)、甲状旁腺激(parathyroid hormone,PTH)水平均在透析前检测。RRF通过公式KRU[2]2(UID×VID)/TID(Cpos+Cpre)计算;其中KRU代表残余肾尿素清除率(mL/min),UID代表透析间期收集尿液的尿素浓度(mmol/L),VID代表透析间期收集的尿量(mL),TID代表透析间期时间(min),Cpos代表透析后血尿素浓度(mmol/L),Cpre指透析前血尿素浓度(mmol/L);同样,也可用肌酐来计算RRF。本研究分别用肌酐、尿素氮计算RRF,然后取两者均值,代表RRF,以消除误差。
1.4 统计学方法
应用SPSS13.0统计软件包分析,数据均采用表示,组间比较采用单因素方差分析(one-way ANOVA)的S-N-K检验,自身前后比较采用配对t检验,以P<0.05为差异有显著性。
2 结 果
2.1 3组患者治疗前后RRF的比较
从表1可见,治疗前LFHD组、HD+HDF组及HD+HP组患者RRF差异无统计学意义(P>0.05);治疗6个月后3组RRF均明显下降,与治疗前比较差异均有统计学意义(P<0.05)。6个月后HD+HDF组及HD+HP组患者RRF下降明显低于LFHD组(P<0.05);HD+HDF及HD+HP组患者RRF差异无统计学意义(P>0.05)。
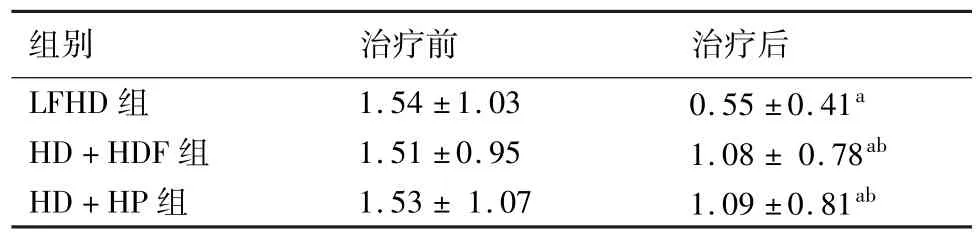
表1 3组患者治疗前、后残余肾功能(RRF)的比较(n=10,mL/min)
2.2 3组患者治疗前后β2-MG和PTH的比较
从表2可见,3组患者治疗前β2-MG及PTH水平差异无统计学意义(P>0.05)。与治疗前比较,HD+HDF组和HD+HP组β2-MG和PTH水平明显下降(P<0.05)。治疗6个月后HD+HDF组、HD+HP组β2-MG及PTH水平明显低于LFHD组(P<0.05);HD+HDF组和HD+HP组之间差异无统计学意义(P>0.05)。

表2 3组患者治疗前后β2-MG和PTH水平的比较(n=10)
3 讨 论
RRF与慢性肾衰竭患者的生存质量、营养状况及生存率等各个方面等密切相关,RRF在终末期肾衰竭患者发挥着清除溶质清除、维持水电解质平衡、改善钙磷代谢等重要作用;近年来大量研究表明,透析不能替代残余肾对尿毒症代谢产物的清除作用,RRF是减少透析并发症的前提[3]。最初RRF在腹膜透析领域研究较多,1995年Maiorca等[4]首次报道RRF是持续性腹膜透析(CAPD)患者存活率的独立危险因子,指出RRF有利于腹膜透析(PD)患者的长期生存。随后的CANUSA研究显示RRF都是腹膜透析患者病死率的预测因子,直接影响腹膜透析患者的生存率[5]。近几年对于血液透析,RRF的研究也逐步增多,证实RRF对于血液透析患者也起着同样重要的作用[6]。但进入血液透析的患者,RRF下降快速甚至完全消失,特别在开始进入透析的阶段,表现更为突出。其影响RRF的下降存在多种因素[7],包括原发病的进展、大量蛋白尿、肾毒性药物高蛋白饮食、高脂血症、高血压、血流动力学的改变、透析膜的生物相容性、透析液纯度、高低通量透析、高效透析消毒剂的使用及钙磷代谢紊乱等,这些因素相互影响,互为因果,加重RRF的丧失;正确认识维持性血液透析患者的RRF,加强对其保护,是目前临床要特别重视的问题。
本研究表明,治疗6个月后无论是LFHD组、HD+HDF组、HD+HP组都存在RRF的下降(P<0.05),但HD+HDF组及HD+HP组RRF下降明显低于LFHD组(P<0.05)。LFHD主要是以弥散的原理清除毒素,以小分子溶质为主,对中大分子溶质的清除效果差;HDF则以弥散和对流两种方式清除毒素,加大了对中分子及大分子溶质的清除,清除毒素更为充分;HP主要通过树脂吸附毒素,能有效清除中大分子溶质及体内炎症物质;HD+HDF及HD+HP治疗较LFHD治疗,清除体内毒素更为充分,提高透析充分性;同时本研究显示:治疗6个月后HD+HDF组、HD+HP组较 LFHD组患者,β2-MG、PTH水平明显降低(P<0.05);PTH是人体内钙磷代谢重要的调节激素,MHD病人PTH的增高可出现肾性骨病、皮肤瘙痒、异位钙化等系列临床表现,可导致心血管系统等多系统受损,可损伤患者的残余肾功能[8]。β2-MG是分子量为11.8 kDa的非糖蛋白多肽,其主要代谢部位是在肾脏,β2-MG的长期蓄积,可导致透析相关淀粉样变,疾病晚期可出现系统性沉积,是影响终末期肾脏病患者的一种严重并发症,可使患者进行性衰弱[9-10];HD+HDF组、HD+HP组清除β2-MG、PTH优于LFHD组。
综上所述,血液透析患者透析过程中RRF均有下降,但HD+HDF及HD+HP组RRF下降程度明显低于单纯HD组,可能与HDF和HP可以增加中大分子毒素的清除,提高透析充分性,改善钙磷代谢,而较LFHD能更好地保残余肾功能。但本研究入院患者数量较少,故需进一步严格按照随机、对照、双盲设计的多中心、大样本的长期临床研究追寻RRF下降的因素,寻找更有效的方法阻止和延缓RRF的下降。
[1] Liao CT,Chen YM,Shiao CC,et al.Rate of decline of residual renal function is associated with all-cause mortality and technique failure in patients on long-term peritoneal dialysis.[J].Nephrol Dial Transplant,2009,9,24(9):2909-2914.
[2] Singhal MK,Bhaskaran S,Vidgen E,et a1.Rate of decline of residual renal function in patients on continuous peritoneal dialysis and factors affecting it[J].Peritoneal Dialysis International,2000,20(4):429-438.
[3] 王丽妍,张东亮,刁宗礼,等.透析患者残余肾功能的保护[J].中国血液净化,2012,11(2):95-98.
[4] Maiorca R,Brunori G,Zubani R,et al.Predictive value of dialysis adequacy and nutritional indices for mortality and morbidity in CAPD and HD patients.A longitudinal study[J].Nephrology DialysisTransplantation,1995,10(12):2295-2305.
[5] Canada-USA(CANUSA)Peritoneal Dialysis Study Group.Adequacy of dialysis and nutrition in continuous peritoneal dialysis[J].J Am Soc Nephrol,1996,7:198-207.
[6] Termorshuizen F,Korevaar JC,Dekker FW,et al.The relative importance of residual renal function compared to peritoneal clearance for patient survival and quality of life:an analysis of The Netherlands Cooperative Study on the Adequacy of Dialysis(NECOSAD)-2[J].Am J Kidney Dis,2003,41:1293-1302.
[7] 王质刚.血液透析患者残余肾功能丢失机理的研究进展[J].肾脏病与透析肾移植杂志 ,1997,6(4):376-378.
[8] Chiroli S,Mattin C,Belozeroff V,et a1.Impact of mineral and bone disorder on healthcare resource use and associated costs in the European Fresenius medical care dialysis population:a retrospective cohort study[J].BMC Nephrol,2012,10(10):140-141.
[9] Penne EL,van der Weerd NC,Blankestijn PJ,et al.Role of residual kidney function and convective volume on change in beta2-microglobulin levels in hemodiafiltration patients[J].2010,5(1):80-86.
[10] 王海燕.慢性肾脏病骨代谢及其疾病的临床实践指南——指南10β2-微球蛋白淀粉样变性[J].中国血液净化,2006,5(6):343-346.
