不同温度条件下溶壁微球菌和白斑综合症病毒对凡纳滨对虾的致病性
2014-03-13杨绍文陈兆明孙成波
向 赟,王 刚,杨绍文,陈兆明,孙成波,2
(1.广东海洋大学水产学院,广东湛江 524025;2.广东高校热带海产无脊椎动物养殖工程技术研究中心,广东湛江 524025;3.广东海洋大学实验教学部,广东湛江 524025)
不同温度条件下溶壁微球菌和白斑综合症病毒对凡纳滨对虾的致病性
向 赟1,王 刚1,杨绍文1,陈兆明1,孙成波1,2
(1.广东海洋大学水产学院,广东湛江 524025;2.广东高校热带海产无脊椎动物养殖工程技术研究中心,广东湛江 524025;3.广东海洋大学实验教学部,广东湛江 524025)
研究在3种不同温度(19±1℃、25±1℃、31±1℃)条件下不同浓度的溶壁微球菌和白斑综合症病毒对凡纳滨对虾的致病性。通过单独及合并感染对虾记录其死亡率并检测病毒携带量。结果显示:温度19±1℃条件下,至实验结束各组累积死亡率和病毒携带量分别低于7.7%,8.6×102copy/g。温度25±1℃条件下,48~96 h单独感染WSSV累积死亡率与合并感染组差异显著(P<0.05),而且合并感染组不同浓度之间存显著差异(P<0.05),死亡率和病毒量最大值分别为71.1%,6.2×105copy/g(合并感染浓度9.5×107cfu/mL组)。温度31±1℃条件下,各组累积死亡率在48 h迅速升高,合并感染组死亡率和病毒携带量(最大值:75.6%,2.0×106copy/g)明显高于单独感染WSSV组(42.2%,2.2×104copy/g)。随着感染时间延长,单独细菌感染组对虾死亡率随感染浓度升高而升高(最大值:71.1%)。因此合并感染对对虾养殖危害更大,且随着温度升高,溶壁微球菌和合并感染的致病力随温度升高而升高,即温度能显著影响溶壁微球菌和WSSV的致病力。
温度;溶壁微球菌;白斑综合症病毒;凡纳滨对虾
凡纳滨对虾是全球3大对虾养殖品种之一[1]。但随着人工养殖规模扩大及密度越来越大,产生的一系列问题限制了对虾养殖业的发展,如养殖环境恶化,多种疾病爆发,种质退化等。其中疾病发生已给对虾养殖造成巨大损失,如白斑综合症、红体病、烂鳃病等[2-3]。白斑综合症是由一种宿主广泛,传染性强,对虾高致死性病毒--白斑综合症病毒(White spot syndrome virus,WSSV)引起。很多研究报道白斑综合症发生与虾体免疫水平,感染方式,环境因子等有关[4-5]。人工养殖过程中,养殖动物感染的病原体可能不仅仅只有一种,可能有两种或多种[6-8]。如水质恶化,会引起水体中细菌数量增多,极有可能发生二次感染。溶壁微球菌Micrococcus lysodeikticus属革兰氏阳性菌,是一种条件致病菌。且溶壁微球菌对对虾致病力较弱,国内关于溶壁微球菌与白斑综合症发生是否相关的研究较少,所以本文研究在不同温度条件下合并注射感染及单独注射感染WSSV和不同浓度的溶壁微球菌,探讨在不同温度条件下溶壁微球菌和WSSV对凡纳滨对虾的致病性,对对虾养殖健康可持续发展有重要指导意义。
1 材料与方法
1.1 实验材料
1.1.1 健康对虾来源
健康凡纳滨对虾取自广东海洋大学东海岛海洋生物研究基地,体长为8.61±0.39 cm。实验前随机抽取10尾对虾进行荧光定量PCR检测,检测结果为阴性。实验前暂养5 d,投喂对虾人工配合饵料2次/日,换水1次/d,日换水量接近100%。
1.1.2 WSSV粗提液制备
取感染WSSV症状明显的凡纳滨对虾,去除甲壳,按1:1(W∶V)加入高盐PBS,冰浴中匀浆,将匀浆液于4℃、7 000 r/min离心15 min;离心后的上清液加入蔗糖至终浓度为30%(W/W),4℃、16 000 r/min超速离心50 min,弃上清,沉淀用PBS(pH 7.4)重悬,将重悬液用0.45 μm的滤膜过滤,分装后-80℃冰箱保存。
1.1.3 菌株
对虾病原菌-溶壁微球菌,由西北农林科技大学刘小林教授实验室提供,经接种、活化培养24 h后,用无菌PBS缓冲液稀释制备菌悬液菌。
1.1.4 DNA模板提取和引物设计
DNA模板提取方法参照SUN等[9]的方法,PCR引物参照YOU等[10]的引物设计,由上海生工生物工程技术服务有限公司合成。
1.2 实验方法
1.2.1 感染方式
本实验采用人工注射感染,在凡纳滨对虾第2腹节与第3腹肌之间往心脏方向注射40 μl病原缓冲液,3种合并感染注射液含病毒粒子浓度都为3.2×102copy/μL,含溶壁微球菌浓度分别为9.5×107cfu/mL、9.5×106cfu/mL、9.5×105cfu/mL;单独感染注射液:含3.2×102copy/μL的病毒稀释液,3种含9.5×107cfu/ mL、9.5×106cfu/mL、9.5×105cfu/mL的溶壁微球菌菌悬液。
1.2.2 温度对感染不同浓度溶壁微球菌和WSSV的凡纳滨对虾的影响
将实验对虾分别培养在19±1℃、25±1℃、31±1℃有60 L水的0.1 m3塑料桶中,实验组分为合并感染组(合并感染WSSV与溶壁微球菌)与单独感染组(单独感染WSSV,单独感染3种浓度的溶壁微球菌),各组均设置3个平行,每组对虾各30尾,对照组注射40 μl PBS缓冲液。实验中投喂对虾人工配合饵料2次/日,24 h充气,定时吸出排泄物,日换水量20%。及时取出死亡对虾放入-20℃冰箱保存。各组在感染后0 h、6 h、12 h、24 h、48 h、72 h、96 h取样保存。观察记录对虾发病及死亡率,定期检测对虾组织中病毒含量,并对死亡对虾进行病毒检测。
1.2.3 病毒检测方法
病毒检测采用荧光定量PCR方法参考程晓燕等[11]。
2 实验结果
2.1 温度19±1℃下WSSV和溶壁微球菌对凡纳滨对虾的致病性
2.1.1 温度19±1℃下感染WSSV和溶壁微球菌的凡纳滨对虾死亡情况
当温度为19±1℃时,单独感染不同浓度的溶壁微球菌和WSSV与合并感染两种病原对凡纳滨对虾的累积死亡率影响不大,至实验结束各组累积死亡率低于最大值7.7%,如图1。

图1 19±1℃下对感染溶壁微球菌和WSSV的凡纳滨对虾的影响Fig.1 Impact of M.lysodeikticus and WSSV infected L.vannamei at 19±1℃
2.1.2 温度19±1℃下感染不同浓度溶壁微球菌对凡纳滨对虾携带WSSV的影响
在温度19±1℃条件下,整个实验过程中单独感染WSSV对虾体内携带病毒量与合并感染组无显著差异(P>0.05),各组病毒携带量都低于8.6×102copy/g,见表1。

表1 温度19±1℃下感染不同细菌浓度对凡纳滨对虾体内病毒携带量的影响Tab.1 Effects on amount of virus in L.vannamei by infected different concentrations of bacterial at 19±1℃
2.2 温度25±1℃下WSSV和溶壁微球菌的凡纳滨对虾的致病性
2.2.1 温度25±1℃下感染WSSV和溶壁微球菌的凡纳滨对虾死亡情况
在温度25±1℃条件下,整个实验过程中0~24 h各组的累积死亡率低于2.0%,几乎没有死亡,至48 h单独感染WSSV组对虾累积死亡率最大为21.0%显著高于其他组(P<0.05);至72 h出现差异变化,单独感染WSSV组累积死亡率50.0%和合并感染浓度为9.5×107cfu/mL的56.7%显著高于其他组(P<0.05),细菌单独感染组浓度为9.5×107cfu/mL(20.0%)明显高于其它细菌单独感染浓度组的累积死亡率(5.6%)(P<0.05)。至96 h细菌单独感染浓度为9.5×107cfu/ml显著高于其他细菌单独感染,所有感染WSSV组与未感染WSSV之间存在显著差异,如图2。

图2 温度25±1℃下对感染WSSV和溶壁微球菌凡纳滨对虾的影响Fig.2 Impact of M.lysodeikticus and WSSV infected L.vannamei at 25±1℃
2.2.2 温度25±1℃下感染溶壁微球菌对凡纳滨对虾携带WSSV的影响
在温度25±1℃条件下,整个实验过程中,单独感染WSSV对虾体内携带病毒量与合并感染组在24 h、48 h、96 h存在显著差异(P<0.05),在72 h合并感染浓度为9.5×107cfu/mL组与另两合并感染组存在显著差异,72 h单独感染WSSV组对虾体内携带病毒量与合并感染组不存在显著差异,见表2。

表2 温度25±1℃下感染不同细菌浓度对凡纳滨对虾体内病毒携带量的影响Tab.2 Effects on amount of virus in L.Vannamei by infected different concentrations of bacterial at 25±1℃
2.3 温度31±1℃下WSSV和溶壁微球菌对凡纳滨对虾的致病性
2.3.1 温度31±1℃下感染WSSV和溶壁微球菌的凡纳滨对虾死亡情况
在温度31±1℃条件下,0~24 h各组的累积死亡率低于5.6%,至48 h合并感染组浓度为9.5×105cfu/mL、9.5×106cfu/mL的累积死亡率明显高于单独感染WSSV组和细菌单独感染浓度为9.5×105cfu/mL、9.5×106cfu/ mL,显著低于细菌单独感染浓度为9.5×107cfu/mL(50.0%)及合并感染浓度为9.5×107cfu/mL(48.9%);至72 h单独细菌感染组累积死亡率升高,单独感染WSSV组和单独细菌感染浓度为9.5×105cfu/mL都显著低于其它感染组(P<0.05),且其它感染组之间无显著差异。至96 h单独感染WSSV组累积死亡率显著低于所有细菌感染组(P<0.05),合并感染浓度为9.5×107cfu/mL组累积死亡率达到最大值75.6%,见图3。
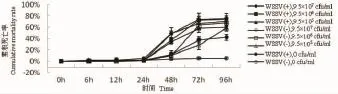
图3 温度31±1℃对感染WSSV和溶壁微球菌的凡纳滨对虾的影响Fig.3 Impact of M.lysodeikticus and WSSV infected L.vannamei at 31±1℃
2.3.2 温度31±1℃下感染溶壁微球菌对凡纳滨对虾携带WSSV的影响
在温度31±1℃条件下,整个实验过程中,至12 h单独感染WSSV组病毒携带量明显低于合并感染浓度为9.5×107cfu/mL、9.5×106cfu/mL组(P<0.05),24 h时合并感染浓度为9.5×107cfu/mL、9.5×106cfu/mL组与合并感染浓度为9.5×105cfu/mL组、单独感染WSSV组存在显著差异(P<0.05),至48 h病毒携带量迅速增加,各组之间无显著差异,72~96 h病毒携带量维持在较高水平,见表3。

表3 温度31±1℃下感染不同细菌浓度对凡纳滨对虾体内病毒携带量的影响Tab.3 Effects on amount of virus in L.vannamei by infected different concentrations of bacterial at 31±1℃
3 讨论
随着凡纳滨对虾养殖业快速发展,伴随的一系列问题不容忽视,尤其是病害问题,如在表面健康无明显症状的对虾体内能检测到WSSV,且在夏季对虾体内病毒携带量高于秋季[12]。对虾养殖中也出现WSSV和致病弧菌合并感染现象,如SELVIN等[13]在感染WSSV对虾体内分离到致病性鳗弧菌。温度不仅直接影响对虾的新陈代谢、抗病能力、进食、生存发育,还对病毒及弧菌在对虾体内增殖有重要影响。如对虾偷死综合症一般发生在养殖60 d后,且多在高温季节暴发,尤其在蜕壳期间极易发生,在低温和养殖前期危害不大[14]。
在温度为19±1℃条件下,各组对虾累积死亡率和病毒含量都很低,累积死亡率低于7.7%,病毒含量低于8.6×102copy/g。说明在低温19±1℃条件下,WSSV和溶壁微球菌的增殖都受到了抑制,溶壁微球菌致病力与感染剂量无关,属于潜伏感染,此结果与管越强等[15]报道当水温低于15℃对日本囊对虾体内WSSV的增殖情况相符,DU等[16]报道在低温10±1℃条件下虾体内病毒携带量明显低于24±1℃条件下病毒携带量。
在温度25±1℃条件下,0~24 h各组的累积死亡率低于2.0%(P>0.05),病毒携带量低于6.0×102copy/g,48 h单独感染WSSV组累积死亡(21.1%)和病毒含量(1.9×105copy/g)明显高于其他组。72 h后死亡加速,伴有死亡高峰(P<0.05),病毒含量随着合并感染浓度升高而提高,与累积死亡率结果相符。说明在温度25±1℃条件下,对虾感染病原体没有立即发病,有一定的潜伏期,但随着时间延长,死亡加快,病毒增殖也加快,合并感染组中病毒增殖受溶壁微球菌感染浓度影响显著(P<0.05),但前期比单独感染WSSV组病毒增殖要慢,有研究报道少量病原菌侵入对虾体内,酚氧化酶原系统被病原菌细胞壁的多糖激活,产生一种细胞毒杀作用[17],是否由于少量细菌入侵,短暂提高对虾免疫力,对WSSV初期增殖产生影响有待进一步研究。而且李侃等认为WSSV在对虾体内增殖速度受到感染初期病毒侵染对虾组织细胞能力高低的直接影响[18]。单独感染溶壁微球菌中发现溶壁微球菌数量达到产生毒力阀值所需时间因感染浓度不同而不同,因此温度25±1℃条件下,溶壁微球菌的致病力和WSSV在对虾体内增殖与溶壁微球菌感染浓度密切相关。
在温度31±1℃条件下,0~24 h各组的累积死亡率低于5.6%(P>0.05),但对虾体内病毒在12 h时出现增殖高峰期,明显高于单独感染WSSV组,48 h后合并感染组累积死亡率随溶壁微球菌感染浓度升高而升高,病毒含量同样高于单独感染WSSV组,说明在高温条件下,提高了合并感染中病原体对对虾的致死率,并大大缩短了发病时间。对比温度25±1℃条件下单独感染WSSV组结果可知在温度31±1℃下单独感染WSSV组对虾体内WSSV增殖受到一定程度的抑制,与研究报道在高温33℃条件下,可以延缓感染WSSV对虾发病,抑制WSSV在对虾体内增殖,降低死亡率相符[19-20]。合并感染组的病毒增殖情况刚好相反,温度31±1℃条件下整个实验中病毒在对虾体内增殖迅速,死亡率至48 h迅速升高。说明合并感染后,高温引起溶壁微球菌迅速增殖,并促使WSSV在对虾体内迅速增殖,现在对高温对WSSV增殖的抑制作用机理尚不清楚,高温可能引起感染宿主细胞加速凋亡[21];甲壳动物体内血细胞数会随着温度升高而增加,温度升高将激活酚氧化酶原系统,提高对虾免疫水平[22-24];高温能影响多数昆虫病毒复制的多个环节,推测高温也能影响WSSV复制的多个环节[25]。从单独感染溶壁微球菌组结果中发现在高温条件下,溶壁微球菌致病力明显提高,且发病时间随感染浓度升高而缩短,较温度25±1℃条件下结果,说明感染溶壁微球菌发病时间随温度升高而缩短。已有研究报道某些弧菌致病力随着温度升高而升高,同等温度条件下鳗弧菌感染剂量与感染程度密切相关,高温能提高对虾对鳗弧菌的易感性,大大缩短对虾的发病时间[26,27]。此结果也说明现在的连续养殖模式中,随着养殖规模不断扩大和养殖时间推移,引起水体富营养化加重,高温促使合并感染发生,引起对虾死亡。这可能也是目前华南地区中造虾变的难养的原因。
综上,本实验结果较好的解释目前对虾养殖生产中一些想象,如(1)冬棚养殖成功率较高,即低温状态下病毒和细菌增殖较慢,对虾病毒病和细菌病不容易暴发;(2)华南地区早、晚造虾发病率高,原因主要是因为春夏交替和夏秋交替时,温度较适宜WSSV等在对虾体内增殖,造成WSS暴发流行。(3)随着养殖规模不断扩大和养殖时间推移,引起水体富营养化加重,细菌容易大量繁殖,目前华南地区中造虾同样暴发病害,成功率较低,原因可能是在高温条件细菌与WSSV合并或继发感染,引起对虾发病,这一点也和本文研究结果相吻合,因此在今后的对虾养殖中,病害防治要同时防控病毒单一引发、细菌单一引发及病毒和细菌合并感染或继发感染3种情况。
[1]王吉桥.南美白对虾生物学研究与养殖[M].北京:海洋出版社,2003:146-148.
[2]陈爱平.2002年我国南美白对虾养殖及病害情况综述(中)[J].科学养鱼,2003(11):41-42.
[3]沈文英,阳会军,尹军霞.南美白对虾的病害及防治研究现状[J].水利渔业,2004,24(1):58-60.
[4]吴信忠.中国海洋病害主流研究的进展[J].太平洋学报,2005(10):49-59.
[5]孙成波,何建国,黎子兰,等.凡纳滨对虾和斑节对虾对WSSV敏感性的比较[J].湛江海洋大学学报,2006,26(3):17-20.
[6]MANIVANNAN S,OTTA S K,KARUNASAGAR I,et al.Multiple viral infection in Penaeus monodon shrimp postlarvae in an Indian hatchery[J].Diseases of aquatic organisms,2002,48(3):233-236.
[7]FLEGEL T W,NIELSEN L,THAMAVIT V,et al.Presence of multiple viruses in non-diseased,cultivated shrimp at harvest[J]. Aquaculture,2004,240(1):55-68.
[8]PHUOC L H,CORTEEL M,THANH N C,et al.Effect of dose and challenge routes of Vibrio spp.on co-infection with white spot syndrome virus in Penaeus vannamei[J].Aquaculture,2009,290(1):61-68.
[9]SUN Y,LI F,XIANG J.Analysis on the dynamic changes of the amount of WSSV in Chinese shrimp Fenneropenaeus chinensis during infection[J].Aquaculture,2013,376:124-132.
[10]YOU X,SU Y,MAO Y,et al.Effect of high water temperature on mortality,immune response and viral replication of WSSV-infected Marsupenaeus japonicus juveniles and adults[J].Aquaculture,2010,305(1):133-137.
[11]程晓燕,刘庆慧,黄 倢.实时荧光定量PCR检测对虾白斑综合症病毒方法的建立[J].安徽农业科学,2010,38(26):14 265-14 267.
[12]MENG X H,JANG I K,SEO H C,et al.A TaqMan real-time PCR assay for survey of white spot syndrome virus(WSSV)infections in Litopenaeus vannamei postlarvae and shrimp of farms in different grow-out seasons[J].Aquaculture,2010,310(1):32-37.
[13]SELVIN J,LIPTON A P.Vibrio alginolyticus associated with white spot disease of Penaeus monodon[J].Diseases of aquatic organisms,2003,57(1):147-150.
[14]孙成波.南美白对虾"偷死综合症"的病因分析及调控措施探讨[J].中国水产,2008(3):65-67.
[15]管越强.主要环境因子对养殖对虾抗病力及白斑综合症发生的影响[D].北京:中国科学院,2003.
[16]DU H,DAI W,HAN X,et al.Effect of low water temperature on viral replication of white spot syndrome virus in Procambarusclarkii[J].Aquaculture,2008,277(3):149-151.
[17]JOHANSSON M W,S?DERH?LL K.Exocytosis of the prophenoloxidase activating system from crayfish haemocytes[J].Journal of Comparative Physiology B,1985,156(2):175-181.
[18]李 侃,罗淑娅,徐丽美.温度影响对虾白斑综合症病毒增殖机制的研究[J].应用海洋学学报,2013(1):61-66.
[19]RAHMAN M M,CORTEEL M,WILLE M,et al.The effect of raising water temperature to 33°C in Penaeus vannamei juveniles at different stages of infection with white spot syndrome virus(WSSV)[J].Aquaculture,2007,272(1):240-245.
[20]DU H H,LI W F,XU Z R,et al.Effect of hyperthermia on the replication of white spot syndrome virus(WSSV)in Procambarus clarkii[J].Diseases of aquatic organisms,2006,71(2):175.
[21]GRANJA C B,ARANGUREN L F,VIDAL O M,et al.Does hyperthermia increase apoptosis in white spot syndrome virus (WSSV)-infected Litopenaeus vannamei[J].Diseases of aquatic organisms,2003,54(1):73-78.
[22]YEPIZ-PLASCENCIA G,VARGAS-ALBORES F,JIMENEZ-VEGA F,et al.Shrimp plasma HDL and β-glucan binding protein(BGBP):comparison of biochemical characteristics[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,1998,121(3):309-314.
[23]于建平.日本对虾血细胞分类,密度及组成[J].青岛海洋大学学报,1993,23(1):107-114.
[24]TRUSCOTT R,WHITE K N.The influence of metal and temperature stress on the immune system of crabs[J].Functional E-cology,1990:455-461.
[25]蒋杰贤,王冬生,曾爱平,等.温度对甜菜夜蛾核型多角体病毒流行的影响[J].生态学报,2004,24(8):1 724-1 730.
[26]谢珍玉,周永灿,冯永勤.对虾弧菌病的研究进展--回顾对虾弧菌病的病原种类,致病机制与条件,症状与组织病变及对虾的防御机制[J].海南大学学报:自然科学版,2007,25(1):88-95.
[27]邓 欢,王年斌,安育新.日本对虾Penaeus japanicus受弧菌感染的发病情况与感染剂量,温度条件的关系[J].水产科学, 1998,17(2):3-7.
The Pathogenicity of Micrococcus lysodeikticus and White Spot Syndrome Virus to Litopenaeus vannamei under Different Temperature Conditions
XIANG Yun,WANG Gang,YANG Shao-wen,et al
(Fisheries College,Guangdong Ocean University,Zhanjiang 524025,China)
Explored the pathogenicity of different concentrations of Micrococcus lysodeikticus and White Spot Syndrome Virus to Litopenaeus vannamei under three different temperature conditions(19±1℃,25±1℃, 31±1℃).The paper recorded the mortality and detect viral load in vannamei by singal or combined infection with two pathogens.The results showed that when the temperature was 19±1℃,the cumulative mortality andviral load of each group were respectively lower than 7.7%and 8.6×102copy/g;When the temperature was 25± 1℃,there was a significant difference between the WSSV single-infection group and co-infection group at 48-96 h(P<0.05),and there was also a remarkable disparity between co-infection group in different concentrations(P<0.05)with the maximum mortality and viral load of 7.7%and 6.2×105copy/g(under the concentration of 9.5×107cfu/mL).Under the condition of 31±1℃,the cumulative mortality of each group rose rapidly at 48 h. The mortality and virus carrying amount of co-infection group(max:75.6%,2.0×106copy/g)were obviously higher than the single-infection ones(42.2%,2.2×104copy/g).As the time of infection prolonged,the mortality caused by single-infection group grew with the increase of virus concentration(mortality max:71.1%).Therefore,coinfection is more harmful than single ones.What is more,the pathogenicity of M.lysodeikticus and co-infection group on L.vannamei′s breeding increase as the temperature goesd up,from which we learned that temperature could significantly affect the pathogenicity of M.lysodeikticus and WSSV.
temperature;Micrococcus lysodeikticus;White Spot Syndrome Virus;Litopenaeus vannamei
S945.4+9
A
1008-830X(2014)04-0304-07
2014-03-10
科技部星火计划重点项目(2010GA800008);广东省海洋渔业科技推广专项(A201301D02);湛江市自主创新企业科技创新项目(2011[79])
向赟(1987-),男,湖南怀化人,硕士研究生,研究方向:对虾养殖和病害防治.E-mail:x418312@126.com
孙成波(1970-),男,江苏赣榆人,博士,教授,研究方向:对虾养殖和病害防治.E-mail:suncb@gdou.edu
