Zn2+、Mn7+对刺参幼参的急性毒性及富集作用研究
2014-03-13马元庆邢红艳刘爱英白艳艳
李 斌,马元庆,邢红艳,靳 洋,刘爱英,白艳艳,孙 珊,张 娟,何 鑫
(山东省海洋水产研究所,山东省海洋生态修复重点实验室,山东烟台 264006)
Zn2+、Mn7+对刺参幼参的急性毒性及富集作用研究
李 斌,马元庆,邢红艳,靳 洋,刘爱英,白艳艳,孙 珊,张 娟,何 鑫
(山东省海洋水产研究所,山东省海洋生态修复重点实验室,山东烟台 264006)
在静水条件下,研究了Zn2+、Mn7+两种重金属离子对刺参幼参行为及其存活状况的影响,并分析了其在幼参体内的富集状况。结果表明:Zn2+、Mn7+单独处理时,幼参在Zn2+浓度低于0.4 mg/L或Mn7+浓度低于0.5 mg/L条件下暴露96 h后死亡率均为0.0%,表明在此对应浓度范围内两种金属离子均无明显的急性毒性作用;随浓度和暴露时间增加,幼参死亡率明显升高,其附壁率呈降低趋势。Zn2+对幼参的24、48、72 h的半致死浓度LC50分别为49.70、1.35、0.82 mg/L,安全浓度(SC)为0.14 mg/L;Mn7+对幼参的48、72、96 h的半致死浓度LC50分别为31.61、4.24、3.13 mg/L,SC为3.16 mg/L。因此,Zn2+对幼参的急性毒性作用强于Mn7+。随着水体中Zn2+与Mn7+浓度的增加,幼参体内重金属元素含量和累积速率总体呈升高趋势,而富集系数呈降低趋势,Zn2+的富集作用强于Mn7+。
刺参;Zn2+;Mn7+;急性毒性;富集作用
刺参Apostichopus japonicas Selenka,属棘皮动物门海参纲Holothurioidea,以海底藻类和浮游生物为食。近年来,刺参在我国北方沿海的人工养殖规模不断扩大。然而,由于养殖布局不合理,养殖密度过大以及盲目用药等使得水环境负荷增加[1-3];近岸水域重金属污染对养殖生物的生存环境造成了较大影响[4],影响刺参的养殖生产。与其他污染物相比,海洋生物对Zn(II)的富集能力很强,会长期残存在生物体内[5-8],海水中Zn(II)浓度过高会对生物产生一定的毒害作用,影响其生长和存活;金属盐类消毒剂高锰酸钾在苗种培育和水产养殖业中应用广泛,其强氧化性对草鱼Ctenopharyngodon idllus[9]、南美白对虾Penaeus vannamei[10]等养殖生物都具有一定毒性作用。在以往的研究中,有关重金属对海洋经济动物毒性作用的研究对象往往以鱼虾类居多[11-14],对刺参幼参的毒性作用研究报道并不多[4,15]尤其是Zn2+、Mn7+对幼参的联合毒性作用及其在幼参体内的富集。本文研究了+2价锌和+7价锰两种海水中常见的重金属对刺参幼参的急性毒性作用,并对其在刺参幼参体内的累积与富集状况进行了比较,旨在为评价刺参养殖环境和保护刺参资源提供科学依据,对改善养殖水环境、维持养殖业的可持续发展具有重要的意义。
1 材料与方法
1.1 供试动物
试验用幼参取自烟台海益苗业有限公司,为人工繁殖培育的5个月龄的幼参,个体体重为0.48±0.12 g。室内水泥池中暂养3 d后用于试验。每日全量换水,适量投喂配合饲料。试验时选择刺突明显、无化皮、无外伤、伸展自如的幼参随机分组。
1.2 试剂与海水
试验用硫酸锌(ZnSO4·7H2O)、高锰酸钾(KMnO4)均为国产分析纯试剂,先用超纯水配成含Zn2+和Mn7+分别为5 g/L和10 g/L的母液(以元素计),试验时稀释成所需要的各浓度。对照组不加试剂,其他条件与处理组相同。试验用海水取自烟台海益苗业有限公司,pH为7.9~8.1,盐度范围为33.6~34.6。
1.3 试验方法
试验设Zn2+、Mn7+浓度试验组各6个和1个空白对照组,每组设3个重复。Zn2+:0.2、0.4、0.8、1.0、2.5、5.0 mg/L;Mn7+:0.1、0.5、1.5、3.0、5.0、6.5 mg/L;联合毒性效应试验各组中Zn2+浓度设定为0.4 mg/L,将其混合添加到上述6个浓度梯度的Mn7+试验水体中。试验采用96 h静水实验法。试验容器为2 000 mL的玻璃烧杯,每个烧杯中放30只幼参。试验期间不投喂饵料、不充氧,水温为19.5~20.3℃,每隔24 h全量换水1次,换水后将各烧杯中的试剂调整到原始浓度。观察记录幼参暴露24 h、48 h、72 h和96 h的活动状况和附着在烧杯壁的个体数,计算附壁率;随时取出死亡个体,并记录各组的死亡个体数,计算死亡率。96 h,取低浓度组水样及存活的幼参个体测定其中的Zn2+、Mn7+含量,方法均采用原子吸收分光光度法。
1.4 数据处理
试验组取平行样结果的值计算死亡率和附壁率,按公式P=(p′-C)/(100-C)进行校正,式中:p′为试验组取双样平行结果的均值计算的死亡百分数,C为空白组死亡百分数,P为经校正后的试验组的死亡率;附壁率(AR)用以评价幼参的附着与活动能力,其计算公式为AR=100%×NA/30,式中:NA为附着在杯壁上的幼参个体数。
采用SPSS17.0作回归分析和显著性分析,并求得浓度-死亡率直线回归方程;采用概率单位法,根据死亡百分数-概率单位换算表,将死亡百分数换算成死亡概率单位,分别求出各种重金属对幼参48 h、72 h、96 h的半致死浓度(LC50)及其95%置信区间,并计算安全浓度(SC),SC=48 h LC50×0.1[16]。
重金属的富集系数(BCF)和累积速率(RA)[17]的计算公式分别为:BCF=(Ce-Ci)/Cs,其中,Ce为试验结束时幼参体内的重金属的含量,Ci为试验开始前幼参中重金属的背景值,Cs指水体中重金属的试验浓度;RA=(Ce-Ci)/t,t为暴露时间。
2 结果与讨论
2.1 Zn2+对幼参的急性毒性分析
从幼参的附壁率上可以看出,对照组高于试验组;随暴露时间的延长,附壁率呈先升高后降低的趋势,在0.4 mg/L浓度组附壁率值其他浓度组高(P<0.01),在96 h时附壁率达到最低;对比各处理浓度下,空白对照组附壁率值最大,浓度高于2.5 mg/L处理时间超过24 h时,附壁率将为0.0%,表现出对幼参活动能力的抑制作用(图1)。
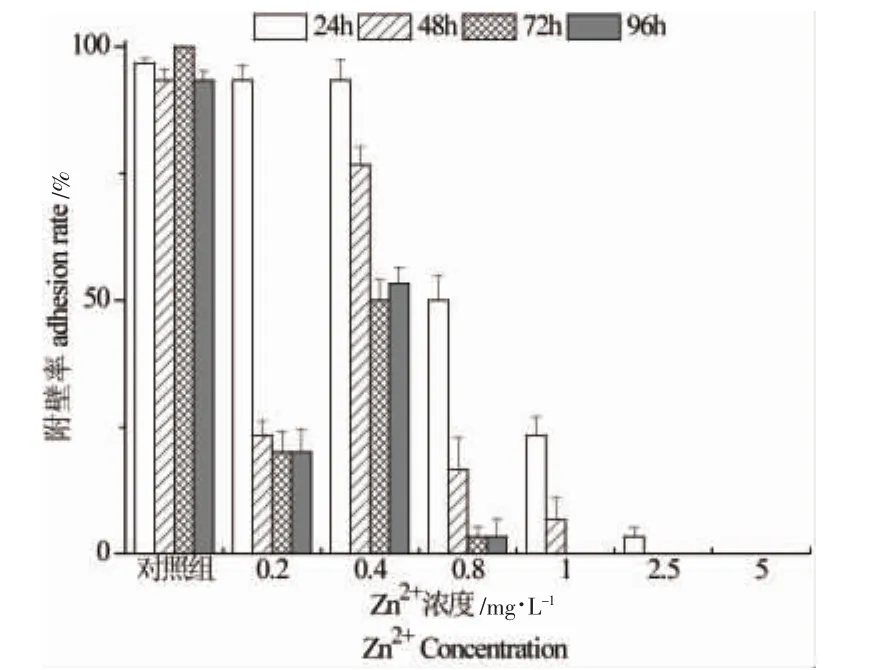
图1 Zn2+对幼参附壁率的影响Fig.1 Effect of Zn2+on adhesion rate in A.japonicas

图2 Zn2+对幼参死亡率的影响Fig.2 Effect of Zn2+on mortality rate in A.japonicas
图2为Zn2+对幼参死亡率的影响,可以看出:对照组、0.2 mg/L和0.4 mg/L Zn2+浓度组在暴露试验的96 h中均没有出现死亡现象,死亡率为0%;而0.8 mg/L浓度组幼参在试验的前48 h中出现个别死亡现象,处于一个缓慢生长的状态;试验进行到72 h时,幼参死亡数量不断增多;至96 h时出现明显的中毒症状,死亡率达到76.7%。表明Zn2+在低于0.4 mg/L的浓度范围内对幼参无明显急性毒性作用。随着Zn2+浓度的增大及暴露时间的延长,幼参死亡率呈现明显的升高趋势,急性毒性效应增强。
2.2 Mn7+对幼参的急性毒性
试验中,设置Mn7+的浓度范围为0.1~6.5 mg/L,幼参附壁率为空白对照组高于各处理组,随暴露时间的延长附壁率基本呈下降趋势(图3)。在暴露24 h、48 h时,低浓度组附壁率先升高后降低,即0.5 mg/L浓度组较0.1 mg/L有所升高,浓度高于1.5 mg/L后,附壁率;在浓度大于3 mg/L时,附壁率急剧下降,表现出对幼参活动能力的抑制作用;浓度大于5 mg/L,暴露时间超过24 h时附壁率降为0%(P<0.01)。

图4 Mn7+对幼参死亡率的影响Fig.4 Effect of Mn7+on mortality rate in A.japonicas
幼参的死亡率随Mn7+浓度和暴露时间增加而呈明显的升高趋势。浓度低于0.5 mg/L的试验组在暴露96 h时,幼参均未出现死亡现象;1.5 mg/L组死亡率96 h时才明显升高,且高浓度组死亡率随暴露时间变化明显。暴露24 h时,6.5 mg/L浓度组死亡率最高,为6.7%;48 h时,1.5~3.0 mg/L两浓度组的Mn7+对幼参死亡率的影响差异不显著(P>0.01);当浓度高于3.0 mg/L时,幼参死亡率明显升高,6.5 mg/L组(20.0%)最高(P>0.01);72 h和96 h时,当Mn7+浓度大于1.5 mg/L时,幼参死亡率明显升高。72 h时,5.0 mg/L浓度组幼参的死亡率最高,达70.0%;而96 h时,5.0 mg/L和6.5 mg/L两组死亡率均达到100%。
2.3 Zn2+-Mn7+对幼参的联合致毒效应
0.4 mg/L Zn2+分别与0.1 mg/L、0.5 mg/L、1.5 mg/L、3 mg/L、5 mg/L、6.5 mg/L Mn7+混合后,Zn2+-Mn7+的联合致毒效应表现为:随着Mn7+试验浓度的增大,幼参的附壁率总体呈降低趋势,且暴露时间越长,附壁率值越小(图5)。在暴露24 h、48 h时,低浓度组附壁率先升高后降低,均为0.4 mg/L Zn2+-0.5 mg/L Mn7+浓度组最大,与Mn7+独立试验的结果规律基本相同;在浓度大于3 mg/L时,附壁率急剧下降,暴露时间超过24 h时附壁率降为0。表现出Zn2+-Mn7+对幼参的联合效应在抑制幼参的活动能力方面较单独Zn2+或Mn7+作用更强。
从图6可以看出,幼参的死亡率随Mn7+浓度和暴露时间的增加而呈升高趋势。在试验期间,0.1 mg/L和0.5 mg/L浓度组内幼参均未出现死亡现象;1.5 mg/L浓度组在暴露96 h时6.7%的幼参出现死亡;浓度高于3.0 mg/L的高Mn7+浓度组死亡率随暴露时间变化明显,暴露时间延长,死亡率明显增大。暴露24 h时,仅在5.0 mg/L和6.5 mg/L浓度组内出现幼参死亡现象;48 h时,5.0 mg/L浓度组内幼参的死亡率最高,为33.3%;72 h和96 h时,5.0 mg/L和6.5 mg/L浓度组内幼参死亡率达到100%。
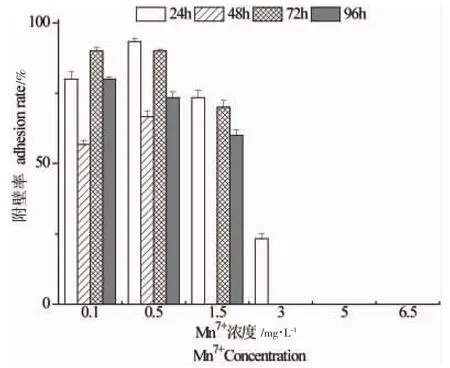
图5 Zn2+-Mn7+联合作用下幼参的附壁率Fig.5 The adhesion rate of A.japonicas exposed in Zn2+-Mn7+
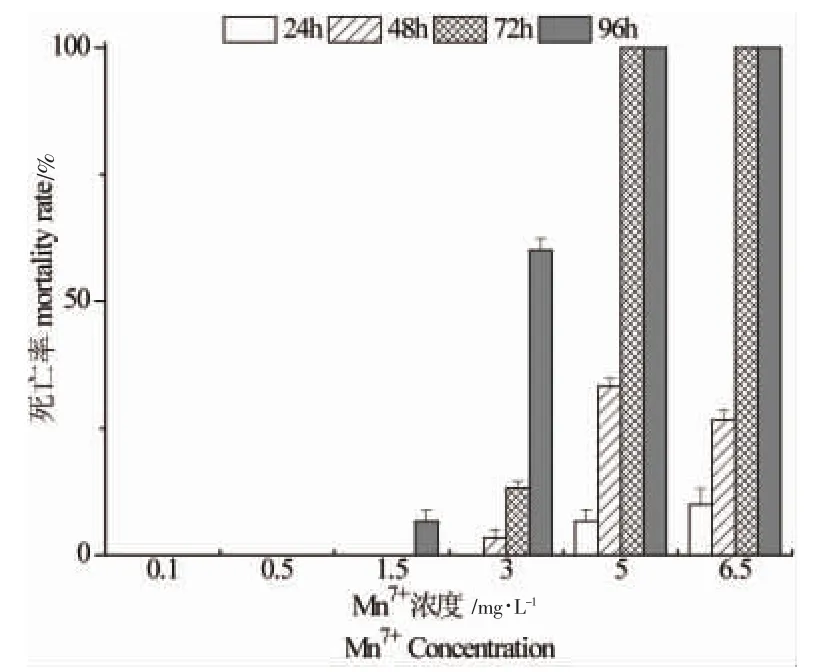
图6 Zn2+-Mn7+联合作用下幼参的死亡率Fig.6 The mortality rate of A.japonicas exposed in Zn2+-Mn7+
环境因子对刺参的生长和行为会产生或大或小的影响,而其研究报道却不多[18],特别是Zn2+-Mn7+的联合效应对刺参幼参存活与行为影响的研究鲜见报道。本研究通过分析发现,在独立Zn2+、Mn7+及Zn2+-Mn7+试验中,随处理时间的延长附壁率基本均呈先升高后降低的趋势,高值均出现在0.4 mg/L Zn2+和0.5 mg/L Mn7+浓度组内,试验期间内表现为一定的活动能力减弱,未出现急性致死现象。表明幼参对实验浓度下的Zn2+、Mn7+暴露具有一定的适应性,对低浓度的Zn2+、Mn7+可能存在某种程度上的毒物兴奋效应[19],但这种效应的生物学机理及其影响因素等有待深入研究。且Zn2+-Mn7+的联合毒性效应较Zn2+、Mn7+的单独作用明显增强。
2.4 Zn2+和Mn7+对幼参的急性毒性特征
通过计算得出,Zn2+对幼参的24 h、48 h、72 h半致死浓度分别49.70 mg/L、1.35 mg/L、0.82 mg/L,其安全浓度(SC)为0.14 mg/L;Mn7+的48 h、72 h、96 h半致死浓度分别为31.61 mg/L、4.24 mg/L、3.13 mg/L,SC为3.16 mg/L(表1)。
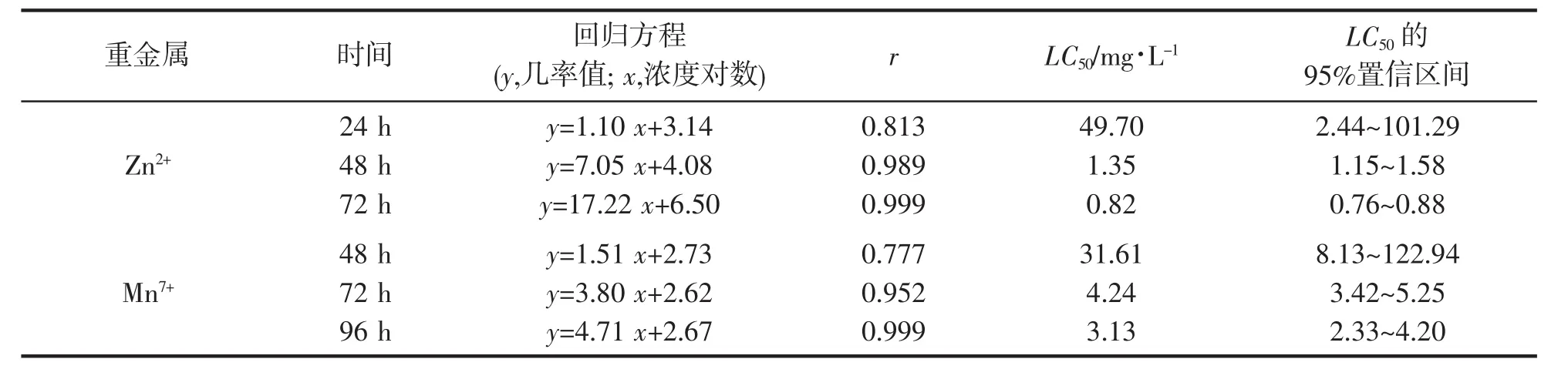
表1 重金属Zn2+、Mn7+对刺参幼参的急性毒性特征分析Tab.1 Analysis of acute toxicity of Zn2+,Mn7+on A.japonicas
在相同暴露时间下,Zn2+对幼参的半致死浓度较Mn7+小,急性毒性效应更为明显,故两种重金属对幼参的急性毒性强弱为:Zn2+>Mn7+。李君丰等[20]研究中采用Zn2+对仿刺参幼参的SC为0.15 mg/L,与本文计算结果相差不大,高于国家标准渔业水质标准(GB11607-1989)[21]中规定的0.100 mg/L;Mn7+的48 h SC低于吕耀平等人[22]研究青虾Macrobrachium nipponense的SC(3.42 mg/L),而高于徐镇等[23]研究秀丽白虾Palaemon modestus的SC(0.070 mg/L),说明刺参幼参对锰耐性强于秀丽白虾,稍弱于青虾。
2.5 Zn2+和Mn7+在幼参体内的富集
本研究认为幼参体内的背景含量Mn忽略不计,Zn含量为4.22 mg/kg。试验中发现,幼参对Zn2+的蓄积量与暴露时间、海水中Zn2+的浓度呈显著正相关(P<0.05),即暴露时间越长,海水中Zn2+浓度越高,幼参对Zn2+的蓄积就越多。
随着水体中Zn2+和Mn7+浓度的不断增加,两种重金属离子在幼参体内的含量和累积速率RA基本呈逐渐升高趋势,而富集系数的变化趋势较之相反。暴露96 h,0.4 mg/L Zn2+浓度组和0.5 mg/L Mn7+浓度组组幼参体内对应金属离子累积含量、RA和BCF均为最低(表2)。0.8 mg/L的最高Zn2+浓度组幼参体内Zn2+含量和RA分别高达13.90 mg/kg和2.42 mg/(kg·d)(P<0.01),而BCF则为12.10;而在1.5 mg/L的最高Mn7+浓度组内,幼参体内Mn7+含量和RA分别达到7.60 mg/kg和1.90 mg/(kg·d)(P<0.01),而BCF则为5.07。
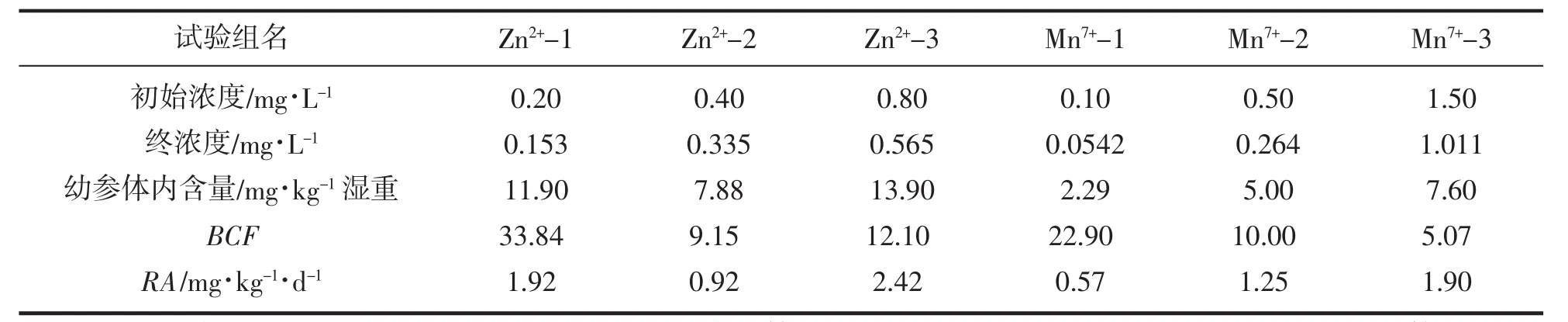
表2 96 h时Zn2+和Mn7+在幼参体内的富集Tab.2 Accumulation of Zn2+and Mn7+in A.japonicas at 96 h
金属元素对海洋生物的毒性因生物种类及其个体大小而异,还与海水环境的理化因子、生物体对重金属的适应程度和重金属的存在形式等有关[24]。赵元凤等[25]发现幼参内脏是铅蓄积的主要部位,而饵料中添加海藻多糖对铅的排放有明显促进作用;丁君等[26]研究表明,刺参消化道对Zn2+的蓄积大于体壁的蓄积,刺参呼吸树对Cu2+的蓄积大于消化道和体壁的蓄积;同时,温度显著影响重金属离子的蓄积。本文发现,幼参体内Zn2+的含量、RA和BCF与Mn7+间均存在较大差异。总体上,在相似的暴露浓度下,Zn2+在幼参中的含量、RA和BCF均高于Mn7+;但Mn7+在幼参中的BCF随暴露浓度升高而显著降低,而Zn2+呈先降低后升高的变化趋势(表2)。综上所述,Zn2+在幼参体内的富集作用强于Mn7+,且其对幼参活动能力的抑制与致死作用也比Mn7+明显。但Zn2+和Mn7+两者之间的联合毒性既可能是毒性的相加作用,也可能是小于相加作用的拮抗作用,或者是大于相加作用的协同作用,相关研究还有待进行下一步的验证。
3 结论
本试验对比了不同浓度的Zn2+和Mn7+对幼参的急性毒性与富集作用。结果发现:(1)暴露96 h时,浓度为1 mg/L的Zn2+组和5 mg/L的Mn7+组幼参死亡率达到100%;而在Zn2+浓度低于0.4 mg/L或Mn7+浓度低于0.5 mg/L条件下,两种金属离子均无明显的急性毒性作用;Mn7+浓度在3.0 mg/L时附壁率较低,而Zn2+在0.8 mg/L就已经达到相当的较低水平。Zn2+的SC为0.14 mg/L,而Mn7+为3.16 mg/L。Zn2+对幼参活动能力的抑制与致死作用较Mn7+明显。(2)Zn2+在幼参体内的富集作用强于Mn7+。随着水体中Zn2+和Mn7+浓度的不断增加,两种重金属离子在幼参体内的含量和累积速率RA也逐渐升高,富集系数总体呈降低趋势。在相似的暴露浓度下,Zn2+在幼参中的含量、RA和BCF基本均较Mn7+高。
[1]牟绍敦,李元山,刘 岗,等.山东省刺参增养殖技术发展现状[J].海洋湖沼通报,2000(2):63-65.
[2]李成林,宋爱环,胡 炜,等.山东省刺参养殖产业现状分析与可持续发展对策[J].渔业科学进展,2010,31(4):127-133.
[3]蒲红宇,周德刚,李子龙,等.我国刺参工厂化养殖发展现状与前景展望[J].齐鲁渔业,2011,28(7):51-53.
[4]张晓燕.Cu2+,Zn2+,Pb2+,Cd2+对刺参幼虫的毒性试验[J].海洋科学,1994(2):9-12.
[5]孙振兴,陈书秀,陈 静,等.四种重金属对刺参幼参的急性致毒效应[J].海洋通报,2007,26(5):80-86.
[6]陈海刚,林 钦,蔡文贵,等.3种常见海洋贝类对重金属Hg、Pb和Cd的累积与释放特征比较 [J].农业环境科学学报, 2008,27(3):1 163-1 167.
[7]KENNISH M J.Practical handbook of estuarine and marine pollution[M].Boca Raton,FL:CRC Press,1997:291-292.
[8]RAINBOW P S.The significance of trace metal concentrations in marine invertebrates[C]//Dallinger R and RAINBOW P S,eds. Ecotoxicology ofmetals in invertebrates.Boca Raton:Lewis,1993:4-23.
[9]温茹淑,郑清梅,方展强,等.敌百虫和高锰酸钾对草鱼鱼种的急性毒性研究[J].水产科学,2007,26(7):405-410.
[10]李广丽,朱春华.五种化学消毒剂对南美白对虾的急性毒性试验[J].水产科技情报,2000,27(6):243-246.
[11]王志铮,刘祖毅,吕敢堂,等.Hg2+,Zn2+,Cr6+对黄姑鱼幼鱼的急性致毒效应[J].中国水产科学,2005,12(6):745-750.
[12]高淑英,邹栋梁,厉红梅.汞,镉,锌和锰对日本对虾仔虾的急性毒性[J].海洋通报,1999,18(2):93-96.
[13]王志铮,吕敢堂,许 俊,等.Cr6+,Zn2+,Hg2+对凡纳滨对虾幼虾急性毒性和联合毒性研究 [J].海洋水产研究,2005,26(2): 6-12.
[15]朱丽岩,吕建发,唐学玺,等.锌对虾夷扇贝和刺参幼体的毒性效应[J].海洋通报,1999,18(4):34-37.
[16]周永欣,章宗涉.水生生物毒性试验方法[M].北京:农业出版社,1989:34-39.
[17]方如康.环境学词典[M].北京:科学出版社,2003:127-128.
[18]陈 勇,高 峰,刘国山,等.温度、盐度和光照周期对刺参生长及行为的影响[J].水产学报,2007,31(5):687-691.
[19]MURADO M A,VAZQUEZ J A.The notion of hormesis and the dose response theory:A unified approach[J].Journal of Theoretical Biology,2007,244:489-499.
[20]李君丰,张丛尧,杨 辉,等.Zn(II)在仿刺参幼参体内的蓄积及对其生长和存活的影响[J].大连海洋大学学报,2011,26 (1):35-40.
[21]国家环境环保总局.GB11607-89.中华人民共和国国家标准渔业水质标准[S].
[22]吕耀平,李小玲,贾秀英.Cr6+、Mn7+和Hg2+对青虾的毒性和联合毒性研究[J].上海水产大学学报,2007,16(6):549-554.
[23]徐 镇,徐如卫,周志明,等.四种常用渔药对秀丽白虾的急性毒性试验[J].水产科学,2005,24(7):29-31.
[24]刘铁钢,赵 文,郭 凯.刺参养殖过程中毒物的毒理及毒性研究概况[J].北京农业,2011,21:11-13.
[25]赵元凤,吴益春,吕景才,等.重金属铅在刺参组织的蓄积、分配、排放规律研究[J].农业环境科学学报,2008,27(4): 1 677-1 680.
[26]丁 君,张学辉,丁 鸣,等.幼刺参不同部位对Zn2+、Cu2+的蓄积动力学研究[J].海洋环境科学,2008,27(4):359-362.
Study on the Acute Toxicity and Accumulation of Zn2+,Mn7+on the Juvenile Sea Cucumber Apostichopus japonicas
LI Bin,MA Yuan-qing,XING Hong-yan,et al
(Shandong Marine Fisheries Research Institute,Shandong Key Lab of Marine Ecological Restoration,Yantai 264006,China)
Using static bioassay test,this paper studied the acute toxicity of Zn2+and Mn7+on behavior and survival status of the juvenile sea cucumber Apostichopus japonicas,furthermore,the accumulation in A. japonicas was also analyzed.The results showed that 96 h separating exposure to Zn2+or Mn7+,the mortality rates of A.japonicas in Zn2+under 0.4 mg/L and Mn7+under 0.5 mg/L were 0.0%,and no obvious acute toxicity was found within the above experimental concentration;The mortality rate increased with the increase of concentration and exposure time,but the adhesion rate decreased.The median lethal concentrations(LC50)of Zn2+in 24 h,48 h and 72 h were 49.70,1.35 and 0.82 mg/L respectively,and its safety concentration(SC)was 0.14 mg/L;The median lethal concentrations(LC50)of Mn7+in 48 h,72 h and 96 h were 31.61,4.24 and 3.13 mg/L,and the SC was 3.16 mg/L.Therefore,it was concluded that Zn2+had a stronger acute toxicity than Mn7+on A.japonicas.With increasing concentrations of Zn2+and Mn7+,the contents of hmetals and accumulationrates gradually increased,but the change of enrichment coefficient wsa contrary.It was indicated that Zn2+showed the stronger accumulating process than Mn7+on the juvenile sea cucumber.
Apostichopus japonicas;Zn2+;Mn7+;acute toxicity;enrichment
S912
A
1008-830X(2014)04-0298-06
2014-03-15
烟台市科技发展计划项目(2011457);水生动物营养与饲料“泰山学者”岗位经费
李斌(1980-),男,山东乐陵人,助理研究员,研究方向:海洋环境毒理.E-mail:albert0722@163.com
邢红艳(1970-),女,高级工程师,研究方向:海洋环境评价.Tel:0535-6939828;E-mail:xinghongyan08@126.com
