花生分离蛋白可食性膜最佳成膜条件研究
2014-03-13甄天元王玲玲杨伟强
李 鹏,甄天元,王玲玲,高 琳,杨伟强,孙 杰
(1.青岛农业大学食品科学与工程学院,山东青岛266109;2.山东省花生研究所,山东青岛266100)
可食性膜是以天然可食性物质(如:蛋白质、多糖、纤维素及其衍生物等)为原料,通过不同分子间相互作用而形成具有多孔网络结构薄膜,通过包裹、浸渍、涂布、喷洒于食品表面(或内部)达到阻止(或减少)水分、气体(O2、CO2)或溶质的迁移,并对食品起到机械保护的作用[1]。目前在此相关研究领域,国内外许多学者进行了研究,但多数集中在以大豆分离蛋白和多糖及部分类脂为主要基质,制备可食用性的食品涂膜材料,用于水果、蔬菜、禽蛋的涂膜保鲜及糕点、糖果的内包装等,对于其他的植物蛋白为原料制备可食性膜,特别是对于可单独用于食品外包装的蛋白薄膜研究比较少,也基本处于探讨阶段。
而花生蛋白是一种优质的而且也是产量丰富的一种植物蛋白资源[2],花生蛋白分子中存在着大量的氢键、疏水键、二硫键、范德华力、离子键、配位键,可成膜性高,同时花生蛋白膜可以减少食品内部水分的蒸发,阻止空气中的氧与食品之间发生的氧化作用,防止微生物的滋生,延长食品的贮藏期,而且由于花生蛋白的交联作用较为强烈,膜的机械特性优于多糖和脂肪膜[3-4],所以对于花生蛋白膜的研究与应用日益受到人们的重视。
本文旨在以低变性花生分离蛋白为原料,研究其成膜性,力求通过实验找到影响花生分离蛋白可食性膜性能,如抗拉强度(TS)、断裂伸长率(E%)和水蒸气迁移速率(νWVTR)的部分影响因素与膜性能的关系趋势,确定膜的最适制备条件,为今后花生分离蛋白膜的制作及应用提供理论与实践基础。
1 材料与方法
1.1 材料与仪器
低变性花生蛋白粉 青岛长寿食品有限公司;甘油 北京鼎国昌盛生物技术有限公司,食用级;无水氯化钙、硝酸镁、盐酸、氢氧化钠 天津市凯通化学试剂有限公司,均为分析纯。
WH-3微型漩涡混合仪 上海沪西分析仪器厂;北京瑞利游标卡尺(0.02mm) 上海量具刃具厂;KA-1600型离心机 上海安亭科学仪器厂;CL-2恒温磁力搅拌机 江苏金坛宏凯仪器厂;电子天平 上海梅特勒-托利多仪器有限公司;MP-120型酸度计 梅特勒-托利多仪器有限公司产;DHG-9023A型电热恒温鼓风干燥箱 上海一恒科技有限公司;DS1型高速组织捣碎机 上海精胜科学仪器有限公司;HH-4型恒温水浴锅 常州国华电器有限公司;TA-XT2i型质构仪 英国Stable Micro System公司。
1.2 花生分离蛋白的提取
采用碱提酸沉法,称取一定低变性花生蛋白粉,按一定比例加入碱溶液,搅拌、浸提;浸提后离心,过滤;滤液中缓慢加入0.1mol/L HCL溶液,并轻轻搅动,使其pH达到蛋白等电点4.5左右,花生分离蛋白呈白色絮状沉淀析出,再用水洗涤沉淀至中性;造粒,干燥,粉碎,即得花生分离蛋白[5]。
1.3 蛋白质的测定
按GB/T6432-1994,凯氏定氮法进行测定。
1.4 花生分离蛋白可食性膜的制备
将上述所得花生分离蛋白按比例混于蒸馏水中,加入2%甘油(V/V)为增塑剂,制备可食性膜,工艺流程为:配制花生分离蛋白溶液,添加增塑剂,用0.1mol/L的NaOH调节到一定pH后,水浴加热至所需温度,搅拌处理30min直到完全溶解,成膜液呈现均匀的状态,离心(3000r/min,10min),过滤,量取混合液倒入有机玻璃板上流延均匀,水平放置2h,膜表面成型后,放入65℃鼓风干燥箱中干燥,揭膜即可得到花生分离蛋白可食性膜,揭膜后在相对湿度50%(硝酸镁饱和溶液)下平衡48h,用以测定性能指标[6-7]。
1.5 单因素及正交实验设计
单因素实验考察热处理温度(℃)、pH和花生分离蛋白溶液浓度(%)对成膜的影响。通过单因素实验结果,确定热处理温度、溶液pH、溶液浓度因素的水平,进行L9(33)的正交实验,采用加权法对花生分离蛋白膜的综合性能进行评分,正交实验设计见表1。
1.6 花生分离蛋白可食性膜性能的测定[8-9]
1.6.1 膜厚度测定 用螺旋测微仪在膜上随机取5点,准确测量膜的厚度,取其平均值,用作该样品抗拉强度和水蒸气迁移速率公式中的厚度值(T)。
1.6.2 抗拉强度测定 用质构仪测定。每种组分的膜准备十个样品进行测定。将膜制成长(L)4.0cm,宽(W)2.0cm的试样,测量其厚度(T),质构仪的初始夹距设定为40mm,拉引速度0.5mm/s,在质构仪上读取膜破裂时的拉力(F)数值。按公式(1)计算膜的TS:

式中:F:作用在膜两端的最大拉力,N;T:膜的厚度,由螺旋测微器测出,mm;W:为膜的宽度,mm。
1.6.3 断裂伸长率E%的测定 是衡量膜的机械强度的另一指标,用质构仪测定。每种组分的膜准备十个样品进行测定。将膜制成长(L)4.0cm,宽(W)2.0cm的试样,测量其厚度(T),质构仪的初始夹距设定为40mm,拉引速度0.5mm/s,测量膜断裂时的膜的延伸长度(L0),按公式(2)计算膜的E:

式中:L0:膜断裂时被拉伸的长度,mm;L:膜的原始长度40mm。
1.6.4 水蒸气迁移速率 将待测的花生分离蛋白膜密封于装有无水氯化钙的小锥形瓶口处,在室内放置平衡24h,称量小锥形瓶质量的变化。水蒸气迁移速率单位为g/(m2·h),按公式(3)计算:

式中:Δm:水蒸气迁移量,g;A:膜的面积,m2;t:测定的时间,h。
1.7 膜性能综合评分原则
实验采用加权法对花生分离蛋白膜的综合性能进行评分[10],满分为100分。膜性能评分标准:TS,40分;E,32分;νWVTR,20分;表观效果8分。
1.7.1 TS(40分) TS≥2.0MPa,分值40分;1.5MPa≤TS<2.0MPa,30分≤分值<40分;1.0MPa≤TS<1.5MPa,20分≤分值<30分;0.5MPa≤TS<1.0MPa,10分≤分值<20分;0MPa≤TS<0.5MPa,0分≤分值<10分。
1.7.2 E(32分) E≥200%,分值32分;150%≤E<200%,24分≤分值<32分;100%≤E<150%,16分≤分值<24分;50%≤E<100%,8分≤分值<16分;0%≤E<50%,0分≤分值<8分。
1.7.3 νWVTR(20分) νWVTR≤15g/(m2·h),分值20分;10g/(m2·h)<νWVTR≤15g/(m2·h),15分≤分值<20分;15g/(m2·h)<νWVTR≤20g/(m2·h),10分≤分值<15分;20g/(m2·h)<νWVTR≤25g/(m2·h),5分≤分值<10分;25g/(m2·h)<νWVTR≤30g/(m2·h),0分≤分值<5分。
1.7.4 表观效果(8分) 观察所成的膜是否表面光滑,色泽透明,容易成膜,容易揭膜,分值8分,不符合条件的酌情减分。
1.8 数据分析
采用SPSS软件进行方差分析和均值显著性差异分析(采用邓肯氏复极差法测验显著性水平,设p≤0.05时显著性差异)。
2 结果与分析
2.1 花生分离蛋白的蛋白含量
采用碱溶酸沉法制取的花生分离蛋白的蛋白含量为94.4%,达到了分离蛋白的标准(蛋白含量在90%以上)。
2.2 影响膜性能的单因素实验
2.2.1 热处理温度对花生分离蛋白可食性膜性能的影响 在对成膜液的热处理过程中,随着热处理温度的上升,使得最终蛋白膜的TS先上升后下降,温度上升到75℃时,膜的TS得到显著的提高(p<0.05),此后随着温度的升高TS略微有所降低,但差异不显著(p>0.05)(表2)。这可能主要是因为适度的热处理削弱了蛋白质分子间作用力,使大分子从原来有秩序的紧密结构变为无秩序的松散结构,使原来藏在分子内部的巯基和疏水性氨基酸侧链残基等暴露在分子表面,从而有利于蛋白质分子内或分子间相互作用,在干燥过程中蛋白质分子重新形成二硫键,形成坚固的网络结构,使TS提高[11],但若热处理温度过高,时间过长,又使得蛋白质分子过度变性,造成蛋白质分子链断裂,不利于网络结构的形成[12]。
随着热处理温度的升高,花生分离蛋白膜的E也是先升高后有所降低,75℃时E达到最大值(p<0.05),此后随着温度增加,差异不显著(p>0.05)。这主要是经过热处理后,蛋白分子结构由紧密变得松散,原先的球状分子结构变为线性分子结构,更多线性的蛋白分子链重新排列,分子定向程度提高,使得E增加,因此温度对E的影响较大。
花生分离蛋白膜νWVTR,随着热处理温度升高,发生显著变化(p<0.05),当经过75℃处理时,数值最小。这表明适当的热处理能促进蛋白质分子中的氢键和二硫键断裂,结构展开,疏水性基团暴露出来,提高花生蛋白疏水性,加强了分子间相互作用和二硫键重新分布,形成坚固的网络结构,提高其阻水性能[13-14]。
表2 热处理温度对花生分离蛋白膜性能的影响(n=5,±sD)Table 2 Effect of temperature on the properties of the film(n=5,±sD)
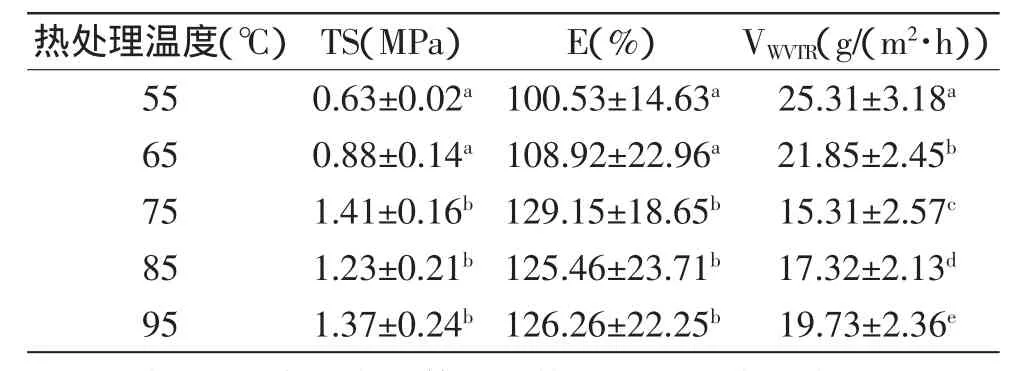
表2 热处理温度对花生分离蛋白膜性能的影响(n=5,±sD)Table 2 Effect of temperature on the properties of the film(n=5,±sD)
注:同列不同的字母表示差异显著(p<0.05);表2、表3同。
热处理温度(℃) TS(MPa) E(%) VWVTR(g/(m2·h))55 0.63±0.02a100.53±14.63a 25.31±3.18a 65 0.88±0.14a108.92±22.96a 21.85±2.45b 75 1.41±0.16b129.15±18.65b 15.31±2.57c 85 1.23±0.21b125.46±23.71b 17.32±2.13d 95 1.37±0.24b126.26±22.25b 19.73±2.36e
2.2.2 pH对花生分离蛋白可食性膜性能的影响 pH在8~11之间,花生分离蛋白溶解性比较好,膜液均匀,可以得到表面光滑、具有一定弹性和强度的薄膜,其性能指标见表3。由表3可以看出,pH对膜的TS存在显著差异(p<0.05)。从pH7~9,TS增大,这主要由于碱使蛋白质变性,内部基团暴露,有利于坚固网格结构的形成;从pH9~11,TS又下降,由于极端碱性条件下,负离子之间极强的静电排斥作用阻碍了蛋白质分子内或分子间的连接,从而阻碍了膜的形成。
表3 pH对花生分离蛋白可食性膜性能的影响(n=5,±sD)Table 3 Effect of pH on the properties of the film(n=5,±sD)
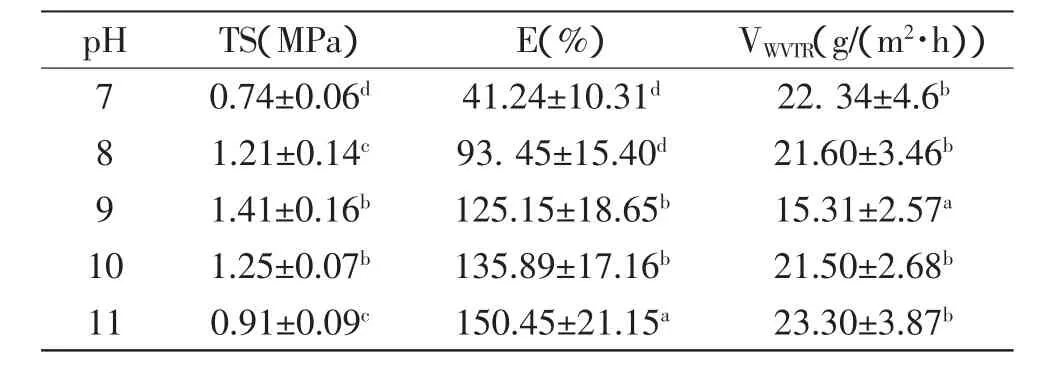
表3 pH对花生分离蛋白可食性膜性能的影响(n=5,±sD)Table 3 Effect of pH on the properties of the film(n=5,±sD)
pH TS(MPa) E(%) VWVTR(g/(m2·h))7 0.74±0.06d 41.24±10.31d 22.34±4.6b 8 1.21±0.14c 93.45±15.40d 21.60±3.46b 9 1.41±0.16b 125.15±18.65b 15.31±2.57a 10 1.25±0.07b 135.89±17.16b 21.50±2.68b 11 0.91±0.09c 150.45±21.15a 23.30±3.87b
膜的E随pH的增大而增大(p<0.05),这可能是因为,高pH碱使蛋白分子间相互作用减弱,而蛋白质是富有弹性的物质,所以使得膜的柔韧性较好,膜的E增加。
νWVTR随着pH的升高呈先下降后升高的趋势,当pH为9时值最小(p<0.05),这与蛋白质网络结构的形成有直接联系,pH为9时膜的结构变得更加致密,阻止了水蒸气的渗透,因此膜的水蒸气透过系数减小。
2.2.3 蛋白溶液浓度对花生分离蛋白膜性能的影响
由表4可见,花生分离蛋白浓度在2%~10%都可以成膜,但浓度在2%~4%时,由于蛋白含量太低,蛋白质分子比较分散,不易于蛋白质分子之间的交联作用,不易成膜;质量分数在6%~8%时,能形成较好的花生分离蛋白膜,且容易揭膜,可以得到柔软、表面光滑的薄膜。由表4可知,随着花生分离蛋白浓度的增加,膜的TS和E随之增强,νWVTR有所下降。花生蛋白浓度升高意味着成膜溶液中有更多的花生蛋白分子进行交联,溶质分子间的作用力加强,提高了蛋白膜的机械强度[15]。
表4 花生分离蛋白溶液浓度对花生分离蛋白膜性能的影响(n=5,±sD)Table 4 Effect of PPI concentration on properties of the film(n=5,±sD)
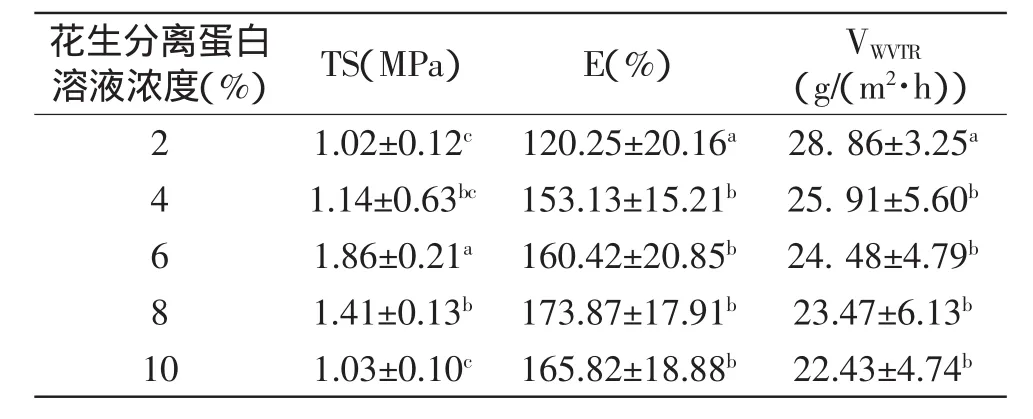
表4 花生分离蛋白溶液浓度对花生分离蛋白膜性能的影响(n=5,±sD)Table 4 Effect of PPI concentration on properties of the film(n=5,±sD)
花生分离蛋白溶液浓度(%) TS(MPa) E(%) VWVTR(g/(m2·h))2 1.02±0.12c 120.25±20.16a 28.86±3.25a 4 1.14±0.63bc 153.13±15.21b 25.91±5.60b 6 1.86±0.21a 160.42±20.85b 24.48±4.79b 8 1.41±0.13b 173.87±17.91b 23.47±6.13b 10 1.03±0.10c 165.82±18.88b 22.43±4.74b
2.3 正交实验结果
通过单因素实验研究表明,热处理温度、溶液pH、溶液浓度对膜性能有很大影响,综合考虑,通过正交实验,采用了加权法对花生分离蛋白膜的综合性能进行评分[16-17],正交实验结果如表5所示。
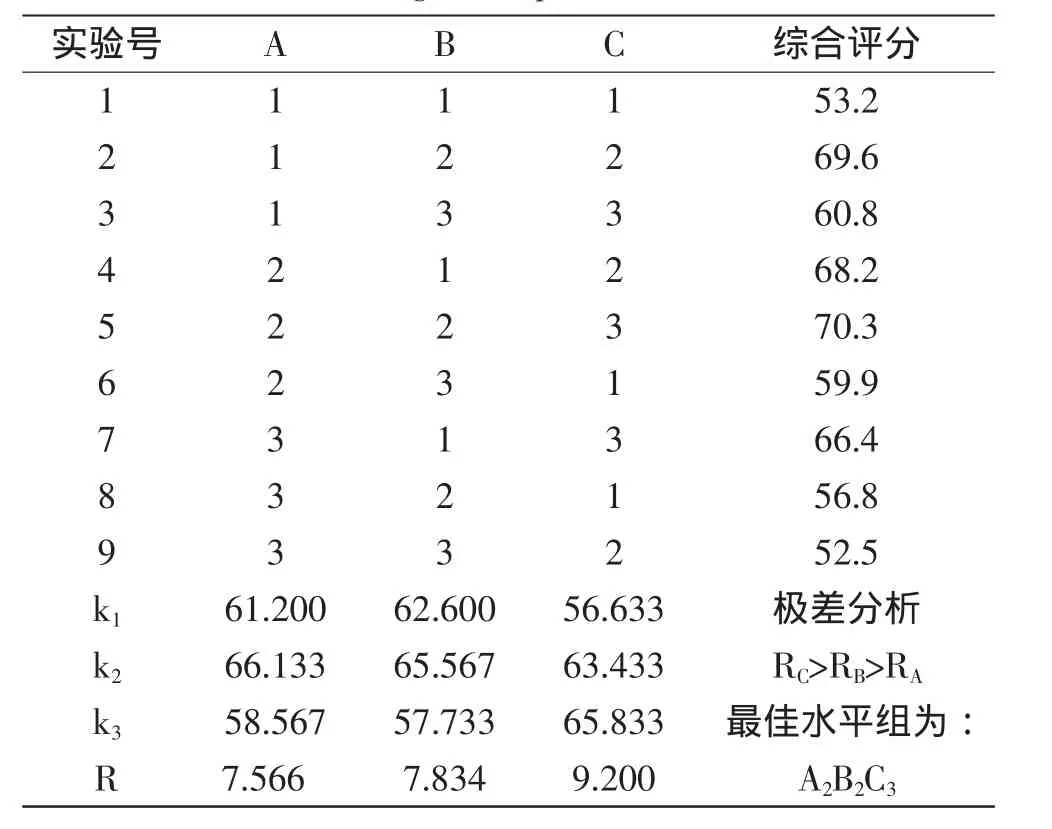
表5 成膜正交实验结果与分析Table 5 Results and analysis of the filming orthogonal experiments
从表5中可以看出,各因素对花生分离蛋白膜性能影响的主次关系依次为C>B>A,即蛋白溶液浓度>pH>热处理温度。可初步筛选条件为A2B2C3,即热处理温度75℃、pH9、花生分离蛋白浓度为8%。在此条件下进行验证实验,结果表明此条件下制得的花生分离蛋白可食性膜具有较佳的性能,综合评分为70.3,TS、E和νWVTR分别达到1.41MPa,173.87%,23.47g/(m2·h),证明该制膜工艺参数合理可行。
3 结论
花生分离蛋白具有良好的成膜性能。在2%的甘油为增塑剂的条件下,花生分离蛋白浓度8%,pH9,热处理温度为75℃,此时成膜质地透明柔软,具有较高的强度和延伸性,并能有效地阻止水蒸气的迁移。
[1]罗学刚.国内外可食性包装膜研究进展[J].中国包装,1999,19(5):102-103.
[2]陈艳君.2012年我国花生及花生油市场分析暨2013年展望[J].粮食与油脂,2013,26(2):36-39.
[3]刘砚,熊柳,孙高飞,等.花生分离蛋白可食性膜的制取及性能[J].中国油脂,2008,33(9):19-22.
[4]冯治平,刘达玉.改善花生分离蛋白成膜及保藏特性研究[J].食品科学,2005,26(1):52-56
[5]杨伟强,李鹏,袁涛,等.从花生蛋白粉中提取花生分离蛋白的条件优化[J].中国油脂,2009,34(1):34-37.
[6]冯治平,黄丹.还原剂对花生分离蛋白膜的保藏性能影响研究[J].食品科技,2007(3):242-246.
[7]Liu C C,Tellez-Garay A M,Castell-Perezc M E.Physical and mechanical properties of peanut protein films[J].LWT-Food Science and Technology,2004,37(7):731-738
[8]包惠燕,郭乾初,欧仕益.不同pH下阿魏酸对大豆分离蛋白膜性能的影响[J].食品科学,2004,25(9):67-70.
[9]陈义勇,徐宇.花生蛋白膜的特性研究[J].食品研究与开发,2010,31(3):58-62.
[10]王昊,张东杰.酶法改性大豆分离蛋白成膜条件的研究[J].农产品加工·学刊,2011(1):57-61.
[11]莫文敏,曾庆孝,张孝祺.热处理和碱处理对可食性大豆分离蛋白膜性能的影响[J].食品工业科技,2001,22(3):22-24.
[12]郭宽,张超,赵晓燕,等.热处理温度对大豆分离蛋白膜功能性质的影响[J].中国粮油学报,2011,26(7):27-30.
[13]Jangchud A,Chinnan M S.Peanut Protein Film as Affected by Drying Temperature and pH of Film Forming Solution[J]. Journal of Food Science,1999,64(1)153-157.
[14]Kim K M,Weller C L,Hanna M A,et al.Heat curing of soy protein films at selected temperatures and pressures[J].Food Science and Technology,2002,35(2):140-145.
[15]孙旸,孙春玉,李靓,等.大豆分离蛋白膜的制备及相关因素分析[J].中国农学通报,2010,26(18):92-95
[16]张华江,迟玉杰,夏宁,等.可食性大豆复合蛋白膜的研究[J].食品与发酵工业,2008,34(9):73-77.
[17]周红锋,张子勇,欧仕益.大豆分离蛋白可食膜的制备及微波处理对性能的影响[J].包装工程,2006,27(2):28-30.
