重组鸡β-防御素12蛋白的原核表达及其生物学特性分析
2014-03-12马得莹李妍妍徐倩倩张婷婷韩宗玺刘胜旺
马得莹,徐 杨,,李妍妍,,徐倩倩,,张婷婷,,韩宗玺,刘胜旺
(1.东北农业大学动物科学技术学院,哈尔滨 150030;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/禽病研究室,哈尔滨 150001)
禽类是人畜共患病食源性细菌(如沙门氏菌和弯曲杆菌等)和病毒(如H5N1,H7N9等)的携带者,因此增强禽类机体免疫力是保证禽类健康和公共卫生安全关键[1-2]。防御素为禽类先天性免疫重要组成部分。目前已发现的禽类防御素(Avianβ-defensins,AvBDs)均属β-防御素亚类[3]。禽β-防御素为两亲性结构的阳离子抗菌肽,含有位置保守的6个半胱氨酸残基构成的3对二硫键,多由4个外显子和3个内含子构成[3-5]。鸡β-防御素12则是由2个外显子和1个内含子组成[6]。迄今为止,已从鸡[7]、火鸡[8]、鸭[9]和鹅[10]等禽类体内分离到40余种禽β-防御素。禽β-防御素具有广谱抗菌活性,能有效杀灭多种革兰氏阴性菌和革兰氏阳性菌[9-12],对肿瘤细胞和某些被膜病毒有抑制作用[11,13]。此外,防御素可作为天然免疫信号诱导炎性细胞因子表达,激活TLR-NF-κB信号转导通路,启动、调节并放大获得性免疫反应,进一步增强机体免疫力[14]。因此,禽β-防御素是禽类抵御病原微生物入侵的重要屏障。
为探讨禽β-防御素的生物学功能,采用基因工程方法在特定宿主内大量表达禽β-防御素融合蛋白为有效途径。目前,鸡AvBD1[15]、AvBD5[16]、AvBD6[17]、AvBD10[18]等已实现在大肠杆菌中原核表达,纯化后重组蛋白均具有体外抗菌活性。尚未见有关鸡β-防御素12在防御系统作用等研究报道。本研究将鸡β-防御素12基因成熟肽片段克隆至pProex HTa表达载体中,原核表达鸡AvBD12重组蛋白,测定其体外生物学特性。此外,应用荧光定量PCR法检测该基因在组织脏器中分布,为进一步开展禽β-防御素研究与应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 动物
14日龄SPF鸡,由中国农业科学院哈尔滨兽医研究所实验中心提供。
1.1.2 菌株及质粒
金黄色葡萄球菌(ATCC 29213)、兔波氏杆菌(ATCC 33222)、猪霍乱沙门氏菌(CVCC 2140)、乳酸菌(ATCC 33222)均购自中国兽医药品监察所;克隆质粒载体PMD18-T-Simple Vector购自宝生物工程(大连)有限公司,表达质粒载体pProex HTa、克隆菌株E.coliTGⅠ及表达菌株E.coliBL21(DE)plysS均由中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室禽病研究室保存。
1.1.3 主要试剂
T4DNA连接酶、ExTaqDNA聚合酶、限制性内切酶EcoRⅠ、XholⅠ、IPTG购自宝生物工程(大连)有限公司;RNA提取TRizol试剂盒购自Invitrogen公司;琼脂糖凝胶回收试剂盒购自美国OMEGA公司;一步法RT-PCR试剂盒、Protein Refolding Kit蛋白纯化试剂盒购自Novagen公司;其他试剂均为分析纯。
1.2 方法
1.2.1 引物设计与合成
根据GenBank中登录的鸡AvBD12(NM-001001607)的cDNA基因序列和表达载体序列进行酶切位点分析,并应用Premier 5.0软件设计4对PCR引物,其中Q1/Q2为克隆引物,Q3/Q4为表达引物,Q5/Q6为AvBD12定量PCR引物,Q7/Q8为18S rRNA定量PCR引物。
Q1:5'ATGAGGAACCTTTGTTTCGTGT 3';
Q2:5'TCAGGTCTTGGTGGGAGTTG 3';
Q3:5'GAATTCATGGACAGCTGTAACCACG 3';
Q4:5'CTCGAGTCAGGTCTTGGTGGGAGTTG3';
Q5:5'GGAACCTTTGTTTCGTGTTCA 3';
Q6:5'GAGAATGACGGGTTCAAAGC 3';
Q7:5'GGTTGCAAAGCTGAAACTTAAAGG 3';
Q8:5'TGAGGTTTCCCGTGTTGAGTC 3'。
Q3的5'端含有EcoR I酶切位点;Q4的5'端含有Xho1 I酶切位点。引物由上海生工生物工程技术服务有限公司合成。
1.2.2 基因克隆、测序及遗传进化分析
取鸡脾脏约0.1 g,按照TRIzolTM试剂盒提取总RNA,体系为20 μL。根据一步法RT-PCR试剂盒说明书扩增目的片段,体系中引物为克隆引物Q1和Q2。取2~3 μL扩增产物,利用2%琼脂糖凝胶电泳进行初步鉴定。回收目的片段与pMD18-TSimple载体连接(重组质粒命名为pMD-AvBD12),转化E.coliTGⅠ感受态细胞,筛选阳性质粒,将鉴定为阳性的重组质粒由北京六合华大基因科技股份有限公司测序。将得到的鸡AvBD12序列应用DNAStar软件中的MEGALIGN程序与已知的禽β-防御素基因及部分哺乳动物的β-防御素基因序列作同源性比较。
1.2.3 原核表达重组质粒构建、重组蛋白的表达及纯化
以重组质粒pMD-AvBD12为模板,采用表达引物Q3和Q4将AvBD12成熟肽段基因亚克隆到表达质粒载体pProex HTa上,将构建重组质粒命名为pProex-AvBD12。链接产物转化表达感受态细胞E.coliBL21(DE)plysS,利用质粒PCR和双酶切方法筛选阳性克隆,阳性克隆由北京六合华大基因科技股份有限公司测序。
将鉴定为阳性的菌液少量活化后,以1∶100接到含有AMP+的LB液体培养基中37℃振荡培养。待OD600nm值达到0.5~0.6时,留取1 mL菌液作为对照,并在剩余菌液中加入终浓度为1 mmol·L-1IPTG进行诱导蛋白表达,分别在诱导4和5 h后各留取1 mL菌样。按照Novagen公司的蛋白纯化复性试剂盒说明书进行包涵体的纯化、复性和透析,并测定重组蛋白浓度。留取1 mL超声波破碎离心的上清液和少量沉淀,将沉淀用100 μL PBS(pH 7.4)重新悬起。将诱导前对照菌样、诱导后菌样、上清液、沉淀样和纯化后的蛋白进行Tricine-SDSPAGE电泳分析,用薄层扫描仪观察结果。
1.2.4 重组鸡AvBD12蛋白抗菌活性测定
采用菌落计数方法测定重组鸡AvBD12蛋白的抗菌活性。用pH 7.4的无菌PBS稀释重组鸡AvBD12蛋白与His标签非重组蛋白,使其终浓度分别为50、100、250 和500 μg · mL-1,各取250 μL加入无菌管中。将1.1.2所述各株细菌培养至对数生长期,然后用相应的培养基稀释细菌至2×106cfu·mL-1,分别取每株细菌培养物10 μL至试管中,同时用PBS代替重组蛋白作为阴性对照,每组设置3个重复。37℃振荡孵育4 h后,每个稀释度各取200 μL接种在营养琼脂平板上,37℃培养箱孵育18 h后,观察并记录每个营养琼脂平板上的菌落数量。取相同稀释度的3个营养琼脂平板菌落平均值作为该稀释度样品的菌落数量。根据接种量和稀释倍数计算每管原液中的细菌数量,并用Excel 2003处理数据,应用GraphPad Prism 5绘制细菌存活率和重组蛋白浓度关系。
细菌的存活率(%)=存活细菌数/阴性对照存活细菌数×100%。
1.2.5 不同盐离子浓度对重组鸡AvBD12蛋白抗菌活性影响
选取金黄色葡萄球菌(革兰氏阳性菌)和兔波氏杆菌(革兰氏阴性菌)作为检测菌,用无菌去离子水稀释氯化钠,使其终浓度分别为0、50、100、150 mmol·L-1。然后用上述不同NaCl浓度的缓冲液稀释重组蛋白浓度至250 μg· mL-1,各取250 μL分别加入无菌离心管中,相应NaCl浓度的稀释液作为阴性对照,分别向每管加入细菌培养物10 μL,37℃振荡孵育4 h。方法同试验1.2.4
1.2.6 重组鸡AvBD12蛋白对鸡红细胞的溶血活性测定
学案导学教学中的导即开导、启迪之意,导学不是传统教学意义上的辅导教学,这里的导学是以学案为依托、以素质教育为指导、以培养学生的创新能力为目的,对学生的导思、导读、导练的过程。
用无菌PBS(pH 7.4)将新鲜鸡血红细胞稀释至2%~3%,用PBS稀释重组蛋白,使其终浓度分别为100、250、500 μg · mL-1。取20 μL蛋白分别加入无菌离心管中,同时设PBS作为阴性对照,0.2%Triton X-100作为阳性对照,分别向每管加入180 μL稀释的红细胞。每组设3个重复,37℃孵育1 h,1000 g·min-1离心10 min后取上清,用微量紫外分光光度计测OD560nm值。每个样品做3个平行测定,取平均值。计算公式为:溶血指数(%)=(OD蛋白-ODPBS)/(ODTriton-ODPBS)。
1.2.7 鸡AvBD12基因在组织中相对表达水平检测
取12日龄SPF鸡放血致死,无菌条件下取腺胃、气管、肾脏、肺脏、肝脏、盲肠扁桃体、法氏囊、哈德氏腺、脾脏、直肠、小肠、盲肠、十二指肠、盲肠、胰腺组织各0.1 g,按TRIzolTM试剂盒说明方法提取总RNA。取1 μL总RNA样品,用DEPC水按1∶10和1∶100稀释,用微量紫外分光光度计测定其浓度。
分别以定量引物Q5/Q6、Q7/Q8为特异性引物,以鸡脾脏组织为模版进行RT-PCR扩增,回收纯化扩增产物,并与pMD18-T-Simple载体相连,将构建好的重组质粒转入E.coliTGⅠ感受态细胞中。筛选阳性克隆,并由北京六合华大基因科技股份有限公司测序。提取阳性质粒,测定质粒浓度并计算标准品拷贝数,计算公式为:
标准品拷贝数(copies·μL-1)=6.023×1023(copies·mol-1)×C(g·μL-1)/碱基数 × 660(g·mol-1)。将标准品质粒按10倍梯度稀释后用于构建荧光定量检测所需的标准曲线。
以各组织RNA为模板,重组质粒为标准品进行荧光定量PCR反应,引物分别为Q5/Q6(AvBD12)与Q7/Q8(18S rRNA),反应体系按 One Step SYBR PrimeScript RT-PCR Kit II试剂盒说明进行操作,分别检测AvBD12和内参基因鸡18S rRNA在各组织脏器中的相对表达量。每个样品均做5个重复,取其平均值进行分析。
基因相对表达量=(目标基因拷贝数/内参基因拷贝数)×107
1.2.8 统计分析
试验所得数据采用SAS 6.0软件的ANOVA法进行方差分析。
2 结果与分析
2.1 鸡AvBD12基因克隆与序列分析
采用特异性引物Q1/Q2,以鸡脾脏组织RNA为模板,经RT-PCR扩增到约200bp的片段,结果与目的基因(198bp)大小相符(见图1)。经北京六合华大基因股份有限公司对质粒PCR鉴定为阳性的质粒进行核苷酸测序,得到鸡AvBD12基因及其推导的氨基酸序列。经序列比对表明,所得到的序列与GenBank中登录的鸡AvBD12(登录号:NM-001001607)的序列完全一致。AvBD12基因由198个碱基组成,编码65个氨基酸残基,分子内含有β-防御素的特征性氨基酸基序,即由1~5、2~4、3~6 位置保守的三对二硫键组成,含有两个外显子和一个内含子。采用DNAStar软件中Clustal V方法将鸡β-防御素12氨基酸序列与其他AvBDs的序列进行比较发现,该基因与其他鸡AvBDs氨基酸同源性较低。
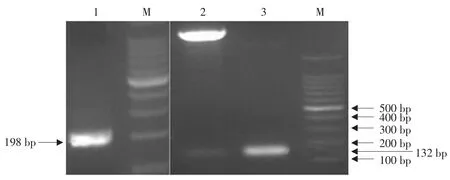
图1 鸡AvBD12 RT-PCR产物、重组表达质粒pProex HTa-AvBD12酶切及PCR鉴定Fig.1 Identification of RT-PCR product,the recombinant expression plasmid pProex HTa-AvBD12 digested and PCR product
2.2 鸡pProex-AvBD12重组质粒鉴定及表达和纯化
将构建的pProex-AvBD12重组表达质粒经EcoR I和Xhol I双酶切,回收目的片段。电泳结果表明,酶切产物大小与质粒PCR扩增得到条带大小一致(132 bp),如图1所示。重组质粒测序结果表明将编码鸡AvBD12成熟蛋白基因正确插入原核表达载体的目的位点。将pProex-AvBD12重组表达质粒转化于E.coliBL21(DE)plysS菌株诱导表达。进行Tricine-SDS-PAGE分析,并设未诱导的重组菌为对照,其中诱导后的重组菌中出现一条明显的表达蛋白条带,以分子质量标准作参照,其分子质量约为14 ku,而对照中未出现,诱导4和5 h后表达量差异不明显。将诱导后的菌液经超声波破碎菌体后,分别取上清和沉淀Tricine-SDS-PAGE分析,可见大部分重组蛋白在沉淀中,表明重组蛋白于E.coliBL21(plysS)中以包涵体的形式存在。采用Novagen蛋白质纯化复性试剂盒对重组蛋白进行纯化,获得的重组鸡AvBD12融合蛋白,运用微量紫外分光光度仪测得的浓度为1200 μg·mL-1。对纯化后的蛋白进行Tricine-SDS-PAGE电泳,观察结果显示可见约14 ku大小的蛋白带,与预期蛋白相符,如图2所示。
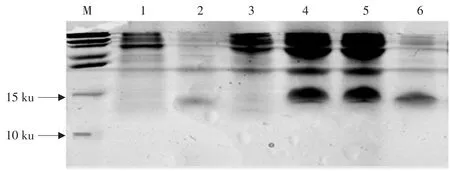
图2 重组鸡AvBD12融合蛋白表达与纯化Fig.2 Expression and purification of recombinant chicken AvBD12
2.3 重组鸡AvBD12蛋白的抗菌活性及理化性质测定
采用菌落计数法测定鸡AvBD12重组蛋白对4种细菌的抗菌活性,如图3所示。结果表明重组鸡AvBD12融合蛋白对所测定的细菌具有显著抑菌作用(P<0.05)。随着鸡AvBD12重组蛋白浓度增加,细菌存活率逐渐下降,即其抗菌活性逐渐增强。其中,鸡AvBD12重组蛋白对金黄色葡萄球菌和兔波氏杆菌抗菌活性较强,对猪霍乱沙门氏菌和乳酸菌的抗菌活性相对较弱,当鸡AvBD12重组蛋白浓度为50 μg·mL-1时,对兔波氏杆菌仍具有抑菌活性。
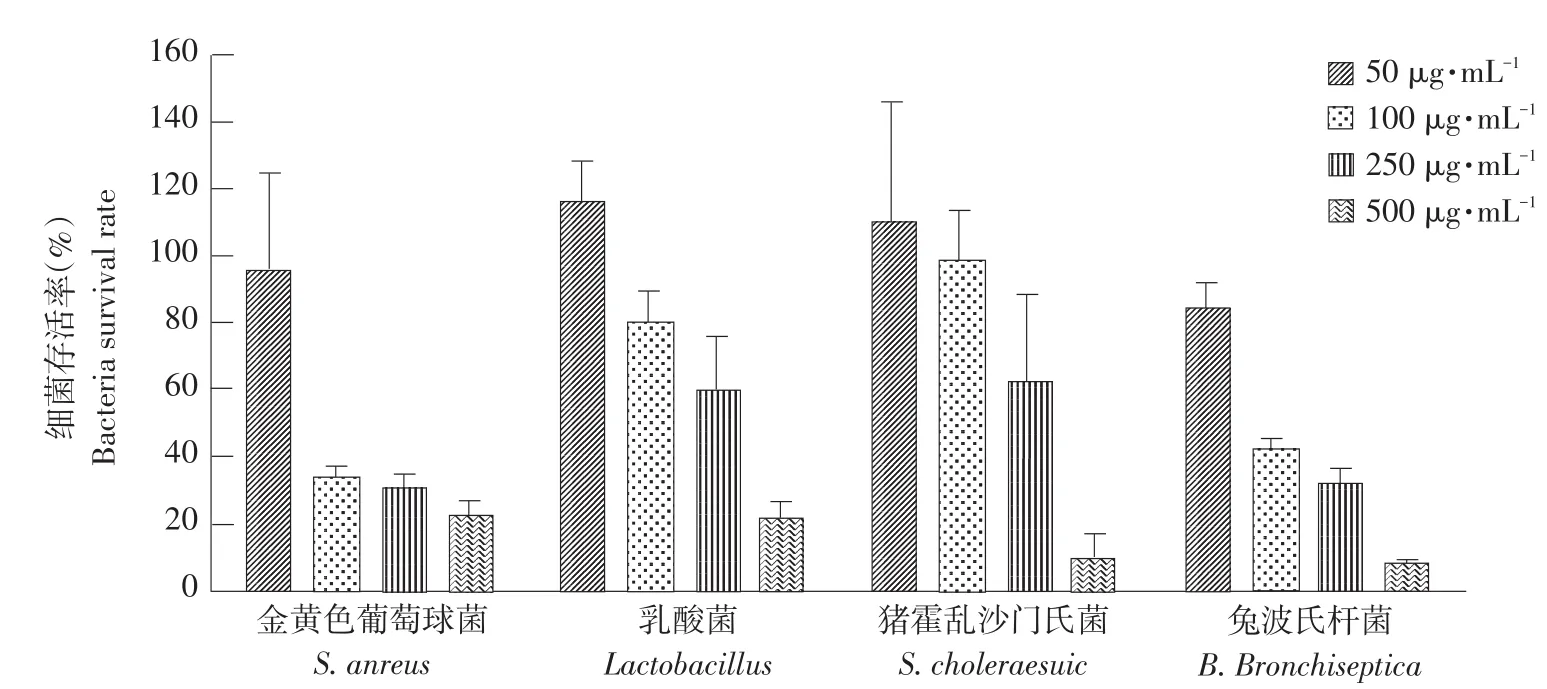
图3 重组鸡AvBD12蛋白抗菌活性Fig.3 Antimicrobial activity of recombinant chicken AvBD12 against bacterial strains
2.4 不同盐离子浓度对重组鸡AvBD12蛋白抑菌活性影响
采用菌落计数法测定重组蛋白(250 μg·mL-1)在不同盐离子浓度下的抗菌活性。由图4可知,随着NaCl浓度的升高(0~150 mmol·L-1),革兰氏阳性菌(金黄色葡萄球菌)和革兰氏阴性菌(兔波氏杆菌)存活率均不断上升,即鸡AvBD12重组蛋白抗菌活性逐渐降低,当NaCl浓度为150 mmol·L-1时,重组蛋白抗兔波氏杆菌活性显著下降(P<0.01)。表明,高盐离子浓度显著降低鸡AvBD12重组蛋白的抗菌活性。

图4 不同NaCl浓度下,250 μg·mL-1的重组鸡AvBD12蛋白的抗菌活性Fig.4 Effects of salinity on the antibacterial activity of recombinant AvBD12 protein with 250 μg·mL-1against bacterias
2.5 重组蛋白对鸡红细胞的溶血活性
本试验以不同浓度的重组蛋白作为检测对象,结果显示重组鸡AvBD12蛋白为500 μg·mL-1时,对鸡血红细胞溶血活性极低,与阴性对照差异不显著(P>0.05),表明重组鸡AvBD12蛋白对鸡血红细胞没有溶血的活性(见图5)。

图5 重组鸡AvBD12蛋白的溶血活性Fig.5 Hemolysis activity of recombinant chicken AvBD12 protein
2.6 鸡AvBD12基因在组织中分布
分别以鸡的15个脏器组织的cDNA为模板,采用real-time PCR相对定量方法进行检测,利用18S rRNA对鸡AvBD12基因在体内组织器官中的相对表达量进行统一校正,结果表明AvBD12在鸡脏器组织中广泛表达,在15个组织脏器中均有不同水平的表达。在腺胃、肾脏、十二指肠、小肠、盲肠和法氏囊的表达水平显著高于其他组织(P<0.05),在气管中表达量最低(见图6)。

图6 AvBD12基因在鸡各组织脏器中相对表达量Fig.6 Relavtive expression of AvBD12 mRNA in tissues of chicken
3 讨论
本研究根据GenBank中提交的鸡AvBD12的基因序列,设计特异性引物,利用RT-PCR方法从鸡脾脏组织克隆得到鸡AvBD12基因。测序结果表明,该基因与已发现的AvBDs基因一样,含有由六个保守的半胱氨酸组成的三对二硫键及GXC保守结构[6,9-10,12],该保守氨基酸基团为β-防御素的特征性结构。将鸡AvBD12基因与其他AvBDs基因进行同源性分析比较发现,该基因与其他鸡AvBDs氨基酸同源性较低,表明鸡AvBD12基因存在较大的种属特异性,推测造成这种现象的原因可能是物种进化选择的结果。
大多数外源基因都可在大肠杆菌原核表达系统中高效表达,易于培养且费用低廉,为防御素生产自动化、产业化奠定基础。本试验采用大肠杆菌BL21(DE)plysS作为表达菌株,通过融合表达方式将鸡AvBD12成熟肽片段克隆到pProex HTa中,经诱导实现鸡AvBD12在大肠杆菌中高效表达。结果表明,该蛋白大部分以不溶的、无活性的包涵体形式存在。包涵体是大量表达的重组蛋白形成的致密颗粒,能保护目的蛋白不受蛋白酶降解,且不影响宿主菌生长,便于产物分离[19]。结果表明,纯化后重组鸡AvBD12融合蛋白具有广谱抗菌活性。在500 μg·mL-1蛋白浓度条件下,对革兰氏阳性菌及革兰氏阴性菌均有较强抑制作用且差异显著;而50 μg·mL-1蛋白浓度时,对猪霍乱沙门氏菌和乳酸菌抗性较弱,本研究结果与韩宗玺等有关AvBDs的抗菌活性报道一致[12,17-18]。不同种类的防御素对细菌的抑制作用也有所不同[3-5,11],如重组鸡AvBD6和鹅AvBD3对枯草芽孢杆菌、多杀巴氏杆菌和金黄色葡萄球菌均具有较强抑制作用;而与鹅AvBD3相比,重组鸡AvBD6对沙门氏菌、大肠杆菌的抗菌活性则较弱[12,17]。Ma等相关研究表明,已发现的鸭AvBDs蛋白对不同细菌的抑菌作用不同,鸭AvBD6能够强烈地抗枯草芽孢杆菌,多杀性巴氏杆菌和金黄色葡萄球菌,而对兔波士杆菌的作用一般;鸭AvBD16对奇异变形杆菌具有极强的抑制作用,对鸡白痢沙门氏菌和绿脓杆菌的抗菌活性相对较弱[9]。防御素的抗菌作用可能与其(两亲性)和阳离子性分子特性有关[3-5,11],目前,对于禽β-防御素的抗菌机制未有定论,公认说法是防御素可以在细菌的细胞膜上形成离子通道,即防御素通过静电作用被吸附到细菌表面,将疏水端插入细菌膜中从而改变其膜结构,造成细菌膜穿孔进而使细菌裂解死亡[3-6]。鸭AvBD5蛋白与其他已发现鸭AvBDs蛋白相比,对奇异变形杆菌、大肠杆菌、兔波士杆菌、猪霍乱沙门氏菌等革兰氏阴性菌的抑制作用较弱,这可能是与鸭AvBD1(+8.89)、鸭AvBD3(+5.06)和鸭 AvBD6(+7.89)所带的电荷相比,鸭AvBD5成熟肽段所带正电荷数(+2.9)最少,因此削弱其抗菌活性[9]。β-防御素是禽类先天具有的免疫防御系统的重要组成部分,由于其体内缺乏过氧化氢和髓过氧化物酶而导致氧化机能受到影响,所以只能依赖酶、阳性蛋白和多肽等非氧化机制发挥抗菌作用[6,10,12]。
根据本试验结果可知,在150 mmol·L-1高盐离子浓度条件下,重组鸡AvBD12蛋白抗兔波氏杆菌活性显著下降,而对金黄色葡萄球菌仍具有很强抑制作用,但重组鸡AvBD12蛋白抗兔波氏杆菌和金黄色葡萄球菌活性随着盐离子浓度升高而降低,表明防御素抗菌作用具有一定的盐离子浓度依赖性。本研究抗菌试验部分以盐离子浓度为148 mmol·L-1的PBS作为稀释液,其抗金黄色葡萄球菌和兔波氏杆菌活性均低于不含NaCl的处理中重组蛋白的抗菌活性,推测可能是氯离子和钠离子对防御素抗菌活性产生拮抗作用,该结果与Hancock等报道结论相符[10,12]。但盐离子浓度如何影响防御素的抗菌作用仍不明确,有待进一步研究。由试验结果得出,重组蛋白对鸡血红细胞溶血活性极低,对细胞没有毒性作用,这与其他AvBDs重组蛋白生物学作用的研究结果一致[12,17-18]。该现象可能是因为真核细胞膜上存在大量的膜蛋白、胆固醇和外层糖脂与糖蛋白组成的糖复合物糖起到物理屏障作用,阻碍防御素的疏水端插入脂质双分子层中,确保真核细胞膜免受损害,使细胞结构趋于稳定[19]。
本研究表明,AvBD12在鸡的所检测的15个组织脏器中都有广泛表达。在腺胃、肾脏、十二指肠、小肠、大肠、盲肠、盲肠扁桃体和法氏囊的表达量较高;在肺脏、气管、哈腺中表达量相对较低。Higg等研究表明,β-防御素基因在不同组织中表达的差异性与其相应功能有关[7]。AvBD10在鹅和鹌鹑各组织脏器中广泛表达,在骨髓、法氏囊、小肠、盲肠扁桃体组织中的表达量相对较高[10,20],由此可见,防御素在肠道和免疫器官大量表达,可推测防御素作为宿主天然免疫第一道防线对抵抗病原入侵具有重要作用。此外,还可能因特定病原或外部因素诱导AvBDs表达,而使不同AvBDs间存在组织表达特异性[21]。Das等研究表明,精液中AvBD5、AvBD9、AvBD10和AvBD12基因的表达量因LPS刺激而显著增加[22]。与此相似,感染肠炎沙门氏菌可诱导鸡卵巢组织中AvBD4、5、7、11和12表达量显著上调[23]。炎性细胞因子(如IL-1β、IL-6和TNF-α)还可作为防御素(如人β-防御素2)有效的诱导剂和上调剂,推测防御素基因表达增强通常与病原感染引起的高度炎性反应有关[22]。因此,防御素基因表达多态性(SNPs)可能成为相关疾病的检测手段,可为研究宿主和病原体相互作用关系奠定理论基础。
4 结论
本试验从鸡脾脏细胞中克隆到鸡AvBD12基因,该基因编码区大小为198 bp,编码65个氨基酸。重组鸡AvBD12融合蛋白分子质量大小约为14 ku,该重组蛋白具有广谱抗菌活性,对鸡红细胞无显著溶血活性。高盐浓度对重组鸡AvBD12融合蛋白抗菌活性有显著影响。AvBD12基因在鸡体内广泛分布。
[1] Neumann G,Chen H,Gao G F,et al.H5N1 influenza viruses:outbreaks and biological properties[J].Cell Research,2010,20(1):51-61.
[2] Parsons B N,Humphrey S,Salisbury A M,et al.Invasive non-typhoidal Salmonella Typhimurium ST313 are not host-restricted and have an invasive phenotype in experimentally infected chickens[J].PLoS Negl Trop Dis,2013,7(10):e2487.
[3] Van Dijk A,Veldhuizen E J,Haagsman H P.Avian defensins[J].Vet Immunol Immunopathol,2008,124(1):1-18.
[4] Sugiarto H,Yu P L.Avian antimicrobial peptides:the defense role of beta-defensins[J].Biochem Biophys Res Commol/Lun,2004,323(3):721-727.
[5] Martin E,Ganz T,Lehrer R I.Defensins and other endogenous peptide antibiotics of vertebrates[J].J Leukoc Biol,1995,58(2):128-136.
[6] 马得莹,韩宗玺,廖文艳.禽β-防御素的研究进展[J].农业生物技术学报,2007,15(2):341-345.
[7] Higgs R,Lynn D J,Gaines S,et al.The synthetic form of a novel chickenβ-defensin identified in silico is predominantly active against intestinal pathogens[J].Immunogenetics,2005,57(1-2):90-98.
[8] Evans E W,Beach F G,Moore K M,et al.Antimicrobial activity of chicken and turkey heterophil peptides CHP1,CHP2,THP1,and THP3[J].Veterinary Microbiology,1995,47(3-4):295-303.
[9] Ma D,Zhang K,Zhang M,et al.Identification,expression and activity analyses of five novel duck beta-defensins[J].PLoS One,2012,7(10):e47743.
[10] Ma D,Zhou C,Zhang M,et al.Functional analysis and induction of four novel goose(Anser cygnoides)avianβ-defensins in response toSalmonella enteritidisinfection[J].Comp Immol/Lunol Microbiol Infect Dis,2012,35(2):197-207.
[11] Hancock R E,Diamond G.The role of cationic antimicrobial peptides in innate host defences[J].Trends in Microbiology,2000,8(9):402-410.
[12] 张名岳,周财源,韩宗玺,等.鹅β-防御素3基因的分离、鉴定及其表达产物的生物学特性[J].生物工程学报,2011,27(12):1711-1721.
[13] Gu Y,Dong N,Shan A,et al.Antitumor effect of the antimicrobial peptide GLI13-8 derived from domain of the avianβ-defensin-4[J].Acta Biochimica et Biophysica Sinica,2013,45(11):904-911.
[14] Yang Y,Jiang Y,Yin Q,et al.Chicken intestine defensins activated murine peripheral blood mononuclear cells through the TLR4-NF-κB pathway[J].Vet Immunol Immunopathol,2010,133(1):59-65.
[15] 吴静,史玉颖,李玉峰,等.鸡β-防御素-1基因在大肠杆菌中的融合表达及其初步纯化与抗菌活性测定[J].家禽科学,2013,(1):7-11.
[16] Ma D Y,Liu S W,Han Z X,et al.Expression and characterization of recombinant gallinacin-9 and gallinacin-8 inEscherichia coli[J].Protein Expression and Purification,2008,58(2):284-291.
[17] 韩宗玺,廖文艳,王瑞琴,等.重组鸭β-防御素6基因的表达和生物学特性的研究[J].中国预防兽医学报,2009(6):476-480.
[18] 廖文艳,马得莹,刘胜旺,等.重组鸡β-防御素10蛋白的原核表达及其抗菌活性的测定[J].中国预防兽医学报,2008(10):765-769.
[19] Ishitsuka Y,Pham D S,Waring A J,et al.Insertion selectivity of antimicrobial peptide protegrin-1 into lipid monolayers:effect of head group electrostatics and tail group packing[J].Biochem Biophys Acta,2006,1758(9):1450-1460.
[20] 蔺利娟,王瑞琴,韩宗玺,等.鹌鹑β-防御素10基因的克隆与表达及其体内分布的检测[J].中国预防兽医学报,2011,33(7):552.
[21] Hellgren O,Ekblom R.Evolution of a cluster of innate immune genes(β-defensins)along the ancestral lines of chicken and zebra finch[J].Immunome Research,2010,6(1):3.
[22] Das S C,Isobe N,Yoshimura Y.Expression of Toll-like receptors and avianβ-defensins and their changes in response to bacterial components in chicken sperm[J].Poultry Science,2011,90(2):417-425.
[23] Michailidis G,Avdi M,Argiriou A.Transcriptional profiling of antimicrobial peptides avianβ-defensins in the chicken ovary during sexual maturation and in response toSalmonella enteritidisinfection[J].Research in Veterinary Science,2012,92(1):60-65.
