ACOX3基因多态性对鸡体脂沉积的影响
2014-03-12赵士初黄学涛王守志
李 辉,赵士初,黄学涛,王守志
(农业部鸡遗传育种重点实验室,黑龙江省普通高等学校动物遗传育种与繁殖重点实验室,东北农业大学动物科学技术学院,哈尔滨 150030)
育种工作者对肉鸡生长速度的高强度选择,导致肉鸡生长速度加快,同时产生体脂过度沉积、腹水综合症等负面效应[1]。鸡体脂主要包括腹脂、皮下脂肪和肌间脂肪。腹脂、皮下脂肪是屠宰场废弃物主要来源,肉鸡的腹脂重可达胴体重10%~15%[2],降低经济效益,造成环境污染。近年来,鸡体脂过度沉积问题已成为关注焦点。但采用传统育种方法,依据个体表型值和生理生化指标对鸡脂肪性状进行选择,进展缓慢。在分子水平上研究影响体脂沉积候选基因,寻找相关分子遗传标记,进行标记辅助选择将是更为有效的选种方法[3-4]。
酰基辅酶A氧化酶3(Acyl-Coenzyme A Oxidas⁃es 3,ACOX3)是过氧化物酶体脂肪酸β-氧化过程中的氧化酶之一,是2-甲基支链脂肪酸β-氧化的重要限速酶。过氧化物酶体β-氧化是植物和几种真菌的主要脂肪酸代谢途径[5-6]。在哺乳动物中,过氧化物酶体β-氧化与线粒体氧化体系联合,主要分解长链、超长链和支链脂肪酸等[7]。此外,过氧化物酶体β-氧化体系与多不饱和脂肪酸(PUFA)合成有一定关系[8-9]。因此,可推测ACOX3基因是影响体脂沉积的重要基因之一。
鸡ACOX3基因位于4号染色体,全长33090 bp,包含18个外显子,mRNA长3013 bp。本研究以鸡ACOX3基因为候选基因,选取东北农业大学高、低脂双向选择品系肉鸡为试验材料,检测该基因多态性,分析等位基因频率在高、低脂系间差异,及该基因多态性对脂肪性状影响,以期了解该基因对鸡体脂沉积影响,寻找可用于脂肪性状分子标记辅助选择的遗传标记。
1 材料与方法
1.1 试验群体及基因组
东北农业大学肉鸡高、低脂双向选择品系第8世代315只公鸡、9世代371只公鸡、10世代610只公鸡、11世代485只公鸡。7周龄翅静脉采血,血样用4%EDTA抗凝,离心去血浆后酚仿抽提基因组,基因组DNA用TE溶解,-20℃保存。
1.2 性状测定
7周龄屠宰,称量活重(Body weight,BW)、腹脂重(Abdominal fat weight,AFW),计算腹脂率,用肝素-镁简易比浊法测定血浆极低密度脂蛋白(Very low density lipoprotein,VLDL)浓度。
1.3 引物设计与PCR扩增
根据GenBank公布的鸡ACOX3基因序列(NC_006091),设计ACOX3基因5'侧翼区测序引物ACO5R/F(见表1),扩增长度1411 bp。

表1 鸡ACOX3基因引物Table 1 Primers of chicken ACOX3 gene
选取东北农业大学肉鸡高、低脂双向选择品系第10世代高、低脂系各2只,白耳黄鸡2只,共计6只鸡的基因组为模板进行PCR扩增,扩增得到PCR产物连接到pMD18-T载体测序。利用DNAMAN软件对测序结果进行比对,寻找多态位点。
针对测序发现的多态性位点以及UCSC数据库(http://genome.ucsc.edu)公布的ACOX3基因多态性位点,利用Primer5.0软件分别设计扩增引物,见表1。
PCR反应体系(10μL):50ng·μL-1基因组DNA1 μL、10×PCRBuffer 1μL、10mmol·L-1dNTP0.8μL、10μmol·L-1上下游引物各0.25μL、5U·μL-1TaqDNA聚合酶0.1μL、ddH2O7.1μL。
PCR反应程序:94℃预变性7 min;34个循环(94℃变性30 s、48.8~58.0℃退火30 s、72℃延伸30 s);72℃终延伸7 min;4℃保存。
1.4 统计分析
根据东北农业大学肉鸡高、低脂双向选择品系群体的特点,构建线性模型如下:

Y为性状观察值,μ为群体均值,G为基因型固定效应,L为品系固定效应,GE为世代固定效应,G*L为基因型与品系的互作效应,G*GE为基因型与世代的互作效应,BW7作为协方差变量,e为剩余值。
家系效应和母鸡效应对性状无显著影响,因此以上模型不考虑这两个效应。模型①②用于高、低脂双向选择品系不同世代混合群体,模型③④用于高、低脂双向选择品系单个世代。运用统计软件JMP4.0[10],分别计算基因型与性状的相关,估计性状的最小二乘均值。P<0.05表示有显著影响,P<0.2表示有一定影响。
基因型的显性度计算模型如下:

d为显性度,A为加性效应,D为显性效应,AA和BB为不同等位基因的纯合子的最小二乘均值,AB为杂合子的最小二乘均值。
2 结果与分析
2.1 基因型分析
2.1.1ACOX3基因c.-442A>C位点的基因型分析
测序发现ACOX3基因转录起始位点上游442 bp处发生A>C的突变,命名为c.-442A>C。利用引物-442F、-442R,以肉鸡高、低脂双向选择品系第8~11世代群体基因组为模板进行PCR扩增。PCR产物用限制性内切酶HhaⅠ消化后,用2%琼脂糖凝胶进行电泳分型,结果显示出3种基因型,分别命名为AA、CC、AC,见图1。

图1 鸡ACOX3基因多态性位点c.-442A>C PCR-RFLP分型胶Fig.1 PCR-RFLP pattern of the polymorphic site c.-442A>C in chicken ACOX3 gene
2.1.2ACOX3基因c.-228C>T位点的基因型分析
测序发现ACOX3基因转录起始位点上游228 bp处发生C>T的突变,命名为c.-228C>T。利用引物-228F、-228R,以肉鸡高、低脂双向选择品系第10、11世代群体基因组为模板进行PCR扩增。PCR产物用限制性内切酶PvuⅡ消化后,用14%的聚丙烯酰胺凝胶进行电泳分型,结果显示出3种基因型,分别命名为CC、TT、CT,见图2。
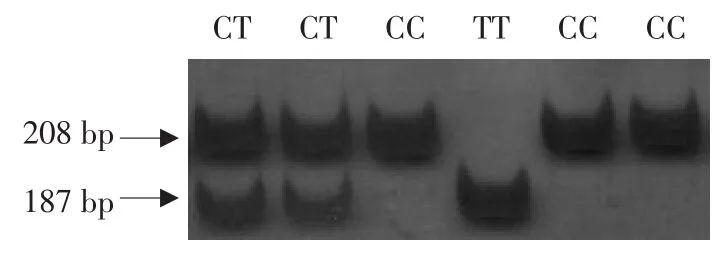
图2 鸡ACOX3基因多态性位点c.-228C>T PCR-RFLP分型胶Fig.2 PCR-RFLP pattern of the polymorphic site c.-228C>T in chicken ACOX3 gene
2.1.3ACOX3基因c.27035A>G位点的基因型分析
UCSC数据库公布的位点snp.13.324.6934.S.2是位于ACOX3基因27035 bp处的A>G突变,命名为c.27035A>G。利用引物SNP2F、SNP2R,以肉鸡高、低脂双向选择品系第10、11世代群体基因组为模板进行PCR扩增。PCR产物用限制性内切酶XspⅠ消化后,用3%琼脂糖凝胶进行电泳分型,结果显示出3种基因型,分别命名为AA、GG、AG,见图3。

图3 鸡ACOX3基因多态性位点c.27035A>G PCR-RFLP分型胶图Fig.3 PCR-RFLP pattern of the polymorphic site c.27035A>G in chicken ACOX3 gene
2.1.4ACOX3基因c.16802C>T位点基因型分析
UCSC数据库公布的位点snp.31.121.215648.S.2是位于ACOX3基因16802 bp处的C>T突变,命名为c.16802C>T。利用引物SNP4F、SNP4R,以肉鸡高、低脂双向选择品系第11世代群体基因组为模板进行PCR扩增。PCR产物用限制性内切酶HinfⅠ消化后,用2.5%琼脂糖凝胶进行电泳分型,结果显示出3种基因型,分别命名为TT、CC、TC,见图4。

图4 鸡ACOX3基因多态性位点c.16802C>T PCR-RFLP分型胶Fig.4 PCR-RFLP pattern of the polymorphic site c.16802C>T in chicken ACOX3 gene
2.2 等位基因频率分析
东北农业大学肉鸡高、低脂双向选择品系从1996年建立零世代起,根据家系及个体腹脂率和血浆VLDL浓度等指标对体脂性状进行选育,到2009年已选育13个世代,两系(低脂系、高脂系)间腹脂性状在第4世代已显著分离[10]。由于高脂系与低脂系的遗传背景相同,影响鸡体腹脂性状的等位基因频率会随着腹脂性状的分离而发生分离。分析等位基因频率在两系间的差异,将为鉴定影响鸡体脂性状的分子标记提供依据(见表2)。

表2 ACOX3基因多态位点等位基因频率在第8~11世代两系间的比较Table 2 Comparisons of allele frequencies of ACOX3 gene polymorphisms in two lines of generations 8 to 11
对ACOX3基因多态位点在各世代中对同一世代内不同品系间等位基因频率进行卡方独立性检验,结果表明4个多态位点除c.27035A>G外,c.-442A>C、c.-228C>T和c.16802C>T多态位点等位基因频率均差异极显著(P<0.01)(见表2,图5)。
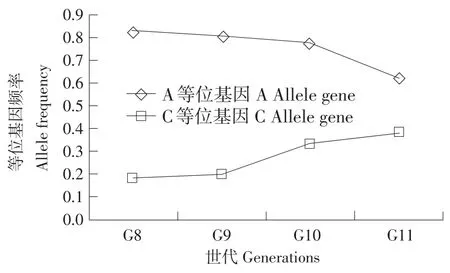
图5 ACOX3基因c.-442A>C位点等位基因频率在第8~11世代低脂系变化趋势Fig.5 Trend of allele frequencies in the lean line of generations 8 to 11
2.3 ACOX3基因多态性与鸡脂肪性状的相关分析
ACOX3基因c.-442A>C位点在肉鸡高、低脂双向选择品系第8~11世代组成的混合群体中,对脂肪性状无显著影响;在低脂系中,该点对腹脂重有显著影响(P<0.05),对腹脂率有一定影响(P<0.2);在高脂系中,该点对脂肪性状无显著影响(见表3)。各基因型最小二乘均值比较结果表明,在低脂系,AA基因型个体腹脂重和腹脂率显著高于AC基因型个体(P<0.05)(见表4)。
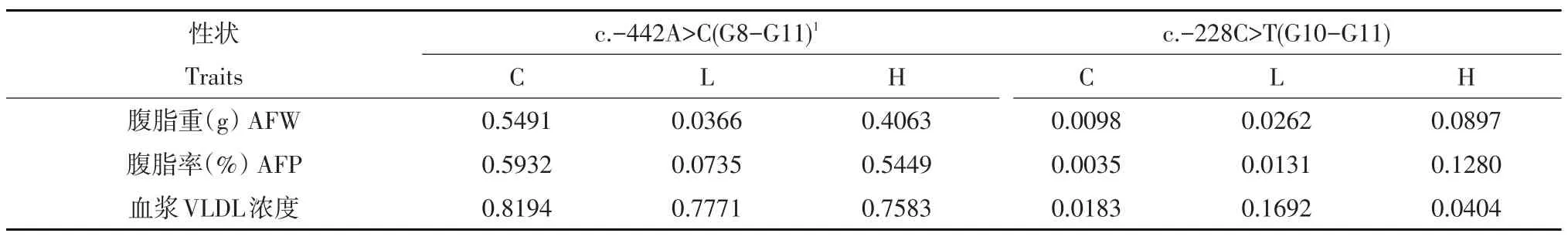
表3 ACOX3基因多态位点c.-442A>C、c.-228C>T对鸡脂肪性状的影响(P值)Table 3 Effects of ACOX3 gene c.-442A>C,c.-228C>T polymorphisms on chicken fat traits(P value)
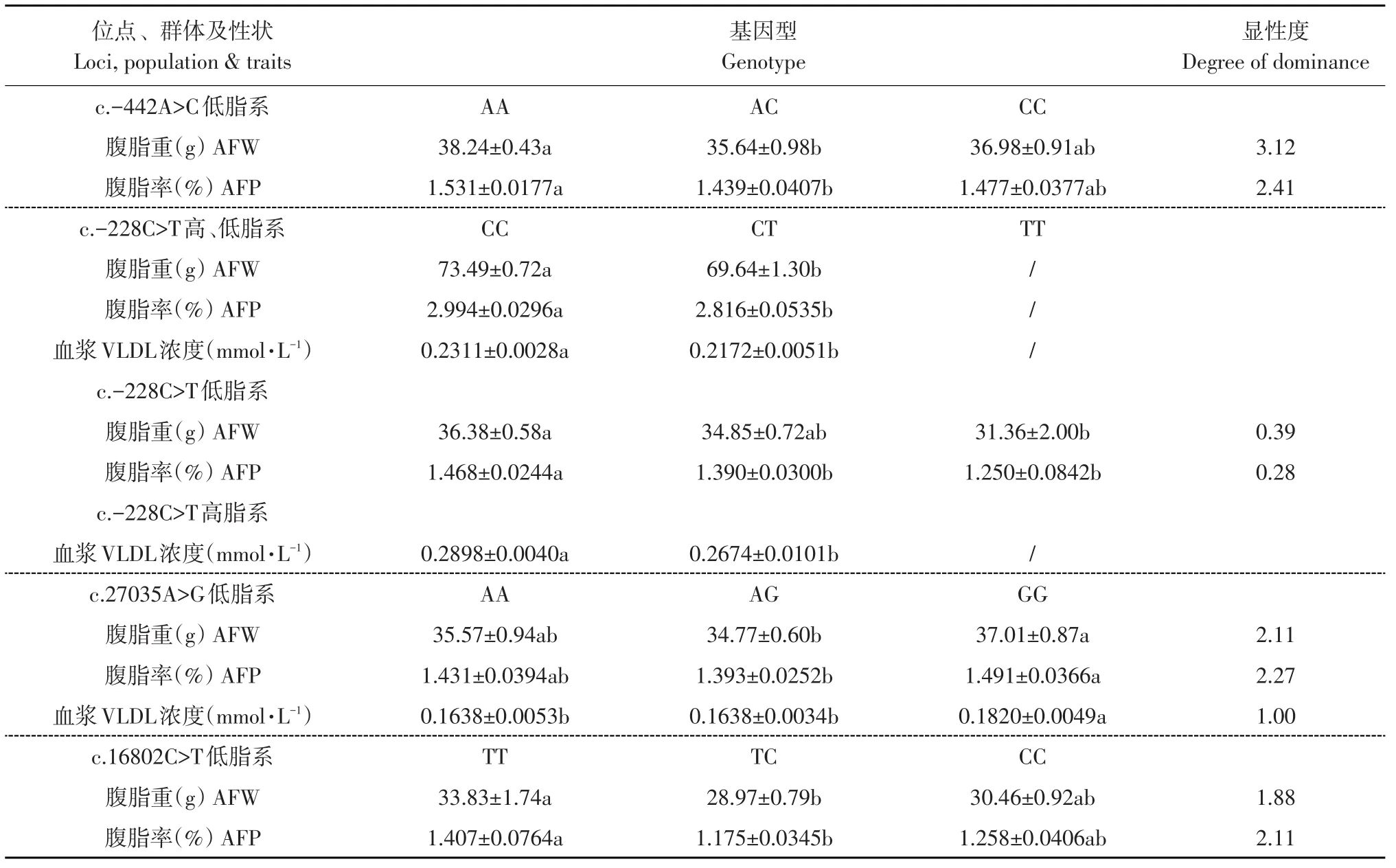
表4 ACOX3基因多态位点对鸡脂肪性状的影响(最小二乘均值及显性度)Table 4 Effects of ACOX3 gene polymorphisms on chicken fat traits(LSM and Degree of dominance)
ACOX3基因c.-228C>T位点在肉鸡高、低脂双向选择品系第10、11世代组成的混合群体中,对腹脂重、腹脂率及血浆VLDL浓度有显著影响(P<0.05);在低脂系中,该点对腹脂重和腹脂率有显著影响(P<0.05),对血浆VLDL浓度有一定影响(P<0.2);在高脂系中,该点对血浆VLDL浓度有显著影响(P<0.05),对腹脂重和腹脂率有一定影响(P<0.2)(见表3)。
各基因型最小二乘均值比较结果表明:在混合群体中,CC基因型个体腹脂重、腹脂率、血浆VLDL浓度显著高于CT基因型个体(P<0.05);在低脂系,CC基因型个体腹脂重显著高于TT基因型个体,CC基因型个体腹脂率显著高于CT和TT基因型个体(P<0.05);在高脂系,CC基因型个体血浆VLDL浓度显著高于CT基因型个体(P<0.05)(见表4)。
ACOX3基因c.27035A>G位点在肉鸡高、低脂双向选择品系第10、11世代组成的混合群体中,对脂肪性状没有显著影响;在低脂系中,该点对血浆VLDL浓度有显著影响(P<0.05),对腹脂重和腹脂率有一定影响(P<0.2);在高脂系中,该点对脂肪性状也没有显著影响(见表5)。各基因型最小二乘均值比较结果表明:在低脂系,GG基因型个体腹脂重和腹脂率显著高于AG基因型个体,GG基因型个体血浆VLDL浓度显著高于AA和AG基因型个体(P<0.05)(见表4)。

表5 ACOX3基因多态位点c.27035A>G、c.16802C>T对鸡脂肪性状的影响(P值)Table 5 Effects of ACOX3 gene c.27035A>G,c.16802C>T polymorphisms on chicken fat traits(P value)
ACOX3基因c.16802C>T位点在肉鸡高、低脂双向选择品系第11世代群体(高、低脂系混合群体)中,对脂肪性状均无显著影响;在低脂系中,对腹脂重和腹脂率有显著影响(P<0.05);在高脂系中,对脂肪性状均无显著影响(见表5)。各基因型最小二乘均值比较结果表明:在低脂系,TT基因型个体腹脂重和腹脂率显著高于TC基因型个体(P<0.05)(见表4)。
3 讨论
3.1 鸡ACOX3基因多态性的群体遗传学分析
东北农业大学肉鸡腹脂双向选择品系由高脂系和低脂系组成,两个品系以AA肉鸡群体为共同祖先,针对腹脂和血浆VLDL浓度性状向两个相反的方向进行选择。上随着选择世代增加,腹脂和血浆VLDL浓度性状分离,影响这些性状的等位基因频率在两系间会逐渐分离。本研究检测的ACOX3基因的多态位点c.-442A>C、c.-228C>T和c.16802C>T等位基因频率在高、低脂系间的差异均达到极显著水平(P<0.01)(见表2)。选择是导致群体基因频率改变的重要因素[11],两系间等位基因频率的差异很有可能因体脂性状选择造成。推测这些位点可能影响体脂性状,ACOX3基因可能与鸡的体脂沉积有关。
3.2 鸡ACOX3基因多态性对脂肪性状的影响
ACOX3基因是过氧化物酶体脂肪酸β-氧化过程中的重要氧化酶之一,过氧化物酶体是脂肪酸氧化的重要场所。在哺乳动物中,过氧化物酶体主要氧化分解长链、超长链和支链脂肪酸,过氧化物酶体的功能障碍会造成很多脂肪酸的过度沉积,引起代谢疾病[12]。组织表达规律研究表明,ACOX3在小鼠白色脂肪组织中的表达量最高[13]。本课题组研究表明,在肉鸡高、低脂双向选择品系7周龄脂肪组织中,高脂系个体ACOX3基因的表达量是低脂系的两倍多[14]。因此,ACOX3基因对脂肪的沉积有重要影响。
本研究发现,ACOX3基因c.-228C>T突变位点在高、低脂双向选择品系混合群体中,对腹脂重、腹脂率、血浆VLDL浓度有显著影响(P<0.05);CC基因型个体的腹脂重、腹脂率和血浆VLDL浓度显著高于CT基因型个体。对高、低脂系分别进行分析时发现,该位点对这些体脂性状有不同程度影响,在低脂系中,此位点对腹脂重和腹脂率的影响较大,在高脂系中则对血浆VLDL浓度影响较大。在低脂系,CC基因型个体腹脂率显著高于CT和TT基因型个体;在高脂系,CC基因型个体血浆VLDL浓度显著高于CT基因型个体。在低脂系,显性度分析显示,该位点基因型对脂肪性状以加性效应为主(见表4)。基因频率分析显示,随着世代选择,C等位基因频率在高脂系中逐渐上升,在第11世代达到0.94(见表2)。综上可见,C等位基因可增加体脂沉积。
ACOX3基因c.-442A>C、c.27035A>G、c.16802C>T突变位点,在高、低脂系合并分析时,发现其对体脂性状没有影响。但对高、低脂系分别进行分析时发现,在低脂系中这些突变位点对体脂性状有不同程度影响;在高脂系中没有发现这些突变位点对体脂性状的影响(见表3,5)。在低脂系中,最小二乘均值比较结果表明,c.-442A>C、c.27035A>G、c.16802C>T突变位点的杂合基因型个体腹脂重、腹脂率和血浆VLDL浓度的均值在三种基因型中最低,而且显著低于其中一种纯合子(见表4)。显性度分析显示,这些位点的基因型对脂肪性状有超显性效应(见表4)。当以腹脂重(率)和血浆VLDL浓度进行选择时,杂合基因型个体被选留的概率比纯合基因型个体大,即为超显性选择。在超显性选择下,群体迟早将达到一种两等位基因共存的平衡状态[15]。本研究发现,随着世代选择,c.-442A>C位点两等位基因在低脂系内频率差异有减少的趋势(见图4)。
研究表明,对目标性状的选育会导致品系间遗传背景的差异[16-17]。东北农业大学肉鸡高、低脂系虽然源自同一祖先,但是经过数代选择,两系的遗传背景已经产生一定差异。本研究检测的ACOX3基因的四个突变位点对低脂系脂肪性状均有显著影响,而对高脂系影响不显著。由于受试验群体遗传背景的影响较大,所以,本研究相关分析的结果还需在其他群体中进一步验证。
4 结 论
本研究表明,ACOX3基因多态性对鸡的体脂沉积有重要影响。ACOX3基因c.-228C>T突变位点对鸡的腹脂重、腹脂率、血浆VLDL浓度有显著影响,可尝试作为遗传标记对脂肪性状进行分子标记辅助选择。
[1] Griffin H D.Understanding genetic variation in fatness in chickens.Annual report[M].Edinburgh,UK:Roslin institute,1996:35-38.
[2] Havenstein G B,Ferket P R,Qureshi M A.Carcass composition and yield of 1957 versus 2001 broilers when fed representative 1957 and 2001 Broiler Diets[J].Poultry Sci,2003,82(10):1509-1518.
[3] Li H,Deeb N,Lamont S J,et al.Chicken quantitative trait loci for growth and body composition associated with the very low density apolipoprotein-II gene[J].Poultry Sci,2005,84(5):697-703.
[4] 王宇祥,李辉.生物技术在家禽育种中的应用[J].东北农业大学学报,2005,36(2):249-252.
[5] Hooks M A,Kellas F,Graham I A.Long-chain Acyl-coA Oxidas⁃es of Arabidopsis[J].The Plant Journal,1999,20(1):1-13.
[6] Kunau W H,Dommes S V,Schulz H.β-oxidation of fatty acids in mitochondria,peroxisomes,and bacteria:a century of contin⁃ued progress[J].Progress in lipid research,1995,34(4):267-342.
[7] Wanders R J,Peroxisomes,lipid metabolism,and peroxisomal dis⁃orders[J].Molecular Genetics and Metabolism,2004,83(1-2):16-27.
[8] Qiu X.Biosynthesis of docosahexaenoic acid(DHA,22:6-4,7,10,13,16,19):two distinct pathways[J].Prostaglandins Leukot Essent Fatty Acids,2003,68(2):181-186.
[9] Sprecher H.The roles of anabolic and catabolic reactions in the synthesis and recycling of polyunsaturated fatty acids[J].Prosta⁃glandins Leukot Essent Fatty Acids,2002,67(2-3):79-83.
[10] 王启贵,史树军,孟和,等.肉鸡血浆VLDL双向选择对腹脂和体重影响的研究[J].中国家禽,2002,24(2):17-18.
[11] 盛志廉,陈瑶生.数量遗传学[M],北京:科学出版社,1999:34-56.
[12] Ronald J A,Wanders.Metabolic and molecular basis of peroxi⁃somal disorders[J].American Journal of Medical Genetics,2004,126A:355-375.
[13] Maria A K Westin,Mary Chunt,Stefan E H.Alexson.Peroxi⁃somes contain a specific Phytanoyl-CoA/Pristanoyl-CoA thioes⁃terase acting as a novel auxiliary enzyme in α-andβ-Oxidation of Methyl-branched tatty acids in mouse[J].J Biol Chem,2007,282(37):26707-26716.
[14] 王洪宝,王启贵,李辉.利用基因芯片技术研究两品种鸡脂肪组织差异表达基因[J].生物工程学报,2005,21(6):979-982.
[15] Wen-Hsiung Li,Dan Graur.Fundamentals of molecular evolution[M].Massachusetts USA:Sinauer Associates,Inc.1991:336-365.
[16] Koenen M,Boonstra-Blom A G,Jeurissen S H.Immunological differences between layer-and broiler-type chickens[J].Vet Im⁃munol Immunopathol,2002,89(122):47-56.
[17] 吴宪文,金鹏程,王守志,等.KDR等6个基因多态性与鸡生长和体组成性状的相关研究[J].东北农业大学学报,2012,43(12):39-45.
