脑出血大鼠模型中血清IL-1β 的表达与脑水肿关系及意义探讨
2014-03-11魏平波
魏平波,游 潮,陈 浩,何 俊,林 斌
白细胞介素1 是高血压脑出血后重要的促炎症细胞因子,动物实验显示,高血压脑出血后的炎症反应是出血后神经元继发性损害及神经功能障碍加重的重要因素[1]。因为对高血压脑出血患者出血灶周围的促炎症细胞因子变化进行研究,存在取材困难和伦理学方面问题,所以近年来已经鲜有报道。我们选用高血压大鼠制作脑出血模型,探讨其出血后外周血血清中IL-1β 的表达与脑水肿程度的相关性,现将研究情况报道如下。
1 材料与方法
1.1 实验动物与分组 由四川大学华西动物实验中心提供自发性高血压大鼠(spontaneously hypertensive rats,SHR),雄性,年龄均为12±2 w,共60只,体重210~260 g,采用多层层流架饲养,恒温(20 ℃~25 ℃)。动物分组:将60 只大鼠随机分成两组:(1)CH 组30 只,按出血时间随机分为8 h、16 h、24 h、48 h、72 h、120 h 共6 组,每组5 只;(2)对照组30 只,也按出血时间随机分为8 h、16 h、24 h、48 h、72 h、120 h 共6 组,每组5 只;每组均在实验前用小动物无创血压测量系统进行尾动脉血压监测。
1.2 ICH 组实验模型的建立(1)ICH 组大鼠采用自体血注入法建立大鼠模型[2];(2)对照组实验大鼠模型建立方法同实验组,但只是完成刺入动作,不注入血液。
1.3 成功模型的筛选与行为学评定 采用Longa、Berderson 评分法[3,4]筛选成功模型,分值与对照组进行统计学分析;有行为学异常的为成功模型,进入实验组继续试验,不成功模型废弃,重新制作补足试验数量;本试验组大鼠模型30 只,一次性模型制作28 只,余2 只在术后死亡,重新制作。采用此方法一次性模型制作成功率达93.3%(28/30)。
1.4 脑含水量测定 行为学评定后在各时间位点将大鼠模型断头处死,剥离颅骨,取全脑组织作冠状切开了解脑内血肿形成情况后沿中线切开,各组大鼠模型右脑组织称测湿重,再经过90 ℃~110 ℃烘干24 h 后测定干重。脑组织含水量=(脑组织湿重-脑组织干重)/脑组织湿重×100%。
1.5 血清IL-1β 测定 ICH 组和对照组大鼠模型均按照随机分组原则分为A(A1-A5)、B(B1-B5)、C(C1-C5)、D(D1-D5)、E(E1-E5)、F(F1-F5)组,共6 组,每组5 只,分别对应8 h、16 h、24 h、48 h、72 h、120 h 6 个不同出血时间位点完成行为学评定后,抽取左股动脉血1 ml 采用IL-1βELISA 试剂盒(上海瑞齐生物科技有限公司),按照血清IL-1β测定步骤进行血清IL-1β 测定。
1.6 统计学处理 采用SPSS12.0 统计软件进行统计学分析,各项检测结果以均数±标准差(±s)表示。两组间比较用t 检验,多组间用单因素方差分析(one way ANOVA),取P<0.05 为有统计学差异。
2 结果
2.1 术前ICH 组与对照组大鼠体重及血压比较无统计学差异(见表1)。
2.2 两种行为学评分法对术后不同时间位点两组大鼠的行为学进行评定 结果ICH 组模型麻醉清醒后即可观察到其行为学异常,对照组无行为学异常;两组大鼠在8 h~72 h 之间的5 个时间位点上采用两种评分方法其分值比较均有统计学差异,提示其行为学改变与脑损伤是密切联系的,在120 h时其行为学异常已明显改善。模型制作过程中有2只分别在术后1 d 和3 d 死亡,可能系血肿引发的水肿肿胀致脑疝死亡,不纳入实验统计,重新制作新模型纳入实验(见表2)(对照组均为0 分)。
2.3 ICH 组大鼠与对照组脑含水量的变化在8 h 组和16 h 组与对照组相比无显著统计学差异(P>0.05),但16 h 组较8 h 组已开始升高,24 h、48 h、72 h 3 组的脑平均含水量较8 h 和16 h 组进一步升高,与对照组相比有统计学差异(P<0.05),并出现明显的行为学异常,其行为学异常程度与脑水肿肿胀程度变化一致,120 h 组已明显下降,与对照组相比无统计学差异(P>0.05),其行为学异常好转;各组间比较,在不同的时间位点,脑含水量值均数不等,各组间比较有统计学差异(P<0.01),因此可认为在脑出血后的不同时间位点其脑含水量是不一致的,在24 h 时逐渐达到高峰,持续到72 h 时开始下降,120 h 时与对照组相比已经无统计学差异(P>0.05)(见表3)。
2.4 两组大鼠不同时间位点外周血IL-1β 含量测定 ICH 后8 h 时即可以监测到外周血IL-1β增高,但增高值与对照组相比无统计学差异(P>0.05),16 h 时外周血IL-1β 增高与对照组已存在统计学差异(P<0.05),在24 h~48 h 外周血IL-1β达到高峰,持续高位维持到72 h 后开始下降,高峰期在48 h 时外周血IL-1β 含量与对照组相比存在明显统计学差异(P<0.01),120 h 时外周血IL-1β含量值仍稍高于对照组,但是二者比较无统计学差异(P>0.05)(见表4)。
2.5 ICH 组模型在出血后其血清IL-1β 含量与脑含水量测定 测定值采用非线性二次项回归分析结果如下:建立非线性二次项回归方程:Y=77.451+0.0001×X2,(r=0.906,P<0.001),2 个变量呈正相关性;其中,Y 表示脑含水量,X 表示血清IL-1β 含量,2 变量的变化关系。

表1 两组大鼠术前体重、血压比较
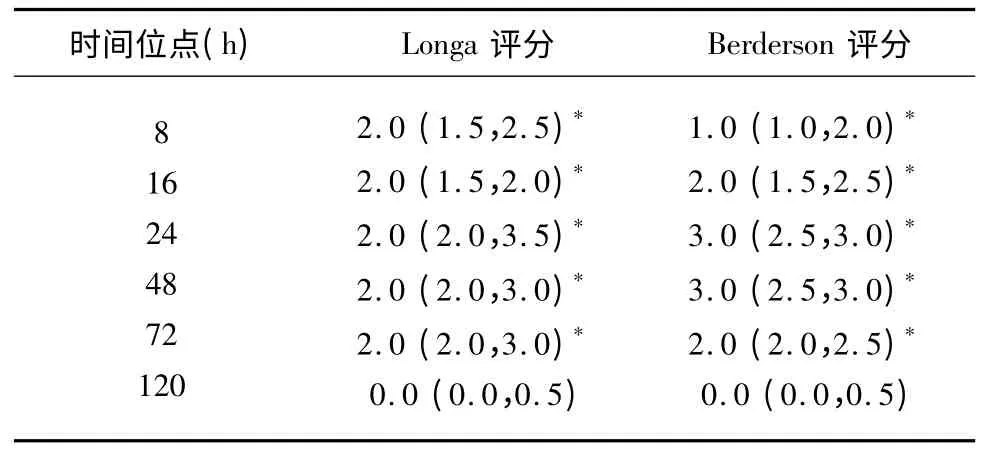
表2 两种行为学评分法对ICH 组大鼠行为学评分

表3 两组大鼠不同时间位点脑含水量测量值变化

表4 两组大鼠不同时间位点血清IL-1β测定值变化(ng/mg·pr)
3 讨论
近年来ICH 后炎症反应对脑水肿的影响已经越来越受到重视,Zhang[5]等以大鼠ICH 模型研究发现,在ICH 后48 h 炎症细胞浸润已经很明显。IL-1β 是IL-1的β 亚型,也是高血压脑出血(ICH)后血肿及其周围组织发生炎症反应的重要细胞因子,Holmin[6]研究发现IL-1 可以破坏血脑屏障(BBB)导致其通透性增加,从而导致并加重血管源性脑水肿。此外IL-1β 尚可促进IL-6、肿瘤坏死因子-α(TNF-α)、克隆刺激因子分泌和加速IL-1β 自身合成,形成出血后损伤[7]。
我们通过动物实验对高血压脑出血后大鼠的血清IL-1β 的监测来了解其变化规律,结果发现:(1)ICH 后血清可以监测到IL-1β 在不同时间位点的变化,这种促炎细胞因子在ICH 后血清中被证实可得到明显的表达。(2)ICH 后以脑含水量代表的脑水肿肿胀的变化过程与血清中IL-1β 的变化过程均是一个从低值到高值,达到波峰后开始下降的过程;ICH 后8 h 时血清中即可监测到IL-1β 增高,在16 h时与对照组已经有统计学差异,在24 h~48 h 时达到高峰,持续性的高位维持到72 h 后开始下降,其中48 h 时统计学差异最为明显,120 h 时IL-1β 仍较对照组偏高,但是已经无统计学差异;而脑含水量在48 h~72 h 达到高峰,与对照组相比有统计学差异。后逐渐开始下降,120 h 时已经无统计学差异;大鼠模型的行为学异常程度亦符合脑水肿的变化规律,120 h 时异常模型已改善。(3)实验证实了血清IL-1β 测量值与脑含水量值两个变量的变化趋势是基本一致的,对两个变量进行相关的统计学分析,求出相关统计学方程可以看出两个变量呈明显正相关。因此在ICH 后脑水肿肿胀程度可以通过血清IL-1β 的变化情况来得到间接的反应,IL-1β 的升高反应了脑水肿加重的程度。IL-1β 由于是一种损伤性的细胞因子,可以破坏血脑屏障(BBB)导致其通透性增加,从而导致并加重血管源性脑水肿;因此IL-1β 的变化可能间接反应了血脑屏障受破坏的程度,或者说反应了血管源性脑水肿的程度;(4)实验我们还发现血清IL-1β 测量值在ICH 后16 h 时与对照组相比已出现统计学差异,而脑含水量的变化是在ICH 后24 h 与对照组相比才出现统计学差异,其峰值较脑水肿峰值来的更早。因此可以认为血清IL-1β 值较早地反应了脑水肿变化程度。通过对血清IL-1β 值的监测可以提前了解到脑水肿的变化是加重或者减轻,从而为临床赢得更多的处理时机。
高血压脑出血是临床常见的脑血管疾病之一,其死亡率一直居各类卒中性疾病前列。目前对于那些出血量中等、意识处于清醒但烦躁或者嗜睡的患者[8],其治疗究竟采用内科保守治疗还是外科手术治疗一直是临床医师的困惑。目前临床上主要依据频繁复查头部CT 来了解脑水肿并根据医师临床经验进行综合判定手术时机。而CT 复查对于危重患者存在搬运风险,医师临床经验的不足导致误判定手术时机可能给患者会带来灾难性的后果。此外颅内压监护作为一种有创监护监测脑水肿需要将传感器植入颅内,且价格昂贵,患者的经济及心理依从性相对较差,因此存在局限。我们在动物实验上证实了血清IL-1β 测量值与脑含水量值两个变量的变化呈正相关,如果临床上高血压脑出血患者也符合这个规律的话,则对于那些ICH 后难以判定是采用手术还是保守治疗的患者进行血清IL-1β 监测,在IL-1β 上升阶段结合传统头部CT 复查和临床经验综合判定无需手术的患者在血清IL-1β 监测的下降阶段就可以放心选择保守治疗。反之,在血清IL-1β 监测的上升阶段患者已经出现意识加深,CT 提示中线结构发生移位等出现手术指征的病例,则不宜继续等待患者观察,应果断采取措施,中转手术。这样,血清IL-1β 监测可以作为一个客观的实验室指标,为临床医师对于ICH 后患者手术时机的选择提供辅助判定的依据。但是,我们目前仅完成的是动物实验,尚缺乏相应的临床资料,对于促炎细胞因子IL-1β 这种新的临床意义有待于今后进一步的临床探讨。
[1]Takizawa T,Tada T,Kitazawa K,et al.Inflammatory cyt okine cascade released by leukocytes in cerebrospinal fluid after cerebral hemorrhage[J].Neurol Res,2001,23(7):724-730.
[2]闫 峰,吉训明,罗玉敏.多种实验动物脑出血模型的制作[J].实验动物科学,2009,26(1):38-40.
[3]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniotomy in rats[J].Stroke,1989,20(1):84-91.
[4]Berderson JB,Pitts LH,Tsuji M,et al.Rat middle cerebral artery occlusion:evaluation of the model and development of neurologic examination[J].Stroke,1986,17:472-476.
[5]Zhang X,Li H,Hu S,et al.Brain edema after intracerebral hemorrhage in rat:the role of inflammation[J].Neurol India,2006,54(4):402-407.
[6]Holmin S,Mathiesen T.Intracerebral administration of interleukin-1 beta and induction of inflammation,apoptosis,and vasogenic edema[J].J Neurosurg,2000,92(1):108-120.
[7]Blamire AM,Anthony DC,Rajgago palan,et al.Interlukin-1beta induced changes in blood barin-barrier permeability,apparent diffusion coefficent,and cerebral blood volume in the rat brain:a magnetic resonance study[J].J Nuersoei,2000,20(21):8153-8159.
[8]魏平波,游 潮,陈 浩.不同方式治疗高血压脑出血的疗效对比中国脑血管病杂志[J].中国脑血管病杂志,2010,7(10):519-522.
