小儿心脏手术后体外膜肺氧合风险因素及预后分析
2014-03-10章晓华周成斌雷迪斯林中林彭勤宝
章晓华,周成斌,陈 萍,雷迪斯,张 力,林中林,彭勤宝,庄 建
·临床研究·
小儿心脏手术后体外膜肺氧合风险因素及预后分析
章晓华,周成斌,陈 萍,雷迪斯,张 力,林中林,彭勤宝,庄 建
目的 探讨小儿心脏手术后体外膜肺氧合(ECMO)预后影响因素。方法 回顾2011年1月至2013年5月25例心脏术后不能脱离体外循环或术后在ICU心脏衰竭或低氧血症的患者使用静脉-动脉ECMO生命支持。比较生存组与死亡组患者的相关临床和实验室检查资料,并评估相关因素对预后的影响。结果 24例患者出现各种并发症57例次;脱离EC⁃MO辅助13例(52%),其中7例(54%)康复出院;红细胞和血浆输入量、血浆丙氨酸氨基转移酶、结合胆红素及白细胞计数水平与ECMO患者的预后显著相关。结论 ECMO为心脏手术后顽固心衰小儿患者生存提供了机会;心脏不可逆损伤、残存心脏病变、大量输血、肝肾损害及感染是导致小儿心脏手术后ECMO失败的主要原因。
体外膜肺氧合;并发症;预后;心脏手术;小儿
体外膜肺氧合(extracorporeal membrane oxygen⁃ation,ECMO)作为一种可相对较长时间进行循环和/或呼吸辅助的方式,近年来为体外循环(extra⁃corporeal circulation,ECC)心脏手术后严重心肺功能衰竭的患者提供了救治机会,并越来越广泛地使用于临床。但来自体外生命支持组织(extracorporeal life support organization,ELSO)的资料显示:ECMO用于心脏术后心脏支持成功率长期以来都明显偏低[1-2〛。本文通过回顾性分析单个中心小儿心脏术后ECMO支持的相关资料,探讨对ECMO预后的影响因素。
1 资料与方法
1.1 一般资料 2010年1月至2013年5月,25例ECC心脏手术后小儿使用ECMO心肺辅助。其中男性20例,女性5例;年龄2 d~14岁,平均(11.80± 33.05)月;体重2.90~26(6.34±4.62)kg。
术前诊断包括:大血管转位8例;Tausing-Bing综合征及室间隔缺损各3例;永存动脉干和法洛四联征各2例;左心发育不良、左冠状动脉起源于肺动脉、单心室、完全和部分肺静脉异位引流、三房心、房间隔缺损各1例。所有患者均在ECC下行相应心脏畸形矫治术。ECC时间34~647(266.36±155.53)min;心脏血流阻断时间17~335(121.68±79.88)min。安装ECMO原因:15例为心脏手术后不能脱离ECC;其余10例为术后在ICU安装ECMO,原因包括心跳聚停、血压不能维持和低氧血症,分别各为5例、4例和1例。
1.2 ECMO方法 22例使用Medtronic小儿ECMO套包;3例使用成人ECMO装置(2例Medtronic、1例Maquet)。均采用静脉至动脉ECMO(VA ECMO)方式。除1例为颈内静脉-颈总动脉插管外,其他均经胸行右心房-升主动脉插管;所有心脏手术不能脱离ECC的患儿均继续使用术中动、静脉插管。除颈部插管的患儿外,其他24例均经左心房置减压管并连接至ECMO引流管。
ECMO过程中使用肝素进行抗凝,全血激活凝血时间(ACT)目标值为140~160 s。对不能脱离ECC患者,在过渡到ECMO后立即使用全量鱼精蛋白进行肝素中和;对在ICU安装ECMO的患者,插管前按100 U/kg体重静脉注入肝素。在ACT低于140 s及无明显出血时开始启动和维持肝素抗凝,并通过调整肝素用量(5~30 U/kg)将ACT控制在目标范围。对有出血倾向患者,ECMO开始后使用氨基己酸100 mg/kg(半小时内静脉滴入),之后使用50 mg/(kg·h)维持剂量,至胸液量明显减少后停用。
对ECMO前存在或怀疑存在中枢神经系统缺血缺氧性损伤的患儿,开始ECMO后在出血被控制的前提下常规采用亚低温疗法,使用氧合器血流变温将患儿直肠温降低至33~34℃,并维持24~72 h。
连续监测ECMO静脉回流血氧饱和度(SvO2)和红细胞比容(Hct),维持SvO2>70%和Hct>0.3。根据患者血流动力学指标和动脉血气分析结果,控制ECMO辅助血流量[100~200 ml/(kg·min)]和ECMO供气状态。呼吸机调整到低压、低频和低氧浓度条件。动态监测心肺功能的恢复情况,包括心脏超声、心电图、血压和脉压差、中心静脉压、正性肌力药物使用情况、X线胸片、动脉血气。血常规、肝肾功能、凝血指标等实验室检查数据采集时点T0~T10,依次分别为开始ECMO当天至ECMO开始后第10天。记录每天血制品使用量。在保证患者组织供血和供氧前提下及时调低ECMO辅助流量,当患者对辅助流量要求低于心输血量30%时,考虑试停ECMO。
1.3 统计学处理 使用SPSS 19.0统计学软件对相关资料进行统计学处理。计量资料采用均数±标准差(±s)表示;单一因素对预后影响采用混合线性模型分析;生存组与死亡组组间计量资料比较采用独立样本t检验,计数资料采用卡方检验。P<0.05视为差异具统计学意义。
2 结 果
2.1 过程和预后 ECMO过程中,1例因人为因素导致管道破裂终止辅助,4例氧合器严重血浆渗漏需更换氧合器。成功脱离ECMO 13例(脱机后生存超过24 h),脱机率52%,其中康复出院7例,脱机后生存率54%,总生存率28%。辅助时间5~240(84.80±54.73)h。除1例患者未出现并发症外,其他24例患者均有并发症出现(表1),生存组和死亡组组间比较各并发症的发生率均不具统计学显著性差异。死亡原因包括:心功能衰竭10例,感染3例,弥漫性血管内凝血(DIC)2例,多器官功能衰竭、EC⁃MO意外及家属放弃各1例;成功脱离ECMO后死亡的6例患者中,死亡原因分别为心功能不能恢复3例(其中2例为心内畸形矫治不满意)、感染2例、多器官功能衰竭1例。此外,生存组与死亡组心脏手术时ECC和心脏血流阻断时间分别为(196.43±103.63)min vs(293.56±166.02)min和(75.71±46.43)min vs(139.56±83.90)min,P值分别为0.165和0.072。生存组与死亡组ECMO时间分别为16~108(71.57± 34.89)h和5~240(89.94±60.82)h,P=0.463。
表1 两组患者并发症分布(±s)

表1 两组患者并发症分布(±s)
并发症 生存组(例) 死亡组(例)胸腔出血(再次开胸止血) 4 12气道出血 0 2消化道出血 1 3感染 25心功能衰竭 0 10 DIC 0 3溶血 01肾功能衰竭 2 6肝功能衰竭 1 3严重主动脉瓣返流 1 0管道破裂意外 0 1
2.2 血制品使用 ECMO开始后红细胞、新鲜冰冻血浆和血小板使用情况见图1、图2和图3。混合线性模型分析显示:红细胞和血浆使用量显著影响患者预后(P值均<0.001)。
2.3 肾功能变化 血浆肌酐水平见图4。各观察时点生存组和死亡组患者血浆肌酐水平无显著性差异;混合线性模型分析显示血浆肌酐水平对患者预后并无显著影响。11例患者使用腹膜透析技术,其中生存组4例(57.1%),死亡组7例(38.9%),P=0.409。

图1 输红细胞量
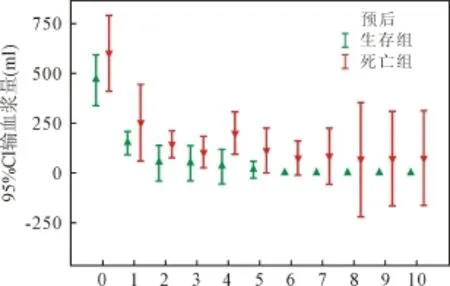
图2 输血浆量
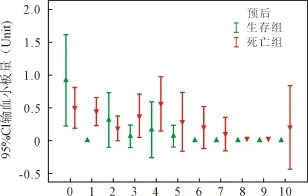
图3 输血小板量
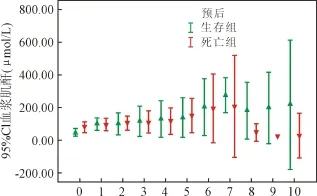
图4 血浆肌酐水平
2.4 肝功能变化 血浆丙氨酸氨基转移酶、总胆红素和结合胆红素水平见图5、图6和图7。混合线性模型分析显示:血浆丙氨酸氨基转移酶和结合胆红素水平显著影响患者预后(P值分别为0.001和0.017);总胆红素水平对患者预后未见显著性影响(P=0.654)。
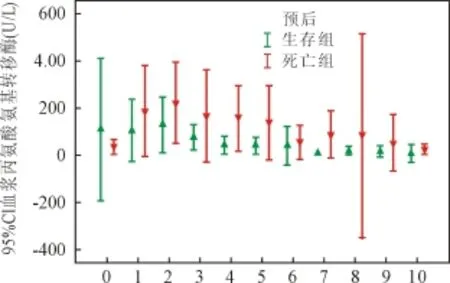
图5 血浆丙氨酸氨基转移酶水平

图6 血浆总胆红素水平

图7 血浆结合胆红素水平
2.5 白细胞计数 血常规白细胞计数水平在死亡组明显高于生存组(图8)。混合线性模型分析显示:白细胞计数水平与患者预后呈显著相关关系(P<0.001)。

图8 白细胞计数
3 讨 论
3.1 ECMO与心脏功能 ECMO循环辅助的目的是帮助心脏功能恢复或为心脏功能恢复提供时间。本组资料显示,患者死亡的最主要原因(10/18)仍是心脏功能衰竭。在ECMO循环辅助适应证方面,外科手术对心脏畸形矫治不全为ECMO难以逾越的障碍。Agarwal等报道:约四分之一的不能脱离ECMO的小儿先心病术后患者存在残存心脏病变,如不能及时诊断和进行处理,患者难以康复[3]。本组患者中心脏畸形纠正不满意的4例患者均死亡,虽然其中2例患者可成功脱离辅助。长时间ECC和心脏血液阻断也是心脏外科术后患者ECMO生存率较低的重要原因。死亡组患者ECC及心脏血流阻断时间明显长于生存组,虽组间未产生显著性差异,主要可能因为ECMO过程中影响因素众多及本组病例数量有限。因此,ECMO开始前应评价患者心脏功能是否可恢复,避免无效辅助。
一般而言,ECMO循环辅助对象是心脏功能可能在1周内恢复的患者[1],延长ECMO辅助时间理论上可能为心脏功能的恢复提供更多的帮助,但临床观察显示长时间辅助使ECMO患者生存率明显降低[4]。国外早期文献报道辅助超过72 h患者生存率将显著下降[5];而最新的文献也认为心脏术后ECMO循环支持超过12 d患者难以存活[6]。在本组生存患者中,最短ECMO时间16 h,平均ECMO时间(71.57±34.89)h,短于死亡组辅助时间。延长ECMO时间并未为患者提供更多的生存机会,特别是对长时间ECC心脏手术及术后心脏停跳抢救患者,其全身状态在一定程度上降低了对ECMO的耐受能力。ECMO辅助过程中辅助流量的选择、充分的左心引流、延迟关胸、及时调整正性肌力药物用量、内环境的改善、营养支持、感染控制等治疗措施均需要积极配合,将ECMO辅助的效益最大化,在促进心脏功能恢复同时尽可能减少或推迟相关并发症的出现。在患者循环及生命体征稳定后,及时综合评估患者状态,尽早撤离辅助。
3.2 出血与抗凝 出血不仅直接影响患者血流动力学稳定,大量异体输血将对患者包括循环、呼吸、血液、免疫等多系统在内的生命器官功能产生负面影响。心脏术后患者ECMO早期胸腔出血和大量异体输血是ECMO失败的重要原因[7]。
对长时间ECC手术患者,即使使用全量鱼精蛋白中和肝素、推迟抗凝治疗和使用抗纤溶药物,EC⁃MO早期胸腔出血的控制仍存在困难。部分复杂先天性心脏病手术后需ECMO支持的病因可能正是ECC状态下难以控制的出血导致的循环不能维持,将患者从完全肝素化的ECC状态转换为ECMO状态并对肝素进行中和,可为止血提供机会。
对术后胸液多的患者,或出现呼吸道、消化道及颅内出血的患者,首先应最大限度控制抗凝治疗。当出血导致生命体征不稳定时,可暂不启动肝素抗凝治疗,即使ACT低于140 s。有文献报道,活化部分凝血活酶间(APTT)对ECMO患者抗凝监测更具可靠性,并可减少出血并发症的发生率[8]。对明显胸腔出血患者,需积极开胸探查,及时终止外科出血,这不仅是减少出血和输血,更是减少凝血因子损耗的最有效方法;此外,及时开胸探查,还可解除心包腔积血或血块对心脏的压塞。处理各种出血并发症的重要及安全方法之一是恢复患者凝血功能,及时和针对性补充血小板、纤维蛋白原等缺失的凝血因子。抗纤溶药物的使用并未明显增加ECMO系统血栓形成的风险。虽有文献报道重组因子Ⅶ可能导致ECMO装置及患者凝血意外,但ECMO状态下的血栓形成并不影响患者的预后[9]。本组2例使用重组因子Ⅶ患者中也未有血栓形成表现。血液回收机对减少红细胞损失有一定帮助,但大量血液回收导致血浆成份的损失对凝血功能存在巨大影响,应尽可能避免使用或缩短其使用时间。
3.3 肝肾功能 肝肾等终末器官的保护直接影响小儿ECMO循环辅助预后[5,10]。本组患者包括长时间手术不能脱离ECC和术后心跳骤停及严重低心排或低氧血症患者,ECMO前均存在不同程度的包括肝肾功能在内的全身性循环障碍和终末器官缺血缺氧性损伤,特别是经历长时间心肺复苏的患者肝肾损害尤为明显。ECMO状态下的非生理性血流、人工循环非生物表面对血液系统的激活、血管收缩药物及存在肝肾功能损害的药物及ECMO早期的出血对血流动力学稳定的影响等因素对肝肾功能可能导致进一步的损害。
生存组和死亡组患者血浆肌酐水平无明显差异,主要获益于透析疗法。生存组接受透析治疗的比例高于死亡组,一定程度上提示了透析治疗对改善预后的积极作用。本组资料提示,ECMO状态下患者出现肾损害,即使恢复也需要较长时间。临床积极使用肾脏替代疗法,不仅为排除体内代谢产物,还可迅速调节水、电解质和酸碱平衡,良好的内环境有助于心肺功能恢复,减少并发症的发生。
血浆丙氨酸氨基转移酶、结合胆红素水平在死亡组显著高于生存组,提示了肝功能损害与患者预后的显著相关性。ECMO过程中应重视护肝治疗和避免使用肝损害药物。血浆胆红素水平上升除与肝损害有关外,与ECMO导致的溶血也有明显关系。一旦发生溶血,应及时更换ECMO装置。因条件限制,本组患者未能对ECMO过程中血浆游离血红蛋白进行监测,也未能对疑似溶血患者进行装置更换。结合胆红素相对更明显的上升在一定程度上提示了ECMO患者胆道可能出现梗阻。鉴于高胆红素血症导致的全身性损害可能加剧ECMO患者全身状况的恶化,血液净化技术可能对ECMO患者有临床使用价值。
3.4 防治感染 外科手术、延迟关胸、长时间辅助循环插管和各种置管、大量异体输血及ECMO非生物表面对免疫功能的影响等众多因素,使感染成为ECMO辅助过程中及脱离ECMO后患者难以回避并对预后存在显著影响的问题。ECMO患者抗感染策略为预防各种并发症的发生及早期重视抗感染措施[11]。早期使用碳青霉烯类和糖肽类二联抗生素,积极进行血液、气道分泌物和体内导管细菌和真菌培养及药敏实验,提高辅助率以缩短ECMO辅助时间,严格执行无菌操作规范及重视患者营养等综合措施对感染的防治和改善患者预后有积极意义。
[1] AnnichGM,Lynch WR,MacLare G,et al.ECMO extracorporeal cardiopulmonary support in critical care[R].Ed4th,Ann Arbor,Michigan,Extracorporeal Life Support Organization.2012.
[2] Paden ML,Conrad SA,Rycus PT,et al.Extracorporeal Life Support Organization Registry Report 2012[J].ASAIO J,2013,59(3):202-210.
[3] Agarwal HS,Hardison DC,Saville BR,et al.Residual lesions in postoperative pediatric cardiac surgery patients receiving extracor⁃poreal membrane oxygenation support[J].J Thorac Cardiovasc Surg,2014,147(1):434-414.
[4] Alsoufi B,Al-Radi OO,Gruenwald C,et al.Extra-corporeal life support following cardiac surgery in children:analysis of risk factors and survival in a single institution[J].Eur J Cardiothorac Surg,2009,35(6):1004-1011.
[5] Aharon AS,Drinkwater DC Jr,Churchwell KB,et al.Extracorporeal membrane oxygenation in children after repair of congenital cardiac lesions[J].Ann Thorac Surg,2001,72(6):2095-2101.
[6] d'Udekem Y,Shime N,Lou S,et al.Recurrent or prolonged me⁃chanical circulatory support:bridge to recovery or road to nowhere[J]?Pediatr Crit Care Med,2013,14(5 Suppl 1):S69-72.
[7] Aubron C,Cheng AC,Pilcher D,et al.Factors associated with out⁃comes of patients on extracorporeal membrane oxygenation support:a 5-year cohort study[J].Crit Care,2013,18;17(2):R73.
[8] Maul TM,Wolff EL,Kuch BA,et al.Activated partial thrombo⁃plastin time is a better trending tool in pediatric extracorporeal membrane oxygenation[J].Pediatr Crit Care Med,2012,13(6):e363-371.
[9] Repessé X,Au SM,Bréchot N,et al.Recombinant factor VIIa for uncontrollable bleeding in patients with extracorporeal mem⁃brane oxygenation:report on 15 cases and literature review[J].Critical Care,2013,17(2):R55.
[10] Costello JM,Cooper DS,Jacobs JP,et al.Intermediate-term outcomes after paediatric cardiac extracorporeal membrane oxygen⁃ation--what is known(and unknown)[J].Cardiol Young,2011,21 Suppl 2:118-123.
[11] Vogel AM,Lew DF,Kao LS,et al.Defining risk for infectious complications on extracorporeal life support[J].J Pediatr Surg,2011,46(12):2260-224.
Extracorporeal membrane oxygenation following cardiac surgery in children:a⁃nalysis of risk factors and prognosis
Zhang Xiao-hua,Zhou Cheng-bin,Chen Ping,Lei Di-si,Zhang Li,Lin Zhong-lin,Peng Qin-bao,Zhuang Jian Department of Cardiovascular Surgery,Guangdong Cardiovascular Institute,Guangdong General Hospital,Guandong Academy of Medical Sciences,Guangdong Guangzhou 510080,China
Objective The purpose of this study was to review our experience and the prognostic factors in the application of extracorporeal membrane oxygenation(ECMO)in pediatric patients after cardiac surgery.Methods Twenty five children received venoarterial ECMO life support postoperative cardiac surgery from Jan.2011 to Mar.2013.The reasons of requiring for ECMO includ⁃ed:unable to wean off bypass in the operating room and acute severe heart failure or hypoxemia in ICU.Clinical and laboratory exami⁃nation data were collected and analyzed between the group of survival and the group of death to determine the factors associated with prognosis.Results Fifty seven complications were presented in 24 patients during and after ECMO.Twelve of the 25 patients(52%)were successfully weaned from ECMO,of which 7(54%)were discharged home.Haemorrhagic events assessed by the red blood cell and fresh frozen plasma received,plasma levels of alanine aminotransferase(ALT)and direct bilirubin,and white blood cell counts during and after ECMO were significant factors associated with hospital mortality.Conclusion ECMO plays a valuable role in children having refractory post operative cardiac failure.Potential for recovery,residual cardiac lesions,volume of blood transfusion,Liver and renal damage,and infection contribute to the outcome for children with ECMO support following cardiac surgery.
Extracorporeal membrane oxygenation;Complication;Prognosis;Cardiac surgery;Children
2014⁃04⁃30)
2014⁃05⁃06)
10.13498/j.cnki.chin.j.ecc.2014.02.02
“十二五”国家科技支撑计划(2011BAI11B22)
510080广州,广东心血管病研究所,广东省人民医院,广东省医学科学院心血管外科
章晓华,Email:zhangxiaohua62@hotmail.com
